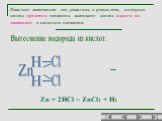
Презентация "Реакции замещения. Электрохимический ряд напряжений." по химии – проект, доклад
Презентацию на тему "Реакции замещения. Электрохимический ряд напряжений." можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 11 слайд(ов).
Слайды презентации
Список похожих презентаций
"Электрохимический ряд напряжений металлов. Общие химические свойства металлов". 11-й класс
Цель урока:. Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. Задачи урока:. Повторить общие химические свойства ...Реакции электрофильного замещения в ароматическом ряду
Реакции электрофильного замещения в ароматическом ряду. Ароматические соединения. Характерны реакции замещения, в первую очередь электрофильного, ...Электрохимический ряд напряжений металлов
Металлы.Нахождение в природе.
Внешний вид и условия хранения.
Получение металлов.
Химические свойства металлов.
Соединения металлов.
Оксиды ...
Реакции ароматического нуклеофильного замещения
Реакции ароматического нуклеофильного замещения. Реакции SNAr Ar-B + C- ArC + B-. Ароматические соединения. Характерны реакции замещения, в первую ...Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс
Верите ли Вы,что... Металлы занимают верхний левый угол в ПСХЭ. В кристаллах атомы металла связаны металлической связью. Валентные электроны металлов ...Реакции соединения
Карточка № 1. Явления. 1. При нагревании вода превращается в пар (физическое) 2. При сильном измельчении кусочек мела превращается в белый порошок ...Реакции разложения
Химическими реакциями называют такие превращения веществ, в результате которых образуются новые соединения и при этом не происходит образования новых ...Реакции окисления и восстановления органических соединений
Реакции окисления-восстановления реакции, в ходе которых происходит изменение степени окисления одного или нескольких атомов углерода. 4 (3)+(+1)= ...Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
Ионные реакции – реакции протекающие между ионами в растворе. Порядок составления ионных уравнений реакции. 1. Записывают молекулярное уравнение реакции ..."Реакции нейтрализации"
Заполните таблицу. mв(NaCl) mp(NaCl) m(H2O) ω(NaCl) 20 г 80 г 100 г 120 г 200 г 40 % 15 г 135 г 150 г 10 % 01.11.2018. Ким Е.П., урок химии (УМК В.В. ...Электролитическая диссоциация веществ. Реакции ионного обмена и условия их протекания
1. Веществом, при диссоциации которого образуются катионы металла и анионы кислотного остатка, является. А. NH4NO3 Б. HNO3 В. NaOH Г. Na2SO4. 2. К ...Реакции ионного обмена
Получение гидроксида меди (II). I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2 + Ba(OH)2 = Cu(OH)2 + BaBr2 3 группа: Cu(NO3)2 + 2NaOH = Cu(OH)2 ...Реакции ионного обмена
Ошибка. Убери лишнее. (Найдите неэлектролиты). NaOH NaCl K2SO4 H2SO4 CaCO3 Mg(NO3)2 CuCl2 BaSO4 CaSO4 Cu(OH)2 SО3 FeCl3 NaNO3 Ca(OH)2 Al(NO3)3 Na2CO3. ...Реакции веществ
Цель создания данной работы – показать возможности использования мультимедийных технологий и интерактивной доски на уроках химии. Фрагменты презентаций ...Реакции в органической химии
Важнейшие реакции в органической химии. Типы химических реакций по числу и составу реагирующих веществ. . Виды органических реакций. . . . . . ...Химические уравнения. Реакции обмена
24.05.2019 Лебедева Л.В.Повторим изученный материал.
Какое слово зашифровано в таблице?
2Na+2HCl=2NaCl +H2↑ 2Al + 3S = Al2S3 Al(OH)3 = Al2O3 + ...
Реакции ионного обмена
ЦЕЛЬ урока: сформировать понятие о реакциях ионного обмена. ЗАДАЧИ: Образовательные: познакомить учащихся с реакциями ионного обмена и условиями их ...Реакции ионного обмена. Ионные уравнения
Определите тип данной реакции по числу и составу веществ вступивших и образующихся в реакции AqNO3 + HCl = AqCl + HNO3. реакция обмена. Технологическая ..."Реакции ионного обмена"
Реакции обмена протекают между ионами, поэтому они называются реакциями ионного обмена Реакции ионного обмена идут до конца в трех случаях. Если образуется ...Конспекты
Типы химических реакций. Реакции разложения, соединения, замещения
Разработка урока:. «Типы химических реакций. . . Реакции разложения, соединения, замещения». . Разработала:. . учитель химии. ...Реакции разложения
Урок по теме: «Реакции разложения». Цель урока:. . Изучить механизм реакций разложения. Познакомиться с понятиями «катализатор», «фермент». Отработать ...Реакции обмена. Реакция нейтрализации
Урок химии в 8 классе. по теме: «Реакции обмена. Реакция нейтрализации». Максимова Светлана Юрьевна, учитель химии. Цель урока:. . повторить ...Реакции обмена
МБОУ Ясенецкая СОШ. Павловский район. Нижегородская область. . Конспект урока. . Предмет : химия. Программа :. . О.С. Габриелян « ...Реакции обмена
Урок химии, 8 класс (базовый уровень). Учитель : Серебрякова Елена Васильевна. МОУ СОШ № 9,г.Георгиевска. Тема урока: Реакции обмена. Задачи:. ...Алкены. Гомологический ряд, номенклатура, изомерия, получения
Конспект урока на тему. «Алкены. Гомологический ряд, номенклатура, изомерия, получения». Цель:. - познакомиться с этиленовыми углеводородами, ...Типы химических реакций. Реакции обмена
Разработка урока по теме: "Типы химических реакций. Реакции обмена.". Цели урока:. Образовательная. -. актуализация знаний обучающихся о ...Степень окисления. Реакции окисления – восстановления
Урок- упражнение , 8 класс. Степень окисления. Реакции окисления – восстановления. . . Цели урока:. Образовательные:. - повторить основные ...Реакции ионного обмена и условия их протекания
Дата ______________ Класс_______________. Тема: Реакции ионного обмена и условия их протекания. Цели урока:. продолжить формирование навыков составления ...Реакции ионного обмена и условия их протекания
Тема урока:. Реакции ионного обмена и условия их протекания. Тип урока. : Урок новых знаний. Вид урока:. Проблемно – исследовательский. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:9 мая 2018
Категория:Химия
Содержит:11 слайд(ов)
Поделись с друзьями:
Скачать презентацию