Презентация "Спирты. Предельные одноатомные спирты" по химии – проект, доклад
Презентацию на тему "Спирты. Предельные одноатомные спирты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Предельные одноатомные спирты
Определение спиртов Классификация спиртов Номенклатура Изомерия Физические свойства Аномалии у спиртов Химические свойства Физиологическое действие ...Алканолы - Предельные одноатомные спирты
Определение спиртов Классификация спиртов Номенклатура Изомерия Физические свойства Аномалии у спиртов Химические свойства Физиологическое действие ...Одноатомные спирты
Цели и задачи :. узнать о представителях класса спиртов, их классификации изучить изомерию и номенклатуру класса. Научиться решать тестовые задания ...Одноатомные спирты
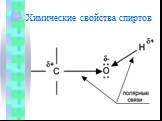
СПИРТЫ И ФЕНОЛЫ. Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. Вещества, ...Одноатомные спирты
Спиртами называются соединения, содержащие одну или несколько гидроксильных групп. По их числу спирты подразделяются на одноатомные, двухатомные, ...Многоатомные спирты кратко
Многоатомные спирты (полиспирты, полиолы) — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Фенолы ...Многоатомные Спирты и их строение
Глицерин (пропантриол-1,2,3) - простейший представитель трёхатомных спиртов. Представляет собой вязкую прозрачную жидкость, очень гигроскопична, смешивается ...Многоатомные спирты
Термин. Представители многоатомных спиртов — этиленгликоль и глицерин. Двухатомные спирты, содержащие две гидроксильные группы—ОН, называются гликолями, ...Многоатомные спирты
Вопросы для повторения. Какими способами может быть получен этиловый спирт? Назовите условия промышленного процесса гидратации этилена и дайте им ...Многоатомные спирты
Многоатомные спирты. Многоатомные спирты – это органические соединения, в молекулах которых содержатся две или более гидроксильных групп, соединенных ...Многоатомные спирты
Цель урока:. Познакомить учащихся со строением, физическими и химическими свойствами многоатомных спиртов,значением и применением их в промышленности ...Многоатомные спирты
Многоатомные спирты — органические соединения класса спиртов, содержащие в своём составе более одной гидроксильной группы. Особое значение многоатомные ...Спирты или алканолы
Строение. Спиртами называют органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп – ОН),соединённых с углеводородным ...Спирты
План урока. Понятие о спиртах. Метанол. Этанол. Глицерин. Д/З : § 35, В. 1 и 3. 1.Понятие о спиртах. Если в молекулах У.В. атом водорода заместить ...Спирты и фенолы
Сегодня на уроке:. вы повторите, что такое спирты и фенолы;. вы узнаете о губительном действии этанола на организм человека;. вы выполните упражнения ...Спирты и фенолы
Спирты – органические соединения, содержащие одну или более гидроксильных групп (гидроксил-ОН), непосредственно связанных С насыщенным атомом углерода. ...Спирты 1
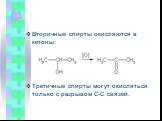
Классификация спиртов. По числу гидроксильных групп спирты делятся на: Одноатомные: СН3ОН-метанол, С2Н5ОН-этанол Двухатомные: НО-СН2-СН2-ОН-этандиол-1,2 ...Спирты - в жизни человека
Цели урока:. Образовательная: Сформировать у учащихся представления о строении и свойствах спиртов. Подвести учащихся к осмыслению понятий: «Древесный ...Спирты
Номенклатура спиртов. По международной номенклатуре ИЮПАК названия дают от названий радикалов, а также из названий углеводородов прибавлением окончания ...Спирты
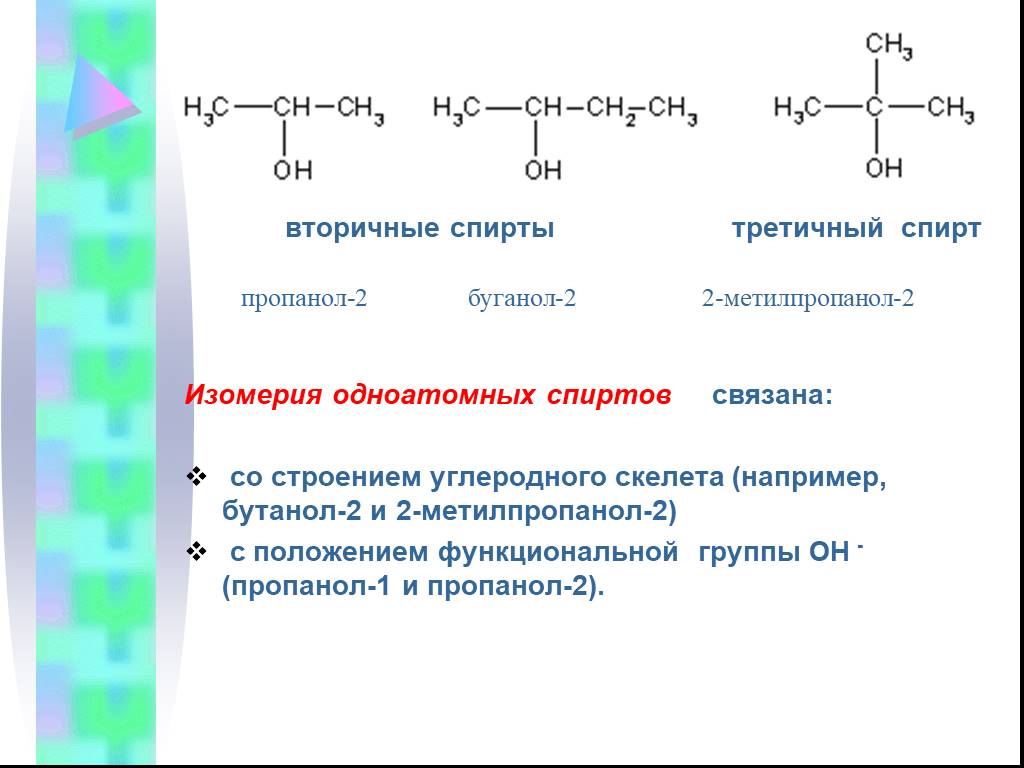
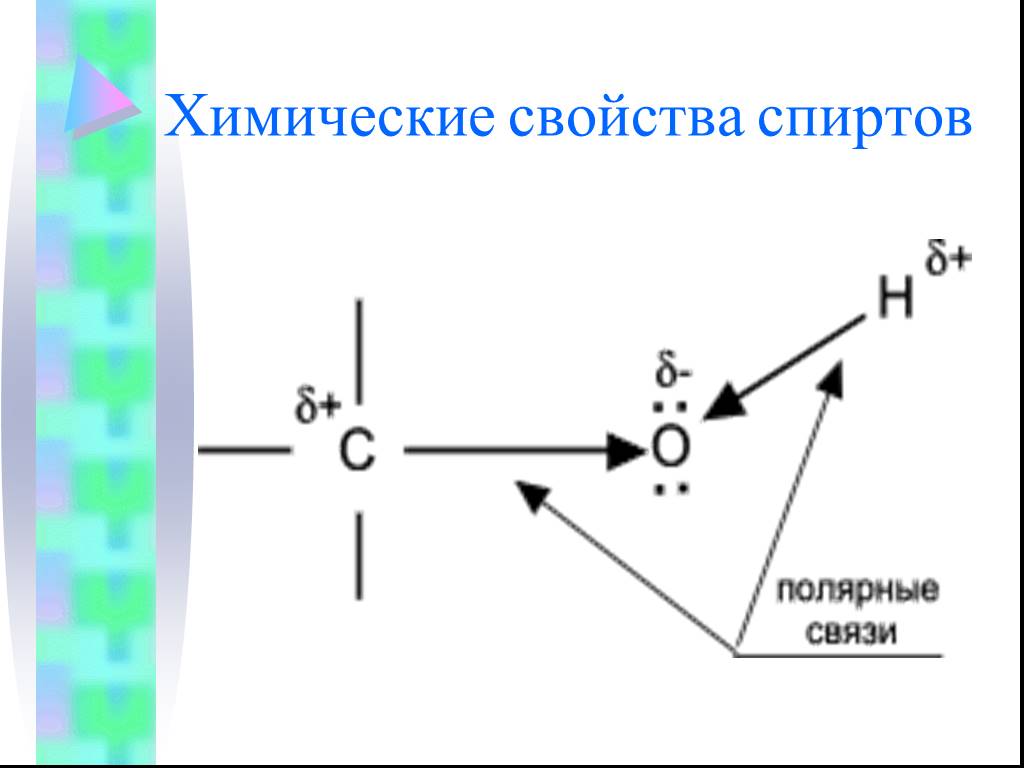
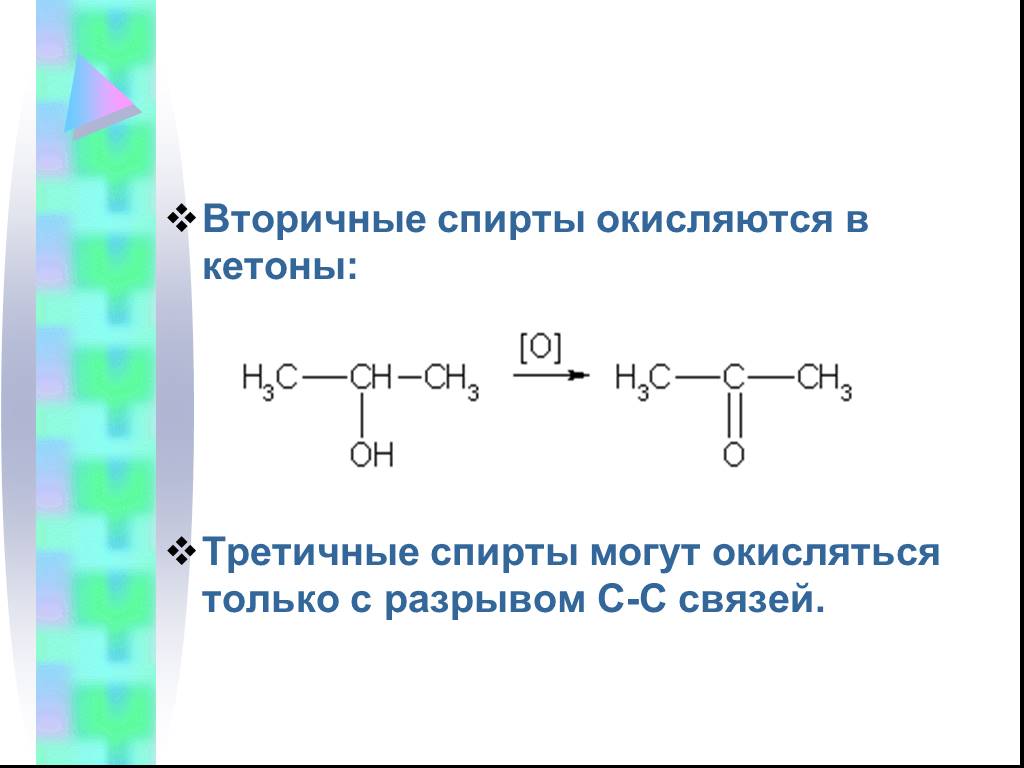
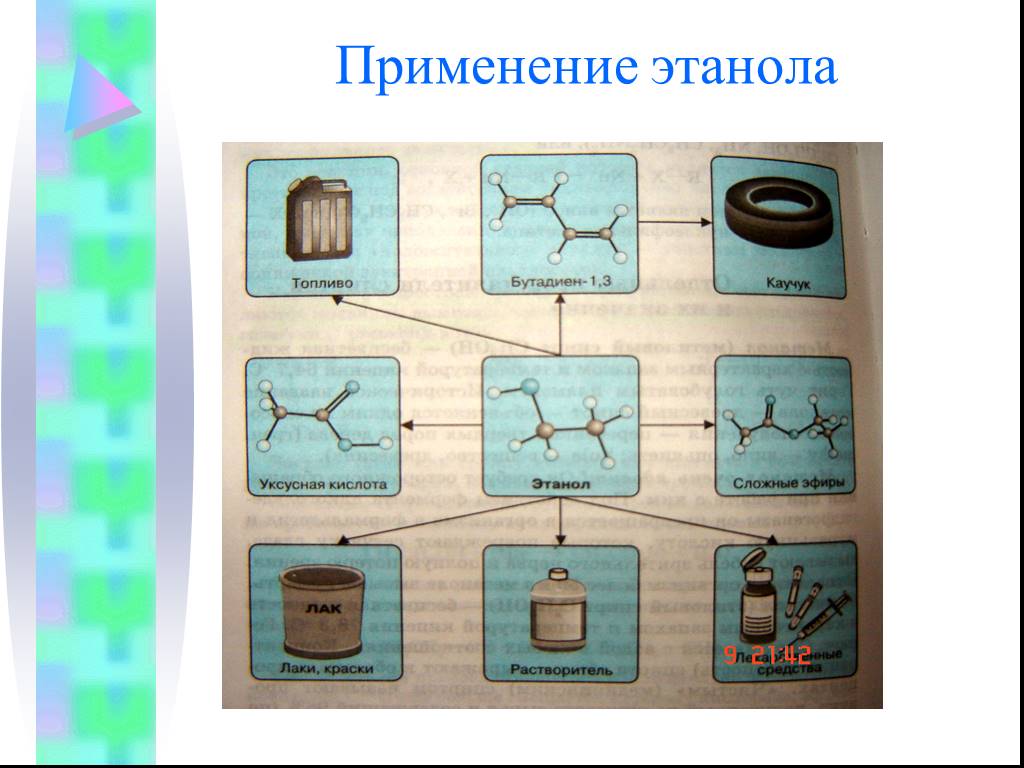
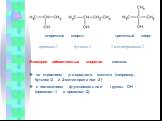
Предельные одноатомные cпирты. Общая формула. C n H 2n + 1 OH или R – OH, где R- углеводородный радикал. Это органические соединения, в молекулах ...Конспекты
Спирты. Предельные одноатомные спирты
Муниципальное бюджетное образовательное учреждение. «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 3». . . . Конспект урока по химии. в 10 классе. ...Предельные одноатомные спирты
МОУ «Мочалищенская СОШ». Конспект урока для учащихся 10 класса по теме «Предельные одноатомные спирты». ТЕМА:. «Влияние алкоголя на состояние здоровья ...Предельные одноатомные спирты
Технологическая карта урока. Предмет Химия__________________________________________________________. Класс__10__(1 час)__________________________________________________________. ...Предельные одноатомные спирты
Технологическая карта урока. Учитель: Валуева В.В. Предмет химия. Класс 10. Автор УМК О.С.Габриелян. Тема урока Предельные одноатомные спирты. ...Кислородсодержащие органические соединения. Предельные одноатомные спирты
Государственное общеобразовательное учреждение -. средняя общеобразовательная школа. при Посольстве России в Турции. Конспект урока по химии ...Одноатомные спирты
11 класс. Тема урока:. «Одноатомные спирты». Цель урока:. ознакомление учащихся с новым классом органических соединений – спиртами. Задачи:. ...Одноатомные спирты
Урок:. . Тема: Одноатомные спирты. Цели урока:. 1.Дать учащимся первоначальные понятия о кислородсодержащих. . веществах. Познакомить с составом ...Одноатомные спирты
Автор:. Красильникова Наталья Александровна. Полное название образовательного учреждения:. Муниципальное общеобразовательное учреждение Шарловская ...Насыщенные одноатомные спирты: состав, строение, свойства, получение
Урок химии в 11 классе. Тема урока. . Насыщенные одноатомные спирты: состав, строение, свойства, получение. Тип урока. : изучение нового материала. ...Многоатомные спирты
. . Тема: «Многоатомные спирты». Тип методического пособия –. методическая разработка урока. Предмет:. химия. 1. Цели:. Сформировать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 февраля 2019
Категория:Химия
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию