Презентация "Реакции веществ" по химии – проект, доклад
Презентацию на тему "Реакции веществ" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 20 слайд(ов).
Слайды презентации
Список похожих презентаций
Обобщение сведений об основных классах неорганических веществ
Цель урока. Обобщение и систематизация знаний по основным классам неорганических веществ. Задачи урока. 1)образовательная: а)отработать умение записывать ...Свойства веществ вода
Количество ВОДЫ на поверхности Земли оценивается в 1,39×1018 т. ПРЕСНЫХ ВОД в реках, озерах, болотах и водохранилищах составляет 2×104 т. Масса ледников ...Многообразие веществ
1. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит. Название вещества Класс ...Реакции ионного обмена
Получение гидроксида меди (II). I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2 + Ba(OH)2 = Cu(OH)2 + BaBr2 3 группа: Cu(NO3)2 + 2NaOH = Cu(OH)2 ...Реакции окисления и восстановления органических соединений
Реакции окисления-восстановления реакции, в ходе которых происходит изменение степени окисления одного или нескольких атомов углерода. 4 (3)+(+1)= ...Причины многообразия веществ
Цель урока:. рассмотреть состав, строение веществ и выявить причины их многообразия. Вещества (по строению). молекулярные, или дальтониды (имеют постоянный ...Реакции ароматического нуклеофильного замещения
Реакции ароматического нуклеофильного замещения. Реакции SNAr Ar-B + C- ArC + B-. Ароматические соединения. Характерны реакции замещения, в первую ...Взаимосвязь путей обмена веществ
Включение безазотистого остатка аминокислот в общий путь катаболизма. Взаимосвязь гликолиза и гликонеогенеза. Гликонеогенез из липидов. дегидро-геназа. ...Влияние химических веществ на рост и развитие растений
Цель исследования: выяснить стимулирующее влияние обработки семян различными химическими веществами на развитие растений фасоли. Гипотеза: Обработка ...Важнейшие классы неорганических веществ
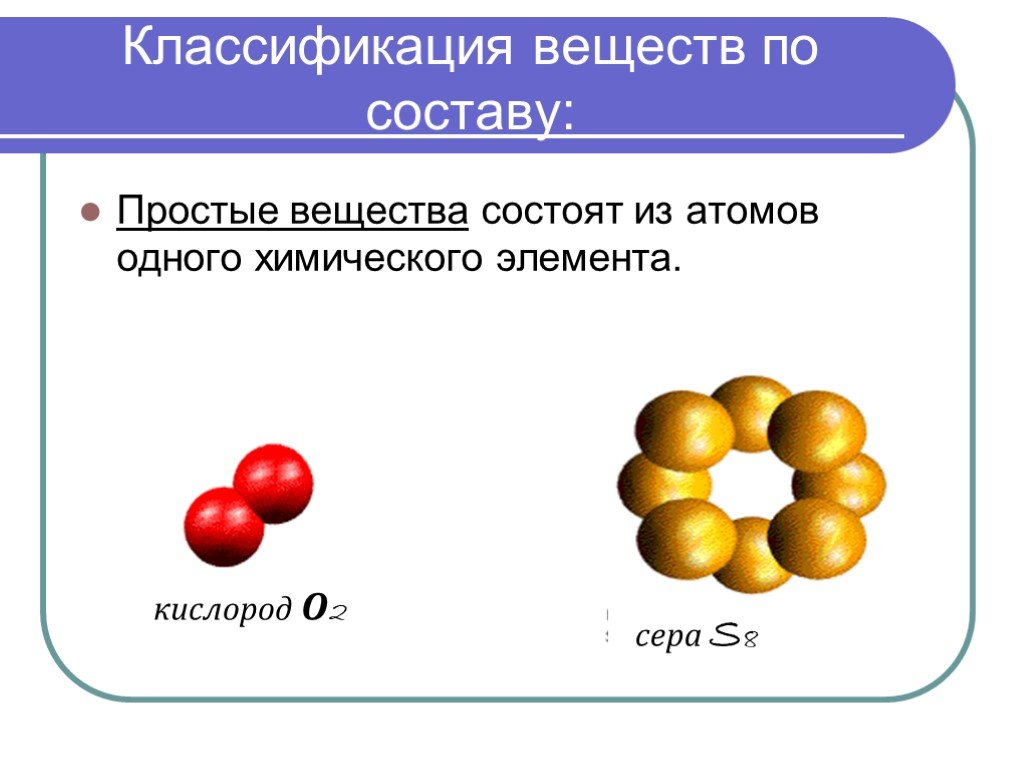
Неорганические вещества. Простые Сложные. Простые вещества Металлы Неметаллы. Сложные вещества. Оксиды - сложные вещества, состоящие из двух химических ...Вещество. Свойства веществ
Вещество-это то, из чего состоит физическое тело. Задание. Нарисуйте тела для перечисленных веществ. тело вещество. Стекло Пластмасса древесина. Вещество ...Большой круговорот веществ
КРОССВОРД К О Р М И Л Ь Ц Ы М У С О Р Щ И К И Е Д О К И Б О Ф Р А 1 3 4. КРУГОВОРОТ ВЕЩЕСТВ. ЧИСТЫЙ ВОЗДУХ ЧИСТАЯ ВОДА ПРОДУКТЫ ДУШНЫЙ ВОЗДУХ ГРЯЗНАЯ ..."Реакции нейтрализации"
Заполните таблицу. mв(NaCl) mp(NaCl) m(H2O) ω(NaCl) 20 г 80 г 100 г 120 г 200 г 40 % 15 г 135 г 150 г 10 % 01.11.2018. Ким Е.П., урок химии (УМК В.В. ..."Реакции ионного обмена"
Реакции обмена протекают между ионами, поэтому они называются реакциями ионного обмена Реакции ионного обмена идут до конца в трех случаях. Если образуется ...Основные классы неорганических веществ
Вспомним теорию. Какие вещества вы знаете? Какие вещества назы- ваются сложными? Что такое оксиды,кис- лоты,основания и соли? Распределить вещества ...Генетическая связь веществ
Найдите ошибки в уравнениях:. Na+SO42- + Ba2+Cl- = BaSO4 + NaCl Ba + SO4 = BaSO4. CaO, CO2 , MgO, C, H2CO3, Ca, NaCl, Ca(OH)2, NaOH, CaCO3, H2SO4. ...Превращения веществ
Интегрированный урок по окружающему миру и химии по теме. «Тела и вещества. Превращения веществ». Цель урока:. Подвести учащихся к пониманию термина ...Генетическая связь между классами неорганических веществ
Взаимосвязь между классами веществ выражается генетическими цепочками. Генетический ряд – это осуществление химических превращений, в результате которых ...Распространенные названия некоторых неорганических веществ
От названий к формулам. . . . MnO2 (диоксид марганца) – пиролюзит CrO3 (оксид хрома (VI)) – хромовый ангидрид. KClO и KCl – жавелевая вода NaClO и ...Генетическая связь между классами неорганических веществ
А13-6-2009. В схеме превращений веществом «X2» является 1) Fe2O3 2) FeO 3) FeCl3 4) FeCl2. А13-2-2009. В схеме превращений веществами «X1» и «X2» ...Конспекты
Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной массе, количеству вещества или объему одного из вступающих или получающихся в реакции веществ
Дата_____________ Класс_______________. Тема:. . Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной ...Реакции ионного обмена
Реакции ионного обмена. Цели урока:. обучающая. . – раскрыть суть протекания химических реакций в растворах электролитов; сформировать умение предвидеть ...Путешествие в мир веществ
Балыклинский филиал ГБОУ СОШ с.Камышла. Урок химии в 8 классе. «Путешествие. в мир веществ. ». . Цели:. Отработать умения, ...Предмет органической химии. Особенности строения органических веществ
Муниципальное бюджетное образовательное учреждение. . «Аргуновская средняя общеобразовательная школа». Никольский район. Вологодская область. ...Вода, как растворитель веществ
Тема урока: «Вода, как растворитель веществ». Цели урока:. . формирование учебно-познавательного интереса к новому способу действия через работу ...Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена. . . Цели урока:. Образовательная. -. актуализация знаний обучающихся о типах химических реакций, классификации ...Реакции разложения
Урок по теме: «Реакции разложения». Цель урока:. . Изучить механизм реакций разложения. Познакомиться с понятиями «катализатор», «фермент». Отработать ...Реакции обмена
Ф.И.О. автора. –. Желовникова Оксана Викторовна. . . Место работы - ГБОУ СОШ п. Комсомольский м.р. Кинельский Самарской области. Должность- ...Гидролиз неорганических веществ
Тема « Гидролиз солей» рассчитана по программе на 2 часа. Целью всей темы является усвоение понятия гидролиз соли и отработка умения составлять уравнения ...Генетическая связь между классами веществ
Муниципальное общеобразовательное учреждение. лицей № 9. имени заслуженного учителя школы Российской Федерации А.Н.Неверова Дзержинского района ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:16 марта 2019
Категория:Химия
Содержит:20 слайд(ов)
Поделись с друзьями:
Скачать презентацию