Презентация "Монооксид углерода: угарный газ" по химии – проект, доклад
Презентацию на тему "Монооксид углерода: угарный газ" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
Угарный газ
Физические свойства. Монооксид углерода представляет собой бесцветный и не имеющий запаха газ, малорастворимый в воде. t пл. 205 °С, t кип. 191 °С ...Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
В 300 мг 20% раствора HNO3 растворили 10 мл аммиака. Определить массу полученной соли. Задача:. CO2 углекислый газ Без цвета Без запаха В воде растворяется ...Оксид углерода (IV) - углекислый газ
Физические свойства CO2. Оксид углерода (IV) – бесцветный газ, без запаха, со слегка кисловатым вкусом; примерно в 1,5 раза тяжелее воздуха, хорошо ...Угарный газ
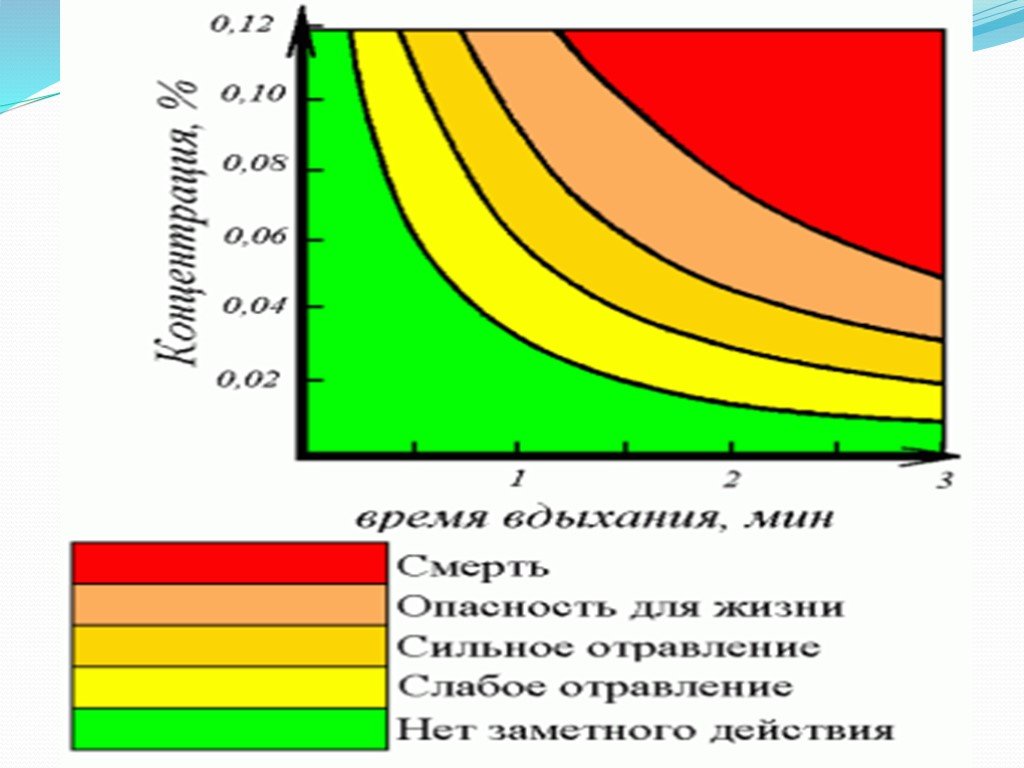
Что такое угарный газ? Методы получения угарного газа. Физиологическое действие угарного газа на организм. Что такое угарный газ? Угарный газ (оксид ...Строение атома углерода
↓ ↓↑. Валентность углерода IV. Валентность углерода II. Строение атома углерода. 6 С 2е4е 1S2 2S2 2P2 6 С 2е4е 1S2 2S1 2P3. Гибридизация. Гибридизация ...Идеальный газ
«Посев научный взойдет для жатвы народной!» (Дмитрий Иванович Менделеев). Ответить на вопросы. Что такое идеальный газ? Назовите условия, при которых ...Природный газ
Оглавление. Природный газ Мировые запасы ПГ на карте мира Запасы ПГ в Украине Состав ПГ Химические свойства Переработка Применение. Природный газ ...Кислородные соединения углерода
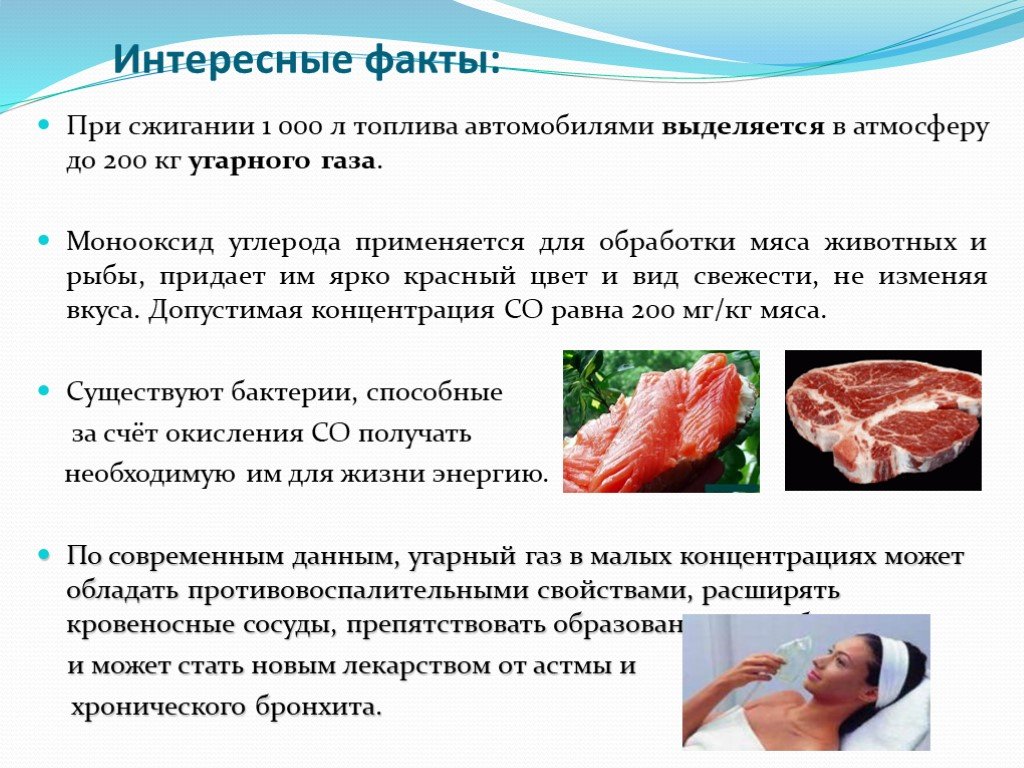
Угарный газ (СО)содержится в выхлопных газах автомобилей. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2. План изучения веществ. Состав ...Подгруппа углерода и азота
Цель урока:. Закрепить и обобщить знания об основных физических и химических свойствах углерода, азота и их соединений. Продолжить формировать умение ...Природный газ
одно из важнейших горючих ископаемых, занимающие ключевые позиции в топливно-энергетических балансах многих государств, важное сырьё для химической ...Круговорот углерода в природе
Самый интенсивный биогеохимический цикл - круговорот углерода. Вся земная жизнь основана на углероде. Каждая молекула живого организма построена на ...Фуллерены – молекулярная форма углерода
Виды молекул фуллеренов: чётное число атомов углерода в молекуле С60, С70, С72, С74, С76, С108, С960 и т.д. Поверхность «мяча» образована пяти- и ...Круговорот углерода в природе
Вся земная жизнь основана на углероде. Каждая молекула живого организма построена на основе углеродного скелета. Атомы углерода постоянно мигрируют ...Круговорот углерода в природе
Самый интенсивный биогеохимический цикл круговорот углерода. В природе углерод существует в двух основных формах в карбонатах (известняках) и углекислом ...Круговорот углерода в биосфере
цели урока. - Выяснить, какие организмы участвуют в круговороте углерода - Составить схему процесса круговорота углерода. - Проследить и уточнить ...Круговорот углерода
КРУГОВОРОТ УГЛЕРОДА. Зависит как от биохимических, так и от физических процессов. АТМОСФЕРНЫЙ УГЛЕКИСЛЫЙ ГАЗ. Наиболее доступный источник углерода, ...Кислородные соединения углерода
Взаимопроверка. Отметка: 10 правильных ответов – «5» 8-9 правильных ответов – «4» 5-7 правильных ответов – «3» Менее 5 – «2». Урок химии в 9 классе ...Углекислый газ
Структурная формула углекислого газа. О=С=О. Молекулярная формула углекислого газа. СО2. Физические свойства. Оксид углерода (IV) – бесцветный газ, ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Углекислый газ CO2
Углекислый газ бесцветный, без запаха. Он почти в 1,5 раза тяжелее воздуха. При обычных условиях в одном объёме воды растворяется один объём углекислого ...Конспекты
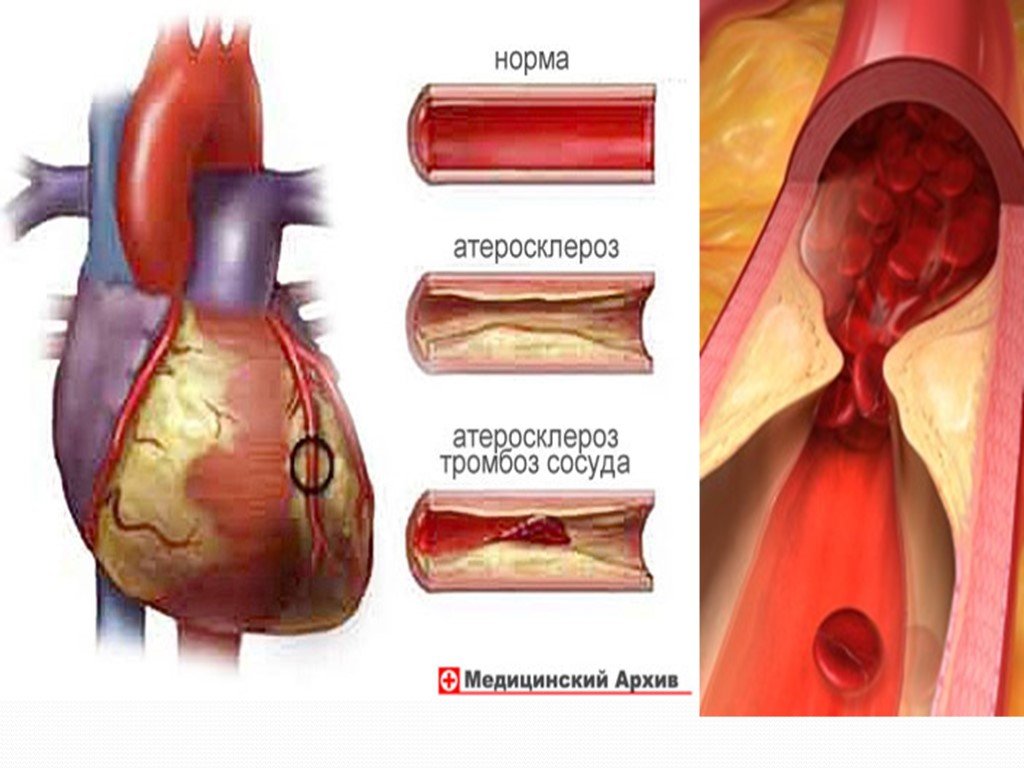
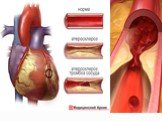
Угарный газ, свойства, физиологическое действие на организм
КОУ ВО «Таловская школа-интернат для детей-сирот и детей, оставшихся без попечения родителей». Урокпо химии в 9 классе. Тема:. Угарный газ, ...Угарный газ, свойства, физиологическое действие на организм
Дата_____________ Класс_______________. Тема:. . Угарный газ, свойства, физиологическое действие на организм. Цели урока:. знать состав, строение, ...Углерод. Соединения углерода
Обобщающий урок по теме» Углерод. Соединения углерода». Форма урока -урок-аукцион. Девиз урока. :. . Бесконечные его соединения. Какие образует ...Углерод, аллотропия углерода. Химический свойства и применение углерода
Конспект урока по теме:. «Углерод, аллотропия углерода, физические и химический свойства. . . Применение углерода.». Выполнила:. Учитель ...Углекислый газ, угольная кислота и ее соли
Дата_____________ Класс_______________. Тема:. . Углекислый газ, угольная кислота и ее соли. . Цели урока:. знать состав, строение, свойства ...Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязненияПриродные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения
Дата_____________ Класс_______________. Тема:. Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха ...Суд над оксидом углерода (II)
Урок – игра. . . «Суд над оксидом углерода (. II. )». Урок химии в 9 классе. . Цели: 1) обобщение и углубление знаний об оксиде углерода( ...Превращения углерода в природе
МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №5 ИМЕНИ Ю.А.ГАГАРИНА г. ТАМБОВА. Интегрированное ...Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Углерод, аллотропные модификации
Дата_____________ Класс_______________. Тема:. . Положение углерода и кремния в периодической системе химических элементов, строение их атомов. ...Оксиды углерода (II) и (IV). Карбонаты
Открытый урок по химии в 9 классе по теме:. . . «Оксиды углерода (. II. ) и (. IV. ). Карбонаты». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 октября 2018
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию