Презентация "Углекислый газ" по химии – проект, доклад
Презентацию на тему "Углекислый газ" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Углекислый газ
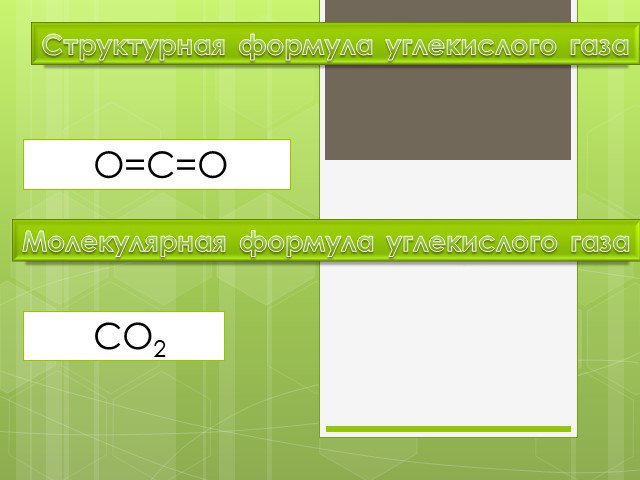
Молекулярная формула углекислого газа СО2 . Проанализируйте молекулярную формулу этого вещества и ответьте на вопросы: 1. Какой качественный и количественный ...Углекислый газ
В сказочном царстве, химическом государстве жил-был граф Углерод. Он был очень важной персоной, так как находился в родстве со всеми живыми организмами. ...Углекислый газ CO2
Углекислый газ бесцветный, без запаха. Он почти в 1,5 раза тяжелее воздуха. При обычных условиях в одном объёме воды растворяется один объём углекислого ...Углекислый газ
I. Строение молекул углекислого газа. Молекулы углекислого газа всегда состоят из двух атомов кислорода и одного атома углерода. Получить молекулу ...СО2 углекислый газ
Цель:. Доказать кислотный характер углекислого газа и изучить его биологическую роль. _____. 1)Исследовать водный раствор СО2; 2)Изучить взаимодействие ...Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
В 300 мг 20% раствора HNO3 растворили 10 мл аммиака. Определить массу полученной соли. Задача:. CO2 углекислый газ Без цвета Без запаха В воде растворяется ...Оксид углерода (IV) - углекислый газ
Физические свойства CO2. Оксид углерода (IV) – бесцветный газ, без запаха, со слегка кисловатым вкусом; примерно в 1,5 раза тяжелее воздуха, хорошо ...Природный газ - добыча и использование
Природний газ - суміш газів , що утворилася в надрах землі при анаеробному розкладанні органічних речовин Природний газ є корисною копалиною. Часто ...Углеводороды и их природные источники. Прородный газ
Углеводороды-это класс органических соединений,молекулы которых состоят только из углерода и водорода. Наиболее распространенными природными источниками ...Угарный газ
Что такое угарный газ? Методы получения угарного газа. Физиологическое действие угарного газа на организм. Что такое угарный газ? Угарный газ (оксид ...Угарный газ
Физические свойства. Монооксид углерода представляет собой бесцветный и не имеющий запаха газ, малорастворимый в воде. t пл. 205 °С, t кип. 191 °С ...Природный и попутный газ, их переработка. Коксохимическое производство
Природные источники углеводородов. Нефть Уголь Природный газ. Попутный нефтяной газ. Способы добычи природного газа и нефти. Состав: СН4 – основа(до ...Монооксид углерода: угарный газ
Цель работы: изучение темы и углубление знаний по химии. Задачи: усвоение новых знаний; пропаганда необходимости бережного отношения к своему здоровью, ...Природный газ
Оглавление. Природный газ Мировые запасы ПГ на карте мира Запасы ПГ в Украине Состав ПГ Химические свойства Переработка Применение. Природный газ ...Природный газ
Состав Физические свойства Основные месторождения Методы переработки Использование. Состав. Физические свойства. Плотность: от 0,68 до 0,85 кг/м³ ...Природный газ
одно из важнейших горючих ископаемых, занимающие ключевые позиции в топливно-энергетических балансах многих государств, важное сырьё для химической ...Природный газ
Цель урока. Познакомить с природными источниками углеводородов: природным и попутным нефтяными газами, и продуктами их переработки. Задачи урока. ...Природный и попутный газ
Состав природнго и попутного газов. Природный Основной составной частью природного газа является метан (CH4). Кроме метана в состав природного газа ...Природный и попутный газ
Природный газ. одно из важнейших горючих ископаемых, занимающие ключевые позиции в топливно-энергетических балансах многих государств, важное сырьё ...Чадний газ
Що таке монооксид вуглецю. Моноокси́д вуглецю́,карбону (II) оксид, монооксид Карбону, чадний газ CO — безбарвний, дуже отруйний газ без запаху. Утворюється ...Конспекты
Углекислый газ, угольная кислота и ее соли
Дата_____________ Класс_______________. Тема:. . Углекислый газ, угольная кислота и ее соли. . Цели урока:. знать состав, строение, свойства ...Угарный газ, свойства, физиологическое действие на организм
КОУ ВО «Таловская школа-интернат для детей-сирот и детей, оставшихся без попечения родителей». Урокпо химии в 9 классе. Тема:. Угарный газ, ...Угарный газ, свойства, физиологическое действие на организм
Дата_____________ Класс_______________. Тема:. . Угарный газ, свойства, физиологическое действие на организм. Цели урока:. знать состав, строение, ...Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязненияПриродные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха от загрязнения
Дата_____________ Класс_______________. Тема:. Природные источники углеводородов. Нефть и природный газ, их применение. Защита атмосферного воздуха ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Химия
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию