Презентация "Определение солей аммония" по химии – проект, доклад
Презентацию на тему "Определение солей аммония" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
Соли аммония
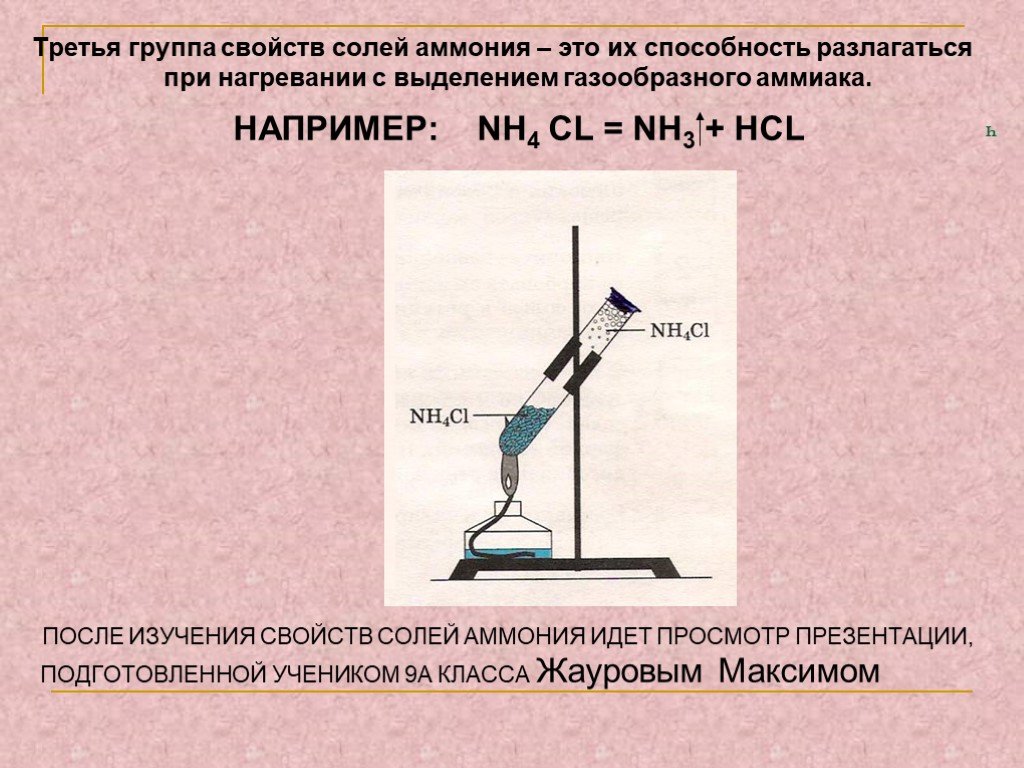
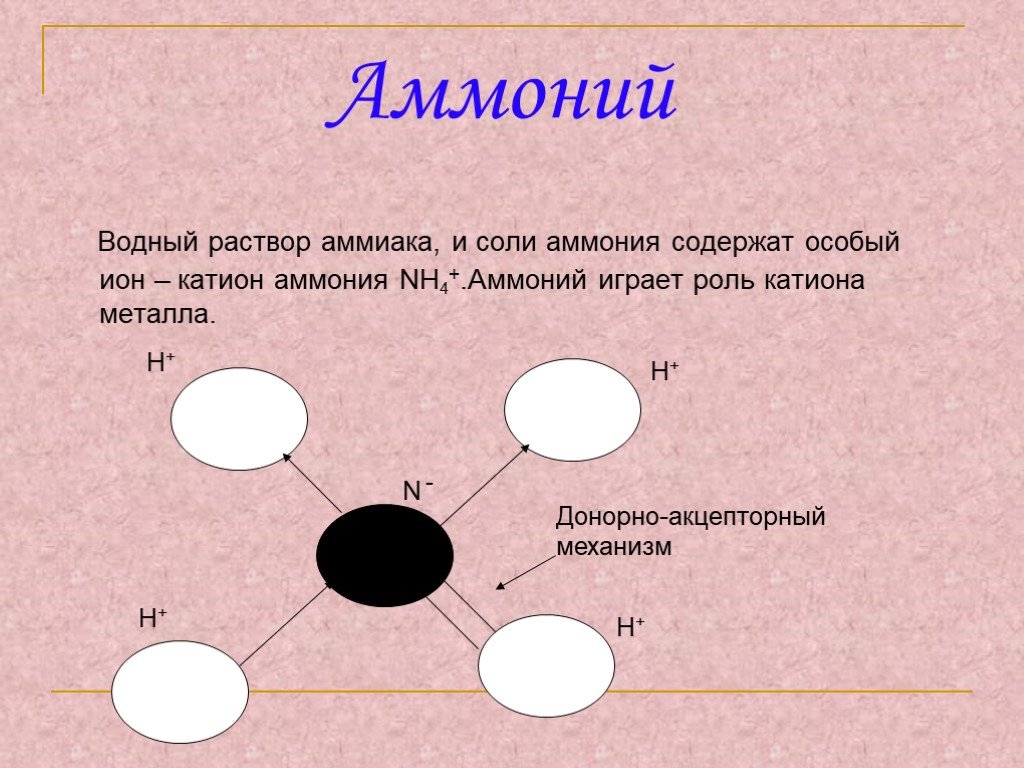
КАТИОН АМОНИЯ. Катион аммония NH4 играет роль катиона метала и образует с кислотными остатками соли: NH4NO3 – нитрат аммония, или аммиачная селитра. ...Соли аммония
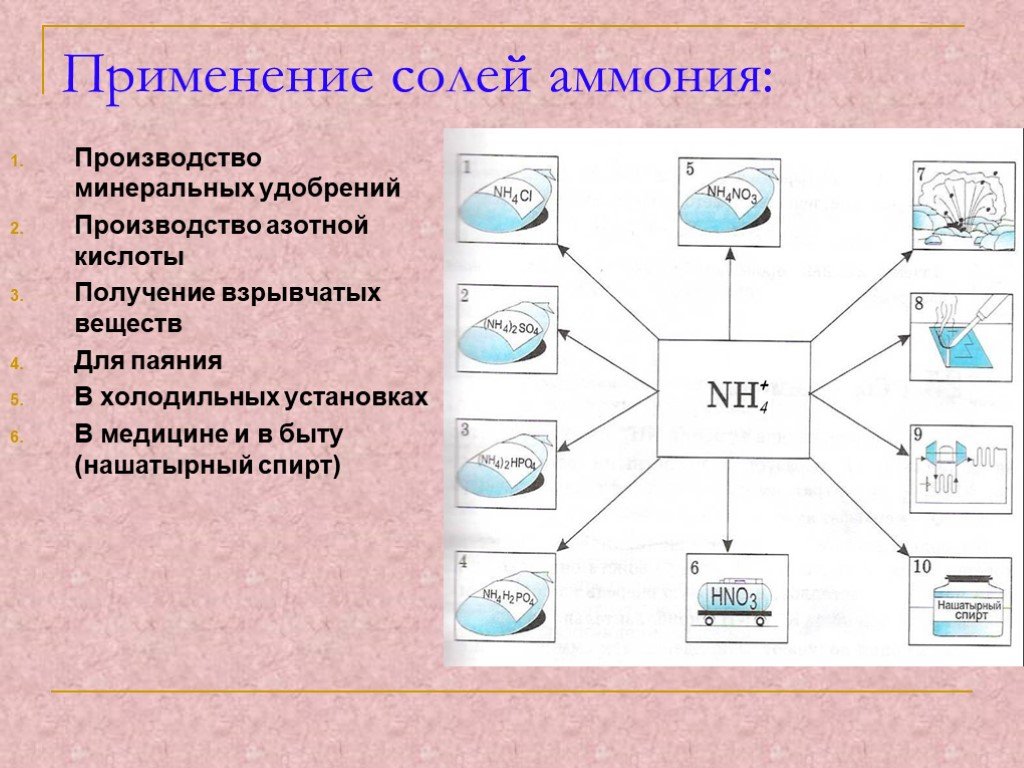
Проблемный вопрос:. Почему соли аммония нашли такое широкое применение в народном хозяйстве? Задачи:. изучить состав, получение и методы распознавания ...Определение химического состава местных глин
Общая характеристика работы Актуальность данной работы связана с тем, что представленные в большом ассортименте строительные материалы как отечественного, ...Применение солей
Соли на кухне. В приготовлении пищи поваренная соль употребляется как важная приправа. Соль имеет хорошо знакомый каждому человеку характерный вкус, ...Определение рода вещества (жидкости) по его плотности
Исследовательская работа: «Определение рода вещества (жидкости) по его плотности». Цель урока: научиться определять, методом исследования, род вещества ...Определение содержания нитратов в корнеплодах овощей
Актуальность темы. Неужели нельзя использовать в пищу растения, выращенные с применением азотистых удобрений? Ответ один – возможно, если учесть особенность ...Диссоциация солей
Что такое основание в свете теории электролитической диссоциации? Задание 1: Выберите тот ряд, в котором находятся только основания и дайте им названия. ...Определение органолептических и физико-химических свойств мороженого
Цель исследования: изучить органолептические и физико-химические свойства мороженого разных сортов. Задачи исследования: - знакомство с теорией по ...Гидролиз солей
ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ. Тема: Гидролиз солей. Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать ...Гидролиз солей
СОДЕРЖАНИЕ Определение. Типы солей,участвующих в гидролизе. Алгоритм составления уравнений гидролиза. Применение гидролиза. Примеры солей,участвующих ...Гидролиз солей
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды. В процессе гидролиза соли в водном растворе ...Гидролиз солей
Гидролиз – это реакция обменного разложения веществ водой. Гидролиз органических веществ. 1. Гидролиз галогеналканов. С2Н5Сl + Н2О →С2Н5ОН + НСl 2. ...Гидролиз неорганических солей
Словарь. Гидролиз – реакция обмена между растворимыми солями и водой Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, ...Химические свойства солей
Определение солей. Мех(КО)у. КО - кислотный остаток. Na2SO4 2Na+ +SO42- CaCl2 Ca2+ + 2Cl-. Na2SO4 CaCl2 Сульфат натрия Хлорид кальция. Соли – ...Есть ли сахар в банке с медом? или Определение качественного состава меда
"Мед - категория нравственная, но в ряду других вечных ценностей, вместе с золотом, серебром, алмазами, янтарем, розовым маслом, мед тоже есть эталон ...Влияние внешних условий на рост кристаллов различных солей
Объект исследования:. насыщенные растворы медного купороса CuSO4∙5Н2О; алюмокалиевых квасцов KCl(SO4)2*12H2O. Задачи исследования:. приготовление ...Классификация солей
Задачи урока: Познакомиться с понятиями кислые, средние, основные соли. Свойства оснований. А) P2O5 + 6KOH = 2K3PO4 + 3H2O P2O5 + 6K+ + 6OH- = 6K+ ...Определение РН осадков в зимнее время в районе Западное Дегунино
Цель: опытным путем установить уровень рН осадков (или воды, образовавшейся при таянии снега) и объяснить результаты своего исследования. Предмет ...Моделювання процесу кристалоутворення солей з розчинів
Об’єкт дослідження – алюмокалієві галуни – подвійні солі калій та алюміній сульфатів. Предметом дослідження є лабораторне моделювання процесу природного ...Определение содержания иода в продуктах питания
Область исследования. продукты питания. Предмет исследования. содержание йода. Цель исследования: Изучить проблемы дефицита иода и определить содержание ...Конспекты
Основания. Определение, состав, номенклатура и классификация
Муниципальное общеобразовательное автономное учреждение «Средняя общеобразовательная школа № 56 имени Хана В.Д. с углубленным изучением русского языка ...Химические свойства солей
. Зайчикова Ирина Николаевна. МБОУ «Пригородная СОШ». Учитель химии, биологии. Разработка урока по химии в 8 классе «Химические свойства ...Гидролиз неорганических веществ – солей
МБОУ « ООШ ст.Миннибаево» Альметьевского района Республики Татарстан. Методическая разработка урока химии. . по теме « Гидролиз неорганических ...Соли аммония, их свойства и применение
ОГАОУ СПО. Белгородский строительный колледж. Технологическая карта урока, в соответствии с требованиями ФГОС,. по теме. «. Соли аммония, ...Химические свойства растворов солей с точки зрения теории электролитической диссоциации
9 класс. Химия. . Тема: химические свойства растворов солей с точки зрения теории электролитической диссоциации. . Цель:. формировать представления ...Соли аммония
Методическая разработка урока химии в 9 классе. Тема: «Соли аммония». Цель:. . - знакомство с понятием «соли аммония»;. - способствование дальнейшему ...Соли аммония
Тема урока:. Соли аммония. Элементы содержания. : соли аммония. Уметь:. составлять уравнения реакций с участием солей аммония, распознавать опытным ...Гидролиз солей
ПЛАН-КОНСПЕКТ. . проблемного урока по химии для учащихся 9 класса. Тема урока:. «Гидролиз солей». Тип урока:. урок изучения нового материала. ...Гидролиз солей
Урок по теме: "Гидролиз солей". . . Цель урока. : Сформировать у учащихсе понятия гидролиза солей. Задачи урока:. . Развить у учащихся ...Гидролиз солей
Тема урока:. . Гидролиз солей. Цели урока:. Сформировать представление о гидролизе, сущности гидролиза солей. . Научить ребят составлять уравнения ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 марта 2019
Категория:Химия
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию