Конспект урока «Гидролиз солей» по химии
Тема урока: Гидролиз солей.
Цели урока: Сформировать представление о гидролизе, сущности гидролиза солей. . Научить ребят составлять уравнения реакций гидролиза солей в молекулярном и ионном виде. Определять реакцию и тип среды раствора электролита на основании состава соли.
Оборудование: образцы солей, подвергающихся гидролизу, вода, индикаторы – фенолфталеин, лакмус, пробирки, стеклянные палочки.
Ход урока
I.Организационный момент.
II. Актуализация урока.
-
Какие основные классы неорганических соединений вы знаете?
-
Какие вещества называются основаниями?
-
Какие вещества называются кислотами?
-
Какие вещества называются щелочами?
-
Какими индикаторами распознают кислоты и щелочи?
-
Вспоминаем изменение цвета лакмуса.
- Лакмус.
- Фенолфталеин.
- Метилоранж.
Лакмус - в кислой среде краснеет, в щелочной синеет, в нейтральной среде остается фиолетовым, не изменяет цвет.
III. Изучение нового материала.
Вам даются три пробирки, №1, №2, №3. В одной пробирке – щелочь, во второй пробирке – кислота, в третьей пробирке– вода. Давайте эти растворы распознаем при помощи лакмуса. До этого вспоминаем правила техники безопасности.
Какой раствор дает кислота?
Кислую, рH
Какой раствор дает щелочь?
Щелочную, рH > 7, лакмус синеет.
Вода – нейтральный раствор, рH = 7 – цвет не изменяется.
Значит, в пробирке №1 – кислота, в пробирке №2 - щелочь, в пробирке №3 – вода.
Кислотными, щелочными и нейтральными могут быть не только кислоты и щелочи, но и соли. Причина этого – гидролиз.
Что такое гидролиз?
Гидролиз солей – это реакции взаимодействия солей с водой, приводящие к образованию слабого электролита. Если кислота – кислая соль, если основание – основная соль, и происходит изменение среды раствора. Гидролиз – процесс обратимый. Гидролизу подвергаются растворимые соли, в состав которых входит либо катион слабого электролита, либо анион слабого электролита. Если катион слабого электролита – идет гидролиз по катиону. Если анион слабого электролита – идет гидролиз по аниону. Если катион и анион многозарядные – гидролиз идет ступенчато. Если в состав соли входят катион и анион слабых электролитов, идет необратимый гидролиз. Гидролизу не подвергаются соли, образованные катионами и анионами сильных электролитов, а также нерастворимые в воде соли.
Что означает гидролиз? (вспоминаем курс биологии).
Гидро – вода, лизис – растворяю.
Алгоритм составления уравнения гидролиза соли:
1.Составить уравнение диссоциации соли, определить ион слабого электролита.
2. Составить уравнение его взаимодействия с водой, определить продукты гидролиза в виде ионов.
3. Сделать вывод о среде электролита.
4. Составить уравнение в молекулярном и ионном виде.
AlCl3 ↔ Al3+ + 3Cl-
Al3+ - катион алюминия, слабое основание гидролиза по катиону
Al3+ + H+OH- ↔(AlOH)2+ + H+
среда кислая
AlCl3 + HOH ↔ (AlOH)2+Cl2 + HCl
Al3+ + 3Cl- + HOH ↔ (AlOH)2+ + 3Cl- + H+
Al3+ + HOH ↔ (AlOH)2+ + H+
Другой вариант алгоритма составления уравнения гидролиза соли:
а) по химической формуле соли определить, какой кислотой и каким основанием образована соль;
б) записать левую часть уравнения в молекулярном виде;
в) составить уравнение в общем ионном виде;
г) сократить одинаковые ионы в левой и правой частях уравнения общего ионного вида;
д) составить уравнение гидролиза в кратком виде, определить среду.
Na2CO3 – соль образована NaOH – сильное основание, H2CO3 – слабая кислота, гидролиз по аниону CO2-3;
Na2CO3 = 2Na+ + CO2-3
Na2CO3 + HOH ↔ NaHCO3 + NaOH;
2Na+ + CO2-3 + H+OH- ↔ HCO-3 + 2Na+ + OH-
Составляем краткое ионное уравнение гидролиза, сокращаем катионы натрия:
CO2-3 + HOH ↔ HCO-3 + OH-
Вывод: среда щелочная, рH>7.
Соли делятся на 4 типа, исходя из какого основания и кислоты они образованы.
I тип. Сильное основание + сильная кислота.
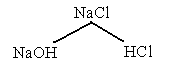
среда нейтральная
II тип. Сильное основание + слабая кислота.
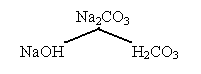
среда щелочная
.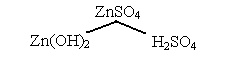
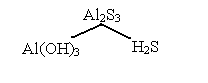
III тип. Слабое основание + сильная кислота
IVтип. Слабое основание + слабая кислота.
Если соль образована многозарядным ионом ,то гидролиз идет ступенчато.( к доске вызывается 1 сильный ученик.)
Al3+ + 3Cl- + H2O ↔ AlOH2+ + 2Cl- + H+
Al3+ + H2O ↔ AlOH2+ + H+
AlCl3 + H2O ↔ AlOHCl2 + HCl
AlOHCl2 ↔ AlOH2+ + 2Cl-
AlOH2+ + 2Cl- + HOH↔ Al(OH)2+ + 2Cl- + H+
AlOH2+ + HOH ↔ Al(OH)+2 + H+
AlOHCl2 + HOH ↔ Al(OH)2Cl + HCl
Al(OH)2Cl ↔ 2Al(OH)+2 + Cl-
Al(OH)+2 + Cl- + HOH ↔ Al(OH)3 + H+
Al(OH)2Cl + HOH ↔ Al(OH)3 + HCl
IV. Обобщение и выводы.
1.Гидролиз – взаимодействие соли с водой с образованием слабого электролита и изменением реакции среды.
2.Гидролиз – обратимый процесс.
3. Возможен гидролиз: а) по катиону; б) по аниону.
Значение гидролиза солей в живом организме, в природе, в быту.
Гидролиз имеет большое значение в живом организме , живой природе, в практической жизни человека.
В качестве моющего средства в древности использовали золу, в состав которой входит K2CO3 - карбонат калия, в воде гидролизуется с образованием щелочной реакции. Раствор становится мыльным. В настоящее время в быту используют мыло , моющие стиральные порошки – натриевые, калиевые соли высших жирных карбоновых кислот – стеариновой и пальмитиновой.
Гидролизуясь в водном растворе они дают щелочную реакцию:
C17H35COONa + HOH ↔ C17H35 COOH + NaOH
В состав моющих средств входят соли неорганических кислот: фосфат, карбонат, они усиливают моющее действие.
В фотографическом деле соли – бура Na2B2O4, Na2CO3, K2CO3, гидролизуясь создают щелочную реакцию.
При недостатке кислотности почвы у растений развивается заболевание хлороз. В почву вводится удобрение (NH4)2SO4, которое повышает кислотность почвы благодаря гидролизу по катиону.
V.Домашняя работа
Параграф 6, ответить на вопросы и 9-10 упражнения, задачи 1-3, стр.22
Здесь представлен конспект к уроку на тему «Гидролиз солей», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

