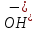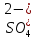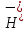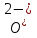Конспект урока «Электролитическая диссоциация кислот, щелочей и солей» по химии
Дата ____________ Класс _____________
Тема: Электролитическая диссоциация кислот, щелочей и солей
Цели урока: рассмотреть свойства кислот, щелочей и солей в свете теории электролитической диссоциации.
Ход урока
1. Организационный момент урока.
Решение задания. Разложить вещество на катионы и анионы.
| Катион | Анион | |
| NaOH | Na+ |
|
| Mg(OH)2 | Mg2+ |
|
| CaSO4 | Ca2+ |
|
| LiH | Li+ |
|
| Na2O | Na+ |
|
2. Диссоциация кислот, оснований и солей в водных растворах
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H +).
Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО-4 (первая ступень) – дигидроортофосфат ион
Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Основания
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH -).
| Диссоциация амфотерных оснований (амфолитов) | |
| Вспомните! Щёлочи – это основания, растворимые в воде. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, Rb ОН, С s ОН, Fr ОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, R а(ОН)2, а также N Н4ОН | Амфолиты - это электролиты, которые при диссоциации одновременно образуют катионы водорода (H +) и гидроксид-ионы ( OH -). |
| Примеры уравнений диссоциации щелочей KOH -> K + + OH -; NH 4OH ↔ NH +4 + OH - Многокислотные основания диссоциируют ступенчато: Ba(ОН)2 -> Bа(ОН)+ + OH- (первая ступень) Ba(OH)+ ↔ Ba2++OH- (вторая ступень) | Примеры уравнений диссоциации амфолитов Н2O ↔ Н+ + ОН- Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением: 2ОН- + Zn2+ + 2Н2О ↔ Zn (ОН)2 + 2Н2О ↔ [Zn(ОН)4]2-+ 2Н+ |
Соли
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH+4+ SO2-4;
Na3PO 4 -> 3 Na + + PO 3- 4
Кислые же и основные соли диссоциируют ступенчато:
Например,
| Диссоциация основных солей | |
| У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. KHSO4 -> K + + HSO -4 HSO -4 ↔ H + + SO 2-4 | У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы. Mg( OH )Cl -> Mg( OH )++ Cl - Mg ( OH )+↔ Mg2+ + OH- |
3. Закрепление изученного материала.
Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
-
Ca(OH)2
-
Na2CO3
-
Na3PO4
-
HNO3
-
KOH
-
Ba(OH)2
-
H2SO3
-
Ca(NO3)2
-
Ca3(PO4)2
-
H2S
-
NaOH
-
HBr
П. 2, упр.6-8, задача 2 на стр.13
№1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ:
HF, Mg(OH)2, CaCl2, Zn(NO3)2,Ba(OH)2, K2SO4, H2SiO3, FeI3, NiCl2, H3PO4
Здесь представлен конспект к уроку на тему «Электролитическая диссоциация кислот, щелочей и солей», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.