Конспект урока «Электролитическая диссоциация» по химии для 9 класса
Учебный проект по химии в 9 классе «Электролитическая диссоциация»
Аннотация:
Проект реализуется в рамках химии темы «Теория электролитической диссоциации» и рассчитан на учащихся 8 класса, изучающих химию по учебнику «Химия-8» О.С. Габриеляна. Он включает в себя исследовательский и информационный блоки.
На основе изучения информационных ресурсов Internet учащиеся составляют опорные конспекты для изучения основ теории электролитической диссоциации.
Самостоятельно исследуют проводимость электрического тока растворов различных веществ. Приобретенные практические знания, умения и навыки позволяют ответить на проблемные вопросы и вопросы учебной темы, доступно и наглядно представлять достаточно сложный теоретический материал и связать его с практической деятельностью человека.
Настоящий проект направлен на поиск новых методов, идей при решении задач и интеграцию разделов школьного курса химии.
Тема проекта: Электролитическая диссоциация
Темы, необходимые для создания проекта:
История химии, типы химических реакций, свойства классов неорганических соединений, строение атомов, ионов, виды химической связи, типы кристаллических решеток.
Дидактические цели проекта:
Углубить и систематизировать знания о веществах и химических реакциях с точки зрения теории электролитической диссоциации.
Иметь представление об электролитах, электролитической диссоциации, реакциях ионного обмена.
Закрепить знания о зависимости свойств веществ от их состава и строения (свойства ионов определяют свойства электролитов).
С целью патриотического воспитания познакомиться с ролью русских ученых в создании теории электролитической диссоциации.
Методические задачи проекта:
Научиться записывать уравнения химических реакций в молекулярном, полном и сокращенном виде.
Закрепить знания свойств веществ основных классов неорганических соединений.
Научиться обрабатывать и обобщать полученную информацию в результате проведенных опытов и экспериментов.
Продолжить формирование навыков обращения с химическими реактивами и оборудованием.
Ожидаемые приращения в компетентностях учащихся:
На начало проекта учащиеся знают вещества основных классов неорганических соединений, их свойства, строение атома, виды химической связи, типы кристаллических решеток; могут составлять формулы бинарных соединений, писать уравнения химических реакций, определять признаки химических реакций и писать уравнения химических реакций.
Однако еще не знают причины проводимости электрического тока растворами веществ, механизма электролитической диссоциации, не могут писать ионные уравнения, не знают условий протекания реакций между электролитами до конца.
В ходе выполнения проекта у учащихся формируется представление об электролитах, электролитической диссоциации веществ с различным видом химической связи и типом кристаллической решетки, степени диссоциации, диссоциации кислот, щелочей и солей, реакций между электролитами, навыки составления уравнений химических реакций в молекулярном и ионном полном и сокращенном видах. Продолжается формирование практических навыков пользования химическими реактивами и оборудованием, персональным компьютером и навыков поиска информации в Internet. Во время работы формируются навыки представления результатов работы в виде таблиц, графиков, применение информационных технологий для презентации полученных результатов, навыки коммуникативного взаимодействия, грамотность информационно-поисковой работы, умения составить литературный обзор полученной информации. В ходе работы над проектом формируются навыки планирования работы, обобщения, сравнения, рефлексии и самоанализа своей деятельности.
Проблемные вопросы учебной темы:
Каков механизм электролитической диссоциации веществ с различным типом химической связи?
Почему растворы кислот, щелочей и солей обладают характерными для данного класса химическими свойствами?
В чем причина разницы свойств ионов и простых веществ натрия и хлора?
Каковы условия протекания реакций между электролитами?
Самостоятельные исследования учащихся: выполнение эксперимента по исследованию электропроводности растворов хлорида натрия, соляной и уксусной кислот, зависимость степени диссоциации уксусной кислоты от концентрации ее растворов, проведение химических реакций между электролитами, поиск информации в Internet, самостоятельная работа с учебником.
Проект соответствует следующим пунктам тематического учебного плана школьного курса химии:
Электролитическая диссоциация, диссоциация кислот, щелочей и солей, реакции ионного обмена, химические свойства веществ основных классов неорганических соединений, окислительно-восстановительные реакции.
Предметные области:
Русский язык, литература, математика, информационные технологии, история, химия, биология, ОБЖ.
Время выполнения проекта: 6 академических часов.
Техническое оснащение:
Кабинет информатики, компьютеры, мультимедийный проектор, принтер, доступ к Интернету.
Оформление результатов проекта: Для решения дидактических целей и решения методических задач, формирования запланированных компетентностей, учитывая возраст учащихся – это восьмиклассники, которые первый год изучают предмет, учителем выбран учебно-ролевой проект, который проведен в виде урока – ролевой игры с показом мультимедийной презентации. Ребята этого класса больше любят представлять себя в роли героев, кроме того, они с удовольствием выполняют слайды. Этот урок был проведен при обобщении и систематизации знаний учащихся в конце изучения темы «Теория электролитической диссоциации», после чего следовала контрольная работа, результаты которой показали верность выбранного типа проекта. Мультимедийная презентация, созданная детьми, может использоваться для самостоятельного изучения темы «Электролитическая диссоциация» будущими восьмиклассниками в последующие годы.
В работе над проектом учитель консультирует, помогает, направляет, координирует деятельность учащихся.
Ведущая деятельность учащихся: Поисковая и исследовательская.
Вначале изучения темы на первом вводном уроке для представления проблемы проекта учащимся был представлен основополагающий вопрос, в котором заключалась неясно сформулированная цель.
Основополагающий вопрос:
Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!» Как же ток добрался до пассажира?
Так как школьники не раз испытали на себе действие электрического тока при включении с мокрыми руками таких электроприборов как электропаяльник, кипятильник, утюг и чайник в электрическую розетку было решено изучить подробно этот вопрос. Поскольку класс небольшой организовали 3 группы по 4 человека «Историки», «Исследователи-теоретики», «Экспериментаторы» и 2 ученика оставили для оформления общей мультимедийной презентации несмотря на то, что каждая группа представляет отчет с показом слайдов.
Первичным мотивом учащихся в работе над проектом был эксперимент, поставленный учителем «Электропроводность поваренной соли в твердом и растворенном состоянии». При пропускании электрического тока через твёрдую поваренную соль электрическая лампочка прибора не загорается, а при пропускании тока через раствор – загорается.
Каждая группа определила себе цель. «Историки» решили изучить вопрос возникновения теории электролитической диссоциации, её основные положения. «Исследователи-теоретики» - как происходит диссоциация веществ с различным типом химической связи на примере поваренной соли и соляной кислоты, а «Экспериментаторы» изучить электролитическую диссоциацию, проделав опыты по электропроводимости, изменению степени электролитической диссоциации в зависимости от концентрации раствора на примере уксусной кислоты.
Вначале предполагалось проектный продукт создать в виде мультимедийной презентации, однако после некоторого времени предложением учащихся было завершение изучения темы провести урок в виде ролевой игры.
Считаю, что урок – ролевая игра, которую затем провели, достиг цели проекта. Урок показал, что учащиеся хорошо усвоили тему. Контрольная работа, проведенная после изучения этой темы, подтвердила данный результат.
Ход урока
-
Организационная часть.
-
Основная часть.
Учитель: Ребята, сегодня мы проведем урок в виде учебно-ролевой игры по теме «Электролитическая диссоциация». Он потребует от вас знаний как по химии, так и других учебных предметов. Для проведения урока мы с вами заранее определили группы:
«Историки»
«Исследователи-теоретики»
«Экспериментаторы».
-
Выступление групп и обсуждение сообщений, оценивание работы каждой группы. Выбор слайдов для общей презентации.
-
Заключительная часть. Выставление оценок.
-
Домашнее задание.
Историки
Еще на заре изучения электрических явлений ученые заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие. Так, водные растворы поваренной соли и других солей, растворы сильных кислот и щелочей хорошо проводят ток. Растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток. Английский физик Майкл Фарадей еще в 30-е годы XIX века, изучая закономерности прохождения электрического тока через растворы, ввел термины «электролит», «электролиз», «ион», «катион», «анион». Электролит – вещество, раствор которого проводит электрический ток. Происходит это в результате направленного движения в растворе заряженных частиц – ионов.
Причина появления в растворах заряженных частиц была совершенно непонятной. Само название «электролит» (от греч. lysis – разрушение, растворение) предполагало, что ионы появляются в растворе при пропускании через него электрического тока.
Растворы всех веществ можно разделить на две группы: электролиты -проводят электрический ток, неэлектролиты - проводниками электрического тока не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты.
Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например, хлорид натрия, поваренная соль - NaCl, K2SO4 – сульфат калия, фторид калия - KF и т.д.)
Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например, соляная кислота HCl).
К неэлектролитам относится большая часть органических соединений, например, диэтиловый эфир, бензол, глюкоза, сахароза, этиловый спирт.
Заряженные частицы появляются только в растворах и расплавах веществ.
Классическая теория электролитической диссоциации, которая объясняет появление ионов в растворах, была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует (распадается) на ионы.
Многие ученые – современники Аррениуса, вначале не приняли его теорию. У многих из них в то время еще не было четкого понимания, чем ионы отличаются от нейтральных атомов. Им казалось невероятным, как, например, хлорид натрия в воде может существовать в виде отдельных ионов натрия и хлора: ведь известно, что натрий бурно реагирует с водой, а раствор хлора имеет желто-зеленый цвет и ядовит. В результате диссертация Аррениуса получила ряд отрицательных отзывов. К числу самых непримиримых противников Аррениуса принадлежал и Д.И.Менделеев, создавший «химическую» теорию растворов, в отличие от «физической» теории Аррениуса. Менделеев считал, что в растворах происходят по сути химические взаимодействия между растворенным веществом и растворителем, тогда как теория Аррениуса представляла водные растворы как механическую смесь ионов и воды. В 1889 году Менделеев опубликовал Заметку о диссоциации растворенных веществ, в которой ставился под сомнение сам факт распада на ионы в растворах электролитов. «Сохраняя все то, что приобретено в отношении к пониманию растворов, – писал Менделеев, – мне кажется, можно оставить в стороне гипотезу об особом виде диссоциации – на ионы, совершающейся с электролитами при образовании слабых растворов».
Хотя Менделеев, критикуя Аррениуса, во многом был не прав, в его рассуждениях была значительная доля истины. Как это часто бывает в науке, в ожесточенном споре между приверженцами физической и химической теории правыми оказались обе стороны. Очень сильное химическое взаимодействие между ионами и молекулами растворителя дает ту энергию, которая необходима для разрушения кристаллической решетки или молекул электролитов. В случае водных растворов эта энергия называется энергией гидратации (hydor по-гречески вода) и она может достигать очень больших значений; так, энергия гидратации катионов Na+ почти вдвое больше, чем энергия разрыва связи в молекуле Cl2. Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решетки). В результате если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решетки (или энергии связи между атомами в таких электролитах, как HCl, H2SO4), растворение будет сопровождаться нагреванием, а если меньше – охлаждением раствора. Именно поэтому при растворении в воде таких веществ как хлорид лития LiCl, безводный хлорид кальция CaCl2 и многих других раствор нагревается, а при растворении хлорида калия KCl, нитрата калия KNO3, нитрата аммония NH4NO3 и некоторых других – охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, покрывается снаружи росой и может даже примерзнуть к мокрой подставке!
Исследователи-теоретики
Растворы всех веществ можно разделить на две группы: электролиты -проводят электрический ток, неэлектролиты - проводниками не являются. Заряженные частицы появляются только в растворах и расплавах веществ.
Как же происходит процесс растворения? Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
В целом молекула воды не заряжена. Но внутри молекулы Н2О атомы водорода и кислорода располагаются так, что положительные и отрицательные заряды находятся в противоположных концах молекулы
(рис. 1). Поэтому молекула воды представляет собой диполь.
Рис. 1. |
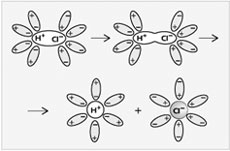
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой - положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным - к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности
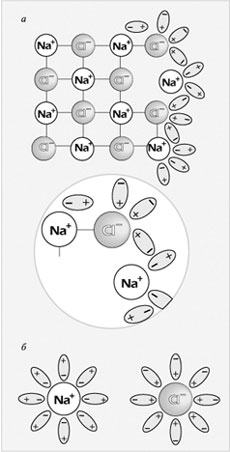
Рис. 2.
Механизм растворения хлорида натрия в воде:
а – ориентация молекул воды на поверхности кристалла NaCl и отрыв иона Na+;
б – гидратация (окружение молекулами воды) ионов Na+ и Сl–
«Электролитическая диссоциация – это процесс распада электролита на ионы при растворении его в воде или расплавлении».
Уравнение диссоциации можно записать следующим образом:
При растворении в воде соляной кислоты (в молекулах HCl cвязь между атомами ковалентная сильнополярная) происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Образовавшиеся ионы остаются связанными с молекулами воды – гидратированными. Если растворитель неводный, то ионы называют сольватированными.
Рис. 3. |
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко.
Свободные ионы, оказавшиеся в водном растворе, окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.
В результате диссоциации в растворе появляются ионы, которые дают возможность появления у раствора или расплава электропроводимости.
Ионы резко отличаются по своим физическим и химическим свойствам от нейтральных атомов. Например, атомы Na реагируют с водой, а катионы Na+ – нет; хлор – сильный окислитель и ядовит, а анионы Cl– не являются окислителем и не ядовиты. Цвет ионов при гидратации может измениться. Например, негидратированные ионы меди бесцветны (безводный CuSO4), а гидратированные – голубые.
Сила электролитов.
Силу электролитов можно охарактеризовать с помощью степени диссоциации.
Степень диссоциации электролита - это частное от деления числа продиссоциированных молекул к общему числу молекул электролита, введённого в раствор.
Степень диссоциации потенциальных электролитов изменяется в пределах 0 (значение α = 0 относится к неэлектролитам).
Степень диссоциации возрастает при увеличении разбавления раствора, а также при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы.)
Сила электролитов в водном растворе определяется их степенью диссоциации при постоянной концентрации и температуре. По степени диссоциации на ионы электролиты стали относить к сильным (полный распад на ионы) и к слабым (на ионы распадается только часть растворенного вещества). К сильным электролитам относятся щелочи, многие кислоты (серная, азотная, соляная), большинство солей. К слабым электролитам относятся уксусная СН3СООН, азотистая HNO2, сероводородная H2S, угольная Н2СО3, сернистая H2SO3, большинство органических кислот. Воду также можно отнести к слабым электролитам, так как лишь очень небольшая часть ее молекул находится в растворах в виде катионов Н+ и анионов ОН–. Фосфорная кислота Н3РО4 – электролит средней силы. Тело человека также содержит растворы электролитов и проводит электрический ток. Прохождение через тело тока силой всего 0,1 ампера может быть смертельным.
Экспериментаторы
-
Исследование проводимости электрического тока растворов соляной и уксусной кислот, гидроксида натрия, хлорида натрия.
-
Увеличение степени диссоциации раствора уксусной кислоты различной концентрации.
-
Наличие ионов в растворах кислот, щелочей и солей можно доказать реакциями обмена. Проведены были следующие опыты:
взаимодействие сульфата меди(II) c:
а) нитратом бария;
б) хлоридом бария;
в) гидроксидом натрия;
взаимодействие нитрата серебра с:
д) соляной кислотой;
е) хлоридом натрия.
Уравнения химических реакций:
а) СuSO4 + Ba(NO3)2 = Cu(NO3)2 + BaSO4![]() ;
;
б) СuSO4 + BaСl2 = CuCl2 + BaSO4![]() ;
;
в) СuSO4 + 2NaOH = Na2SO4 + Cu(OH)2![]() ;
;
г) AgNO3 + HCl = HNO3 + AgCl![]() ;
;
е) AgNO3 + NaCl = NaNO3 + AgCl![]() .
.
На основании этих реакций можно сделать следующие выводы:
1) ионы металлов, гидроксильные группы и кислотные остатки реагируют в водных растворах как самостоятельно существующие частицы;
2) гидроксильные группы, кислотные остатки, атомы водорода кислот и атомы металлов солей являются теми электрически заряженными частицами, которые находятся в растворах кислот, щелочей и солей.
Поскольку число молекул воды, которое присоединяют ионы, неизвестно, то процесс диссоциации кислоты, щелочей и солей упрощенно можно изображать так:
HCl = H+ + Cl–,
NaOH = Na+ + OH–,
NaCl = Na+ + Cl–.
Многоосновные кислоты и кислые соли диссоциируют ступенчато. Чтобы показать неполную диссоциацию молекул и ионов, не относящихся к сильным электролитам, используют знак обратимости «![]() ». Например, для H2SO4 и ее кислой соли NaHSO4:
». Например, для H2SO4 и ее кислой соли NaHSO4:
H2SO4 = H+ + HSO4-
HSO4-![]() H+ + SO42-
H+ + SO42-
NaHSO4 = Na+ + HSO4-
HSO4- ![]() H+ + SO42-
H+ + SO42-
Следует запомнить и не допускать ошибок при написании уравнений диссоциации нерастворимых и малорастворимых веществ, которые практически не диссоциируют на ионы или диссоциируют в малой степени:
CaCO3 ![]() нет диссоциации,
нет диссоциации,
СuSO4 ![]() Cu2+ + SO42-
Cu2+ + SO42-
Учитывая диссоциацию в растворах, уравнения многих реакций можно записать в сокращенном ионном виде. Ионное уравнение показывает, какие именно ионы участвуют в реакции. Например, полное уравнение реакции AgNO3 + NaCl =AgCl + NaNO3 можно записать в сокращенном ионном виде: Ag+ + Cl– = AgCl. Суть реакции состоит в образовании осадка AgCl при встрече ионов Ag+ и Cl–, тогда как ионы Na+ и NO3– остаются в растворе и фактически не принимают участия в реакции.
Здесь представлен конспект к уроку на тему «Электролитическая диссоциация», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.