Конспект урока «Электролитическая диссоциация» по химии для 8 класса
Кузьмина Светлана Ниловна, учитель химии МБОУ «Гимназия №1» г. Чебоксары
Тема «Электролитическая диссоциация»
Цель урока: формирование исследовательских компетентностей учащихся
Задачи урока:
обучающие: - изучить поведение веществ с разным типом связи в водных растворах,
- развить представления учащихся о влиянии строения вещества на его свойства;
- сформировать понятия о веществах электролитах и неэлектролитах;
развивающие: - совершенствовать навыки самостоятельной работы учащихся по приобретению знаний
воспитательные: - формировать у учащихся навыки наблюдательности
Используемые реактивы и оборудование: прибор для определения электропроводимости веществ, поваренная соль (тв.), вода дистиллированная, растворы гидроксида натрия и соляной кислоты.
Используемые электронные учебные пособия: «Химия, 8,9», изд-во «Просвещение», «Уроки химии Кирилла и Мефодия, 8-9 классы», изд-во «Виртуальная школа Кирилла и Мефодия.»
Оборудование кабинета: компьютерный класс, мультимедиапроектор.
Длительность урока: Сдвоенный урок, 1,5 часа .(2 урока по 45 минут).
Ход урока.
-
Организационный этап.
Формулировка целей и задач урока.
-
Подготовка учащихся к активному и сознательному восприятию материала.
1) Беседа, фронтальная работа с классом. Повторяем, какие бывают типы кристаллических решёток и типы химической связи. Ученики заполняют таблицу, которая демонстрируется на экране
| Тип кристаллической решётки | Тип химической связи | |
| Вода | ||
| NaCl | ||
| NaOH | ||
| HCl |
2) Проверяем правильность заполнения 2 и 3 столбиков таблицы. Вспоминаем, пользуясь знаниями физики, что такое электрический ток и чем обуславливается электропроводность.
-
Этап получения новых знаний.
1) На следующем слайде выводим исходную таблицу, но с дополнительным 4-ым столбиком. Учащимся предлагается подумать и высказать свои предположения насчёт электропроводности веществ и растворов веществ, заполнить 4-ый столбик таблицы.
| Тип кристаллической решётки | Тип химической связи | Проводит ли электрический ток | |
| Вода (дист.) | молекулярная | ковалентная полярная | |
| NaCl | ионная | ионная | NaCl (кристаллич.) |
| NaCl (раствор) | |||
| NaOH | ионная | Na+OH- ионная O-H ков. полярная | NaOH (раствор) |
| HCl | молекулярная | ковалентная полярная | HCl (раствор) |
2) Учащиеся высказывают свои предположения насчет электропроводности веществ и растворов, аргументируют свою точку зрения.
3) Проводится ученический лабораторный эксперимент «Электропроводность веществ и растворов». Учащиеся проверяют электропроводность дистиллированной воды, кристаллов поваренной соли, раствора поваренной соли, растворов гидроксида натрия и раствора соляной кислоты. На основании проделанных опытов заполняют таблицу. (Если нет возможности провести ученический эксперимент, то учитель показывает демонстрационный опыт).
| Тип кристаллической решётки | Тип химической связи | Проводит ли электрический ток | |
| Вода (дист.) | молекулярная | ковалентная полярная | не проводит |
| NaCl | ионная | ионная | NaCl (кристаллич.) не проводит |
| NaCl (раствор) проводит | |||
| NaOH | ионная | Na+ OH- ионная O-H ков. полярная | NaOH (раствор) проводит |
| HCl | молекулярная | ковалентная полярная | HCl (раствор) проводит |
4) Возникновение проблемной ситуации. На основании жизненного опыта учащиеся знают, что вода проводит электрический ток, однако, практический опыт противоречит их знаниям. Также возникает вопрос, почему вещества с ионной связью не проводят электрический ток в кристаллах, несмотря на то, что заряженные частицы имеются? Почему проводит ток раствор соляной кислоты, хотя и сама вода, и хлороводород, HCl, не имеют ионов? Учащиеся выдвигают свои гипотезы, предположения для объяснения имеющихся противоречий.
5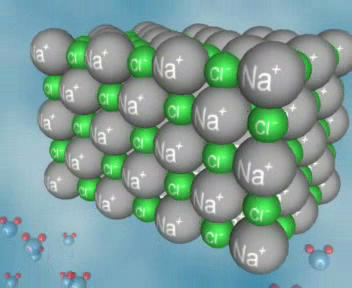 ) Демонстрируется видеофрагмент, объясняющий механизм диссоциации веществ с ионной связью на примере хлорида натрия и его раствора, а также видеофрагмент, объясняющий механизм образования заряженных частиц в растворе соляной кислоты. (Используются видеофрагменты электронного учебного пособия: «Химия, 8,9», изд-во «Просвещение»). Записываем уравнения электролитической диссоциации.
) Демонстрируется видеофрагмент, объясняющий механизм диссоциации веществ с ионной связью на примере хлорида натрия и его раствора, а также видеофрагмент, объясняющий механизм образования заряженных частиц в растворе соляной кислоты. (Используются видеофрагменты электронного учебного пособия: «Химия, 8,9», изд-во «Просвещение»). Записываем уравнения электролитической диссоциации.
NaCl = Na+ + Cl-
NaOH = Na+ + OH-
HCl = H+ + Cl -
-
Этап самостоятельной работы учащихся с информацией.
Учащиеся занимают места за компьютерами и самостоятельно работают по материалу урока, используя электронное пособие «Химия,8,9» (если нет возможности использовать компьютеры, то можно использовать учебники и другие источники информации), отвечая на вопросы, которые выводятся на экран:
-
Что такое электролиты? Приведите 2-3 примера
-
Что такое неэлектролиты? Приведите 2-3 примера.
-
Какие электролиты относятся к сильным? Приведите 2-3 примера.
-
Какие электролиты относятся к слабым? Приведите 2-3 примера.
-
Этап первичной проверки понимания изученного.
Идет обсуждение ответов на поставленные вопросы.
-
Этап закрепления изученного.
Закрепление материала проводим по тесту электронного пособия «Уроки химии Кирилла и Мефодия» темы «Электролитическая диссоциация». Задания выводятся на экран. (Если нет возможности использовать данное пособие, то в презентации предусматривается соответствующий слайд)
Вопросы теста:
-
Электролитом является раствор: 1) сахара в воде, 2) соли в воде, 3) спирта в воде
-
Положительно заряженные ионы называются: 1) катионами, 2) анионами, 3) ионитами
-
К сильным электролитам относятся: 1) нерастворимые соли, 2) вода, 3) щелочи
-
При диссоциации кислот в водных растворах образуются: 1) катионы металла и анионы кислотного остатка, 2) катионы металла и водорода и анионы кислотного остатка, 3) катионы водорода и анионы кислотного остатка
-
При диссоциации средних солей в водных растворах образуются: 1) катионы металла и анионы кислотного остатка, 2) катионы металла и водорода и анионы кислотного остатка, 3) катионы водорода и анионы кислотного остатка
Отвечаем все вместе, выделяя нужные пункты в ответах, которые выбирают ученики, и в конце ответов получаем электронную оценку на экране. Скорее всего, если работали хорошо, оценка будет «пять». Согласитесь, это приятное завершение урока.
-
Этап рефлексии.
Подводим итог урока: достигли ли поставленных задач в начале урока, получили ли новые знания и удовольствие от урока.
-
Этап информации о домашнем задании.
§§ 1 – 3, вопросы стр. 13(устно) Учебник «Химия, 9» Рудзитис, Фельдман. Издательство «Просвещение».
Здесь представлен конспект к уроку на тему «Электролитическая диссоциация», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

