Конспект урока «Железо - общее представление» по химии для 9 класса
Муниципальное общеобразовательное учреждение основная общеобразовательная школа села Акатная Маза
Хвалынского района Саратовской области
Конспект урока по химии в 9 классе
«Железо - общее представление».
подготовила
учитель химии
Гулиева Лариса Анатольевна
село Акатная Маза
2013 год
Тема урока «Железо - общие представления»
Железо не только основа всего мира,
самый главный металл окружающей нас природы,
оно – основа культуры и промышленности,
оно- орудие войны и мирного труда.
Цели урока: организовать самостоятельную работу учащихся для восприятия и запоминания новых знаний о свойствах железа, опираясь на имеющиеся у учащихся знания и умения.
Задачи урока:
1.Задачи обучения: учащиеся должны:
- давать характеристику элемента – железа по его положению в периодической системе химических элементов (п.с.х.э.) Д.И.Менделеева;
- знать основные физические свойства металлов;
- уметь записывать уравнения химических реакций, отражающих свойства железа;
- уметь проводить лабораторные опыты, учитывая правила по технике безопасности.
2. Задачи развивающие:
- продолжить развивать мышление учащихся, навыки самостоятельности и способности к рефлексии, коммуникативные умения в ходе парной работы, умения работать с химическими веществами, со справочной литературой, умения делать выводы;
- осуществлять межпредметные связи: химия- физика– биология – география.
3. Задачи воспитательные:
- формировать коммуникабельность, чувство взаимоуважения, умения рационально организовывать свой труд, вырабатывать правильную самооценку, составить представление о правильном рационе питания.
Оборудование урока:
ПСХЭ Д.И.Менделеева, таблица растворимости веществ, ряд активности металлов, физическая карта России, мультимедийный проектор, компьютер, экран, «Справочник по физике и технике» Янукович, коллекция образцов минералов, содержащих железо.
Реактивы и химическая посуда:
пробирки, штатив для пробирок, железо металлическое восстановленное, растворы кислот серной и соляной; гидроксида натрия; роданида аммония; жёлтой и красной кровяной соли; сульфата железа (II); хлорида железа (III); сульфата меди(II).
Ход урока
-
Организационный момент
Организация внимания учащихся. Подготовка учащихся к уроку, включение их в деловой ритм.
-
Подготовка к активному усвоению материала. Актуализация знаний учащихся
Наш урок будет проведён в виде путешествия за знаниями об удивительном металле. Каком? Вы должны определить это сами, отгадав загадку:
Очень древний я металл,
Счёт столетьям потерял.
Был нескромным я не в меру,
Тысячи лет до нашей эры.
А за блеск, мерцавший холодом,
Люди там платили золотом!
Я давно в названье века,
В организме человека.
Называют мной характер,
Из меня почти весь трактор.
Очень в яблоке полезно,
И зовут меня….. (Железо).
Объявляется тема урока и поставленные цели и задачи. Учащиеся записывают тему урока в тетрадь.
-
Изучение нового материала
1.Характеристика элемента-железа по его положению в ПСХЭ Д.И.Менделеева.
- Прежде, чем отправиться в наше путешествие, дайте характеристику элементу-железу по его положению в ПСХЭ, но учтите, что это элемент побочной подгруппы, и определим его физические характеристики.
1) После ответов учащихся учитель записывает на доске схему строения атома железа, учащиеся делают запись в тетрадь:
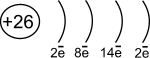 1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
2) Используя «Справочник по физике и технике» Януковича, определите температуру плавления железа и его плотность. (Учащиеся находят данные в справочнике и делают запись в тетрадь).
Температура плавления железа 1539оС, а плотность 7800кг/м3.
Имея некоторые представления об изучаемом металле, можно отправляться в путь.
Путешествие с остановками на станциях «Историческая», «Геологическая», «Химическая», «Практическая». В путешествии нас будут сопровождать экскурсоводы (учащиеся, подготовившие соответствующий материал).
Остановка первая: Станция «Историческая»
Экскурсовод: Первое железо, попавшее в руки человека, очевидно, было небесного происхождения, т.е. метеоритное. Об этом говорит наличие изделий из железа у жителей Гренландии, не имевших никакого понятия о железной руде. В древности железо ценилось очень высоко. В документах древнегреческого оратора и поэта Страбона (90г. до н.э.) сказано, что у
африканцев железо стоило в 20 раз дороже серебра и в 6400 раз дороже меди. Метеоритное железо всегда самородное. Оно относится к сверхчистому железу. Правда, из-за содержащейся примеси никеля, почти не поддаётся ковке. Как ни странно, его следует обрабатывать только в холодном виде, а не в разогретом, как обычное железо.
Согласно легенде, оружейники, которые не знали этого секрета, были безжалостно казнены. Только много столетий спустя эта загадка была разгадана. В XYIII веке оружие из никелистого железа появилось у индийского раджи. Сабли из уникального металла были у легендарного С.Боливара и у российского императора Александра I.
Интересно, что чистое железо не ржавеет. Классический пример – Кутубская колонна в Индии, которая стоит уже 1,5 тысячи лет и не разрушается, не смотря на жаркий и влажный климат. В гробницах египетских фараонов вместе с золотыми украшениями находят железные лезвия, кинжалы, бусы. Железо обнаружено на Марсе и на Луне, причём в лунном грунте оно присутствует также в самородном виде.
Учащиеся должны сделать в свои тетради записи:
- никелистое железо можно обрабатывать только в холодном виде;
- химически чистое железо не ржавеет.
Физминутка: Упражнения для снятия напряжения в мышцах спины; гимнастика для глаз.
Остановка вторая: Станция «Геологическая»
Экскурсовод: Земное железо чаще встречается в виде минералов (демонстрация минералов).
| Химическая формула | Содержание Fe(%) | Важнейшие месторождения | |
| Магнетит | Fe3O4 | до 72 | Южный Урал (Магнитогорск), Курская магнитная аномалия |
| Лимонит | 2Fe2O3. 3H2O | до 60 | в районе Курской магнитной аномалии |
| Сидерит | FeCO3 | до 10 | г. Братск |
| Пирит | FeS2 | до 47 | Урал |
По запасам в земной коре железо занимает четвёртое место после кислорода, кремния и алюминия. Ядро нашей планеты, по мнению учёных, состоит из никеля и железа.
Редчайшие капризы природы – самородное железо земного происхождения. Такое железо получается в уникальных геологических условиях – там, где потоки расплавленной лавы, богатой оксидом железа, на своём пути встречают пласты каменного угля. Уголь восстанавливает железо до очень чистого металла.
В тетрадях у учащихся записи:
- железо встречается в виде минералов: лимонит, сидерит, колчедан, магнетит;
- иногда можно встретить самородное железо земного происхождения.
Остановка третья: Станция «Химическая»
Учитель: Поистине железо таинственный элемент. Очередная станция «Химическая», которая постоянно строится и здесь всегда нужны специалисты, владеющие навыками химического эксперимента. Вам предстоит провести небольшую практическую работу. Используя указания в путеводителе по станции «Химическая» и соблюдая правила техники безопасности, вы проведёте ряд химических реакций, запишите в тетради результаты этих реакций. Дома, в качестве домашнего задания, оформите выполненные опыты, вновь опираясь на указания в путеводителе, запишите уравнения химических реакций и наблюдаемый вами результат.
-
Проведите реакцию между раствором сульфата меди (II) и железом.
-
Проведите реакцию между железом и раствором серной кислоты.
-
Проведите реакцию между хлоридом железа (III) и раствором гидроксида натрия.
-
Качественная реакция на ион железа Fe2+: взаимодействие сульфата железа (II) и красной кровяной соли (это комплексное соединение, имеющее формулу K3[Fe(CN)4]
-
Качественные реакции на ион железа Fe3+: взаимодействие хлорида железа (III) и роданида аммония – NH4SCN, а затем хлорида железа (III) и жёлтой кровяной соли (комплексное соединение с формулой K4[Fe(CN)6].
В тетрадях учащихся записи:
- изменения, происходящие с веществами в каждой реакции (выпадение осадка определённого цвета; окрашивание реагирующей смеси).
Остановка четвёртая: Станция «Практическая»
Экскурсовод: Железо имеет огромное значение для человека и всех живых организмов. Без соединений железа мы не смогли бы жить. Как же он используется?
- Железо – основа огромного числа отраслей промышленности. Современное общество не может прожить без чугуна и стали – основных продуктов переработки железной руды.
- В неживой природе встречаются минералы, окрашенные из-за присутствия в них железа: красный гранат, зелёный нефрит.
- Растениям этот элемент необходим для образования хлорофилла.
- Основная масса железа, содержащаяся в организме человека, находится в крови – в эритроцитах и определяет цвет крови. В организме взрослого человека содержится 4кг железа. Почти 2/3 его входит в состав гемоглобина. В организм железо поступает с пищей. В пищевых продуктах содержится железо Fe3+, а клетки кишечника пропускают только Fe2+. В кишечнике происходит восстановление Fe3+ в Fe2+ . Из пищи усваивается
от 2 до 20% железа, причём из продуктов растительного происхождения
2 – 8%. Но, если человек плохо прожёвывает пищу, восстановление железа Fe3+ не происходит и железо остаётся недоступным. На усвоение железа влияет и состав пищи. Так, в присутствии витамина С и фруктозы железо Fe2+ легко усваивается, а чай, кофе, яичные желтки способствуют образованию труднорастворимых соединений, которые не усваиваются организмом. Оптимальная суточная потребность организма в железе составляет 10-20 мг для мужчин и 20-30 мг для женщин, у детей зависит от возраста.
У человека, страдающего недостатком железа в крови, развивается железодефицитная анемия, которую часто называют малокровием.
А вот ибыток его превращает человека в агрессивное существо с жестоким, эгоистичным характером. Такие люди очень активны, постоянно чем-то заняты, любят командовать и из них получаются прекрасные военные, спортивные тренеры, бизнесмены.
Обратите внимание на таблицу, в которой приведены продукты питания, содержащие железо:
Содержание железа в продуктах питания
| Содержание железа мг/100 г | |
| Морская капуста Печень говяжья Фисташки Фасоль Петрушка Овсянка Изюм Земляника Яблоки Макароны Телятина Свекла Kурица Рыба | 16 8,4 7,0 6,4 6,0 4,5 2,7 2,6 2,2 1,5 1,1 1,0 0,7 0,5 |
Используя данные таблицы, определите, сколько фисташек нужно съедать ежесуточно, чтобы восполнять суточную потребность организма в железе (20мг). (Устно).
(ответ: примерно 300г).
IV. Подведение итогов:
1) Путешествие закончилось. Можно подвести итоги: элемент, с которым мы сегодня познакомились – удивителен. Железо – основа всей металлургии, машиностроения, железнодорожного и автомобильного транспорта, судостроения, грандиозных инженерных сооружений – от Эйфелевой башни до ажура железнодорожных мостов. Всё, всё – начиная от швейной иголки, гвоздя, топора и кончая паутиной железных дорог, плавающими крепостями –авианосцами и линкорами и огнедышащими домнами, где рождается само железо, - состоит из железа. Железо – металл созидания.
2) И, как водится в жизни, я прошу вас поделиться своими впечатлениями о путешествии. Для этого допишите предложения, посвящённые сегодняшнему уроку:
Сегодня я узнал……..
Я удивился ……….
Теперь я умею……….
Я хотел бы ……..
3) Выставление оценок активным участникам урока. Дополнительные оценки за сегодняшний урок будут выставлены за оформление практической работы.
V. Домашнее задание:
- оформить практическую работу;
- выучить параграф 14.
И ещё: я хотела бы вам пожелать: пусть ваш мозг истирается от работы мысли, а не пожирается ржавчиной от лени.
VI. Используемая литература:
1. Габриелян О.С. учебник «Химия 9 класс»; Москва, изд-во «Дрофа», 2009 г.
2. Габриелян О.С., Остроумова И.Г. «Настольная книга учителя», Москва, изд-во «Дрофа», 2003 г.
3. Горковенко М.Ю. «Поурочные разработки к учебнику Габриеляна О.С. «Химия 9 класс»», Москва, «Дрофа"
Здесь представлен конспект к уроку на тему «Железо - общее представление», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

