Конспект урока «Исследование гидролиза солей» по химии
Тема занятия: Исследование гидролиза солей.
Цели занятия: Провести исследования растворов некоторых солей и доказать, что большинство из них подвергаются гидролизу.
Задачи занятия:
-
Закрепить знания о гидролизе вообще и о гидролизе солей в частности;
-
Научить составлять полные и сокращённые ионные уравнения реакций гидролиза солей;
-
Сформировать умение предсказывать среду растворов различных солей;
-
Закрепить знания теории электролитической диссоциации.
Оборудование:
растворы различных солей в химических стаканах объемом 50 мл, дистиллированная вода для промывания датчика, датчик определения рН растворов из комплекта лабораторного оборудования «Polytech», ноутбуки.
Ход занятия:
Учитель вносит несколько дежурных растворов солей.
?: Почему в некоторых растворах со временем появляется осадок?
?: Что такое гидролиз?
Уч-к: Гидролиз — это взаимодействие солей с водой.
Уч-ль: Сформулируйте цели этого занятия!
Уч-к: Выяснить, какие соли подвергаются гидролизу и почему?
Уч-ль: Многие думают, что гидролиз — это когда в условии написано «прилили воду». И это тоже. Но если нам дан раствор соли, то это значит, что эта самая соль уже вступила во взаимодействие с водой.
Вот стоит стакан с раствором какой-то соли. Если очень повезет, то раствор может быть даже цветным. Соль в растворе находится в виде ионов — т.е. она уже провзаимодействовала с водой — продиссоциировала на ионы.
Тема гидролиза довольно обширная и в данном курсе мы рассмотрим ее только в формате подготовки к ЕГЭ. Поступите в ВУЗы, будете изучать степени гидролиза, константы и т.д.
Мы знаем, что любая соль состоит из двух составляющих - катиона (металла, например) и аниона — кислотного остатка. Классический пример образования соли — взаимодействие основания и кислоты.
основание + кислота = соль + H2O
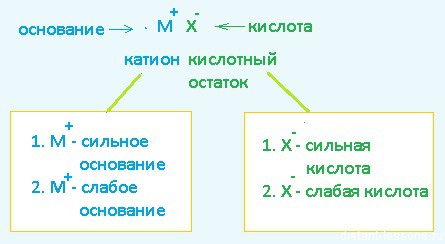
Давайте рассмотрим эту схему на конкретных примерах
| Cлабые основания | |
|
|
| Кислоты средней силы | Cлабые кислоты | |
| HNO3 H2SO4 HCl, HBr, HI HClO4 | HF H2SO3 H3PO4 | H2S H2CO3 H2SiO3 H3BO3 CH3COOH и все остальные органические кислоты |
pH — водородный показатель — показатель количества ионов водорода H+ в растворе.
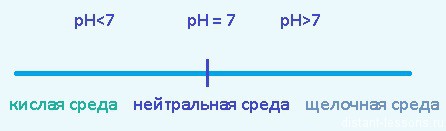
1.1 Соль образована сильным основанием и сильной кислотой
NaCl — соль образована сильным основание NaOH и сильной кислотой HCl.
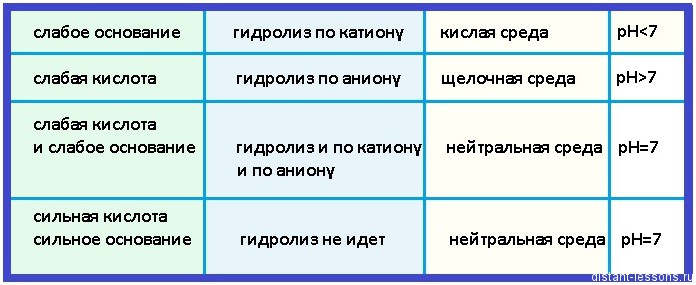
Такие соли не подвергаются гидролизу, реакция среды раствора - нейтральная, pH примерно = 7
1.2 Соль образована сильным основанием и слабой кислотой
Na2S — соль образована сильным основанием NaOH и слабой кислотой H2S.
Давайте посмотрим, что происходит при взаимодействии такой соли с водой:
Na2S + H2O =2NaOH + H2S
В ионном виде:
2Na+ + S-2 + H2O =2Na+ + 2OH-+ H2S — полное ионное уравнение
в растворе остались ионы Na+ и OH- — реакция среды раствора - щелочная, pH > 7
Это гидролиз по аниону.
2.1 Соль образована слабым основанием и сильной кислотой
CuCl2 — соль образована нерастворимым в воде основанием Cu(OH)2 и сильной кислотой HCl
CuCl2 + H2O = Cu(OH)2 ↓ + 2HCl
В ионном виде:
Сu2+ +2Cl- + 2H2O = Cu(OH)2↓ + 2H+ + 2Cl- — полное ионное уравнение
в растворе остались ионы H+ и Cl- — реакция среды раствора - кислая, pH
Это гидролиз по катиону.
2.2 Соль образована слабым основанием и слабой кислотой
(NH4)2S — соль образована слабым основанием NH4OH и слабой кислотой H2S
(NH4)2S + 2H2O =2NH3↑ + H2O + H2S↑
В ионном виде:
2NH4+ + S2- + 2H2O =2NH3↑ + H2O + H2S↑ — полное ионное уравнение
осталась только вода H2O — реакция среды раствора нейтральная, pH=7
Это гидролиз и по катиону, и по аниону
Есть очень простое для запоминания правило - что слабое, по тому идет гидролиз.
Закрепление изученного материала:
Проведение исследования: самостоятельная работа учащихся по исследованию растворов различных солей. На
Выводы по занятию:
Итак, сегодня мы закрепили ваши знания явления гидролиза солей. Прошу дать краткие ответы на мои вопросы:
-
Что такое гидролиз?
-
На какие группы мы разделили все соли?
-
Как происходит гидролиз каждой группы?
Проверим результативность нашей совместной исследовательской деятельности:
Какие результаты вы получили при исследовании растворов солей?
| | | | | | | | | | |
| Показатель рН | | | | | | | | | |
Решение теста: Откройте на рабочем столе папку «Тесты по химии». Найдите в ней тест «Гидролиз солей» и выполните его.
Вывод по занятию: достигли ли цели? узнали ли вы сегодня чего-то новое?
Дополнительное задание:
Установите соответствие между солью и ее способностью к гидролизу.
СОЛЬ СПОСОБНОСТЬ К ГИДРОЛИЗУ
а) ВаCl2 1) по катиону
б) NH4F 2) по аниону
в) CuSO4 3) по катиону и аниону
г) СН3СООNa 4) гидролизу не подвергается
| 2 | 3 | 4 | |
| в | г | б | а |
Здесь представлен конспект к уроку на тему «Исследование гидролиза солей», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

