Конспект урока «Гидролиз солей» по химии
Дата _____________ Класс ____________________
Тема: Гидролиз солей
Цели урока: сформировать у учащихся понятие гидролиза солей.
Ход урока
1. Организационный момент
Лежа дома на диване
Про прогулку думал Ваня
Сколько в мире,- думал Ваня,-
Есть кислот и оснований
Например, вода морей-
Это ведь раствор солей.
Где-то я читал когда-то:
Там хлориды и сульфаты…
И соляной там и серной
Кислоты полно наверно:
Ведь вчера прошли мы в школе
Что в воде идет гидролиз!
И зачем себе на горе
Люди в отпуск едут к морю?
Если долго там купаться
Можно без трусов остаться:
Ткань любую кислота
Растворяет кислота
Ванин слушая рассказ,
Целый час смеялся класс
Больше Ваню не дразните,
Ведь сказал ему учитель:
"Зря Иван поддался страху,-
Лучше б шел купаться в море!"
Сейчас мы рассмотрим, что такое гидролиз, и в конце урока скажем, почему Ваня боялся зайти в море.
2. Изучение нового материала
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита.
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
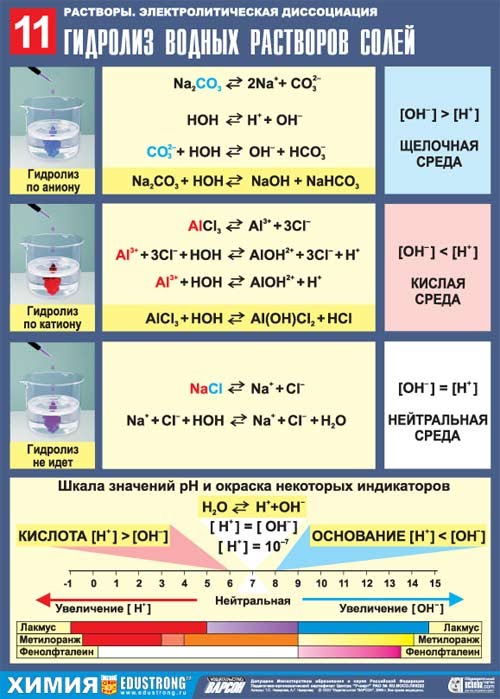
1) Гидролиз не возможен
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl,NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
2) Гидролиз по катиону (в реакцию с водой вступает только катион)
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl,Al2(SO4)3, MgSO4) гидролизу подвергается катион:
FeCl2 + HOH Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- FeOH+ + 2Cl- + Н+
В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора
3) Гидролиз по аниону (в реакцию с водой вступает только анион)
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3,Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН- и другие ионы.
K2SiO3 + НОH KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH- НSiO3- + 2K+ + ОН-
рН таких растворов > 7 (раствор приобретает щелочную реакцию).
4) Совместный гидролиз (в реакцию с водой вступает и катион и анион)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4,(NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Аl2S3 + 6HOH =>2Аl(ОН)3 + 3Н2S
Гидролиз солей многокислотных оснований и многоосновных кислот проходит ступенчато
Например, гидролиз хлорида железа (II) включает две ступени:
1-ая ступень
FeCl2 + HOH Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H+ + OH- Fe(OH)+ + 2Cl- + H+
2-ая ступень
Fe(OH)Cl + HOH Fe(OH)2 + HCl
Fe(OH)+ + Cl- + H+ + OH- Fe(ОН)2 + Н+ + Cl-
Гидролиз карбоната натрия включает две ступени:
1-ая ступень
Nа2СО3 + HOH NаНСО3 + NаОН
СО32- + 2Na+ + H+ + OH- =>НСО3- + ОН- + 2Na+
2-ая ступень
NаНСО3 + Н2О NаОН + Н2СО3
НСО3- + Na+ + H+ + OH- Н2СО3 + ОН- + Na+
Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Мg(ОН)2, Fe(ОН)2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота ( СН3СООН, Н2СО3 ) - со щелочью.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
Алгоритм составления уравнений гидролиза солей
| Пример | ||||
| 1. Определяем силу электролита – основания и кислоты, которыми образована рассматриваемая соль.
Помните! Гидролиз всегда протекает по слабому электролиту, сильный электролит находится в растворе в виде ионов, которые не связываются водой.
| Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3)
| |||
| 2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли:
| 2Na+ + CO32- + H+OH- ↔ Это гидролиз по аниону От слабого электролита в соли присутствует анион CO32- , он будет связываться молекулами воды в слабый электролит – происходит гидролиз по аниону.
| |||
| 3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды | 2Na+ + CO32- + H+OH- ↔ (HCO3)- + 2Na+ + OH-
В продуктах реакции присутствуют ионы ОН-, следовательно, среда щелочная pH>7 | |||
| 4. Записываем молекулярное гидролиза | Na2CO3 + HOH ↔ NaHCO3 + NaOH
|
Факторы, влияющие на степень гидролиза.
1). Гидролиз эндотермическая реакция, поэтому повышение температуры усиливает гидролиз.
2). Повышение концентрации ионов водорода ослабляет гидролиз, в случае гидролиза по катиону. Аналогично, повышение концентрации гидроксид-ионов ослабляет гидролиз, в случае гидролиза по аниону.
3). При разбавлении водой равновесие смещается в сторону протекания реакции, т.е. вправо, степень гидролиза возрастает.
4). Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4
раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
5). Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это помогает константа равновесия. Да, при добавлении соли, то есть фосфат-ионов
Rb3PO4 + H2O Rb2HPO4 + RbOH,
равновесие будет смещаться вправо, концентрация гидрофосфат и гидроксид-ионов будет возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что для того, чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH–] / [PO43–], уменьшится вдвое.
Так для наших примеров 1 и 2 выражения констант равновесия (констант гидролиза) имеют вид:
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4 (1)
Rb3PO4 + H2O Rb2HPO4 + RbOH (2)
Мы возвращаемся к стихотворению и отвечаем, почему же Ваня боялся зайти в море.
Значение гидролиза: Гидролиз имеет большое практическое значение для человека, касаясь органических веществ: жиров, спиртов, мыла, крахмала, которые подробно изучаются в 10 классе.
3. Закрепление изученного материала
№1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 , AlCl3, K2S.
№2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
№3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ:
Сульфид Калия - K2S, Бромид алюминия - AlBr3, Хлорид лития – LiCl, Фосфат натрия - Na3PO4, Сульфат калия - K2SO4, Хлорид цинка - ZnCl2, Сульфит натрия - Na2SO3, Cульфат аммония - (NH4)2SO4, Бромид бария - BaBr2 .
4. Домашнее задание
П. 6, упр. 9 на стр. 24
Здесь представлен конспект к уроку на тему «Гидролиз солей», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

