Конспект урока «Обобщение и систематизация знаний по теме « Чистые вещества и смеси, массовая и объемная доли» по химии
Конспект урока по теме «Обобщение и систематизация знаний по теме « Чистые вещества и смеси, массовая и объемная доли»».
Цель урока:
1) Обобщить и систематизировать сведения о веществах, их агрегатных состояниях, наличие примесей.
2) Развивать умения анализировать, прогнозировать, обобщать. Формировать навыки и умения самостоятельной работы и работы в коллективе.
3) Развивать ответственность, инициативность, творчество, добросовестное отношение к выполняемой работе. Воспитывать понимание значимости химических знаний в повседневной жизни.
Оборудование: компьютер, проектор, жетоны.
Ход урока.
-
Организационный момент.
-
Сообщение темы и цели урока.(2мин)
-
Проверка усвоения материала предыдущих уроков.(15мин)
-
Закрепление изученного материала. (20мин)
-
Подведение итогов урока.(5мин)
-
Выставление оценок.(2мин)
-
Домашнее задание.
3. Проверка усвоения материала предыдущих уроков:
Учитель:Ребята на прошлых уроках мы с вами познакомились с чистыми веществами и смесями , массовой и объемной долей, а сегодня мы с вами еще раз повторим и закрепим в виде игры.
(игра-«Брейн-ринг»)
Для этого учитель сам сначала задает один вопрос какому- либо ученику. При ответе на вопрос учителя (если он верно ответил), то ученик может задать свой вопрос (короткий- имеющий ответ в нескольких словах другому ученику), а потом вовлекается весь класс без участия учителя. Учитель только контролирует правильность ответов и за правильный ответ ученик получает жетон.
Подобные вопросы:
-
Какие виды вод вы знаете?
-
Что представляет собой морская и дистиллированная вода?
-
Что представляет собой природная, речная, океанская вода?
-
Что такое смеси?
-
Какие виды смесей вы знаете?
-
Что такое однородная смесь?
-
Что такое неоднородная смесь?
-
Какая вода бывает?
-
Что такое массовая доля?
-
Как она обозначается и в чем выражается?
-
Как находится массовая доля?
-
Что такое объемная доля?
-
Как она обозначается и в чем выражается?
-
Как находится объемная доля?
Если ответ ученика на вопрос был неполным, то ему дается жетон светло-розовый, если ответ был полным, но с некоторыми недочетами, то ему дается жетон желтого цвета, если ответ был исчерпывающим, то жетон дается красного цвета, но. а если ответа вообще не было, жетон черного цвета. Главная задача ребят набрать больше жетонов за весь урок.
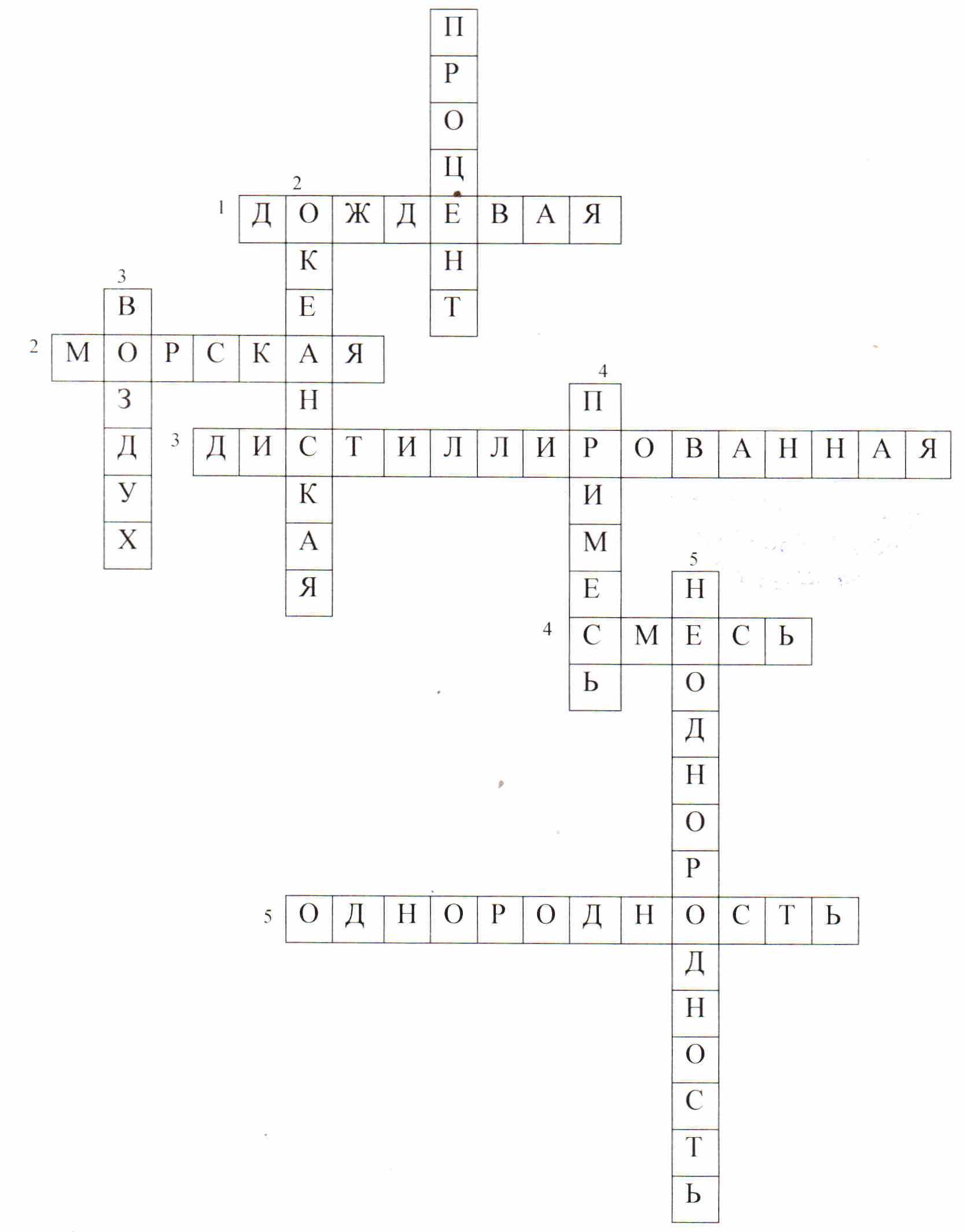
После игры в «брейн-ринг» учащимся предлагается закрепить на «Кроссворде».
4. Закрепление изученного материала:
На экран выводится кроссворд, клетки которого пустые, необходимо чтобы учащиеся его разгадали. Но вопросы выводятся поочередно, сначала вопрос по вертикали, затем по горизонтали. За правильный ответ учащиеся также получают жетоны. Здесь все зависит от подготовленности к уроку ученика. (На решение кроссворда отводится 10 минут, по одной минуте на вопрос)
Выводятся вопросы:
По вертикали:
-
Вода, которая содержит небольшое количество примесей, захваченные из воздуха?
-
Вода, основную массу которой, составляет NaCl?
-
Вода, содержащая очень мало примесей?
-
Материал, состоящий из двух или несколько веществ, хаотично чередующихся друг с другом в пространстве?
-
Смеси, в которых нельзя заметить границу раздела фаз между веществами?
По горизонтали:
1. В чем измеряется массовая и объемная доли?
2. Вода, которая замерзает при t0 = -1,90С?
3. Что представляет собой смесь, состоящая из O2, N2, Ar, Ne, CO2?
4. Состав чего, устанавливают с помощью химического анализа?
5. Смесь, которая имеет границу раздела фаз( видно невооруженным взглядом)?
Ответы на кроссворд:
По вертикали-
-
Дождевая
-
Морская
-
Дистиллированная
-
Смесь
-
Однородность.
По горизонтали-
-
Процент
-
Океанская
-
Воздух
-
Примесь
-
Неоднородность.
После разгадывания кроссворда, ученикам предлагается решить задачу сначала по алгоритму, а затем самостоятельно, после чего ученику представляется возможность предоставить ее решение учителю.
Задача: Вычислите массу гидроксида натрия, необходимого для приготовления 400г 20% -ного раствора гидроксида натрия?
Алгоритм решения задачи
| Оформление решения задачи | |
| С помощью соответствующих обозначений запишем условия задачи. Выразим массовую долю вещества с помощью десятичной дроби( для этого значение массовой доли, выраженной в процентах, поделим на 100, перенося запятую на два знака влево). | Д m р-ра (NAOH)=400г W m в-ва(NAOH)=?г |
| Записываем формулу для расчета массовой доли вещества в растворе. | Решение: W=mв-ва / mр-ра |
| Преобразуем данную формулу для расчета массы вещества | mв-ва = mр-ра ∙ w |
| Подставим цифровые данные в эту формулу и произведем расчет | mв-ва(NAOH)= 400г ·0,2 =80г |
| Запишем ответ | Ответ. mв-ва(NAOH)=80г |
Задача для самостоятельного решения:
Вариант-1: Сколько граммов сахара нужно взять, чтобы приготовить 250г 12%-го раствора его?
Вариант-2: Определите массу сульфата магния , чтобы приготовить 55 г 15% -го раствора .
О твет учащегося, решения задачи 1-го варианта :
твет учащегося, решения задачи 1-го варианта :
Дано: Решение
m(сахара)р -ра =250г W=mв-ва / mр-ра
w(сахара) == 12 %
 mв-ва = mр-ра ∙ w
mв-ва = mр-ра ∙ w
m(сахара)в –ва = ?
Вычисление:
mв-ва(сахара)=250г ·0,12=30г
Ответ. mв-ва(сахара)=30г
Ответ учащегося, задачи 2-го варианта:
Д ано: Решение
ано: Решение
m(MgSO4)р -ра =55г W=mв-ва / mр-ра
w(MgSO4) == 15 %
 mв-ва = mр-ра ∙ w
mв-ва = mр-ра ∙ w
m(MgSO4)в –ва = ?
Вычисление:
mв-ва(MgSO4)=55г ·0,15=8,25г
Ответ. mв-ва(MgSO4)=8,25г
5.Подведение итогов урока:
Учитель: Итак давайте подведем итоги урока. На уроке мы с вами закрепили виды вод.
Ответ учеников:
Морская (Вода, основную массу которой, составляет NaCl)

 Океанская (Вода, которая замерзает при t0 = -1,90С)
Океанская (Вода, которая замерзает при t0 = -1,90С)

Д истиллированная(Вода, содержащая очень мало примесей)
истиллированная(Вода, содержащая очень мало примесей)
 Речная (Вода, содержащая в себе нерастворимые частицы)
Речная (Вода, содержащая в себе нерастворимые частицы)
Природная (Дождевая) (Вода, чистая, но содержит незначительное количество примесей из воздуха)
Учитель: Также выяснили виды смесей.
Ответ учащихся:

Однородные Неоднородные
По содержанию солей кальция и магния, вода подразделяется на:
-
Жесткую
-
Мягкую.
Учитель: Разобрали понятие массовой и объемной доли, дали определение, в чем измеряет, как находится:
Ответ учащихся:
W- массовая доля [%] или [доля]
φ-объемная доля [%] или [доля]
W- отношение массы растворенного вещества к общей массе раствора.
φ-отношение объема растворенного вещества к смеси.
![]() =
= ![]() φ =
φ =![]()
6 . Выставление оценок. (подводим подсчет жетонов начиная с 2 и выше)
. Выставление оценок. (подводим подсчет жетонов начиная с 2 и выше)
Светло-розовые -3 – оценка «3»
4 - оценка «4»
5 – оценка «5»
Желтые 2 - оценка «3»
3 - оценка «4»
4 - оценка «5»
Красные 2 - оценка «4»
3 - оценка «5»
7. Домашнее задание: №7, №6 из §24. Составить алгоритм решения задачи на нахождение объемной доли.
Здесь представлен конспект к уроку на тему «Обобщение и систематизация знаний по теме « Чистые вещества и смеси, массовая и объемная доли», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

 (
(