Конспект урока «Гидролиз солей» по химии для 11 класса
Муниципальное бюджетное образовательное учреждение
"Белогорская средняя общеобразовательная школа"
МО "Холмогорский муниципальный район"
Архангельской области
Конспект урока по химии
в 11 классе
«Гидролиз солей»
подготовила
учитель химии и биологии
Кукина Галина Александровна
п. Белогорский
Тип урока: комбинированный
Цель урока. Сформировать представление у обучающихся о сущности гидролиза солей.
Задачи:
Образовательные: расширить знания о свойствах солей, сформировать у учащихся знания о возможности и характере протекания гидролиза различных типов солей, научить определять реакцию среды в растворах солей, составлять уравнения гидролиза. Дать представление о практическом применении гидролиза, о факторах, влияющих на степень гидролиза.
Развивающие: совершенствовать умение работать с учебным материалом, выделять необходимую информацию, пользоваться алгоритмическими действиями, делать логические выводы из наблюдения за проведенным экспериментом. Развивать навыки научного познания методами поисково-экспериментальной деятельности обучающихся.
Воспитательные: формировать естественнонаучное мировоззрение, стремление к творческой, познавательной деятельности, умения применять изученный материал в практических ситуациях, защищать свои убеждения, формулировать и аргументировать собственное мнение, работать в группе.
Оборудование и реактивы: таблица растворимости кислот, оснований, солей в воде; индикаторная шкала; штатив с пробирками, растворы лакмуса, фенолфталеина, метилового оранжевого, соляной кислоты, гидроксида натрия, хлорида цинка, карбоната натрия, хлорида натрия, хлорида алюминия, сульфата цинка, сульфата железа (II), сульфида натрия, карбоната калия, силиката натрия, сульфата натрия, хлорида кальция, бромида калия, нитрата бария, хлорида железа (III), ацетата аммония, сульфида аммония, сульфата аммония; зола, хозяйственное мыло, питьевая сода, желудочный сок..
Используется проблемно-поисковый метод обучения.
Ход урока:
1.Организационный момент
2. Подготовка учащихся к усвоению новых знаний, постановка проблемы
Как известно, присутствие в растворе кислот и оснований можно обнаружить с помощью индикаторов.
Учитель демонстрирует опыты: изменение окраски индикатора в пробирках с растворами гидроксида натрия, соляной кислоты (например, лакмус в растворе кислоты краснеет, а в растворе основания становится синим).
Чем вызвано изменение окраски индикатора в растворах кислоты и основания?
Обучающиеся: Изменение окраски индикатора вызвано присутствием в растворе кислоты ионов Н+, а в растворе основания – ионов ОН-.
Таблица "Изменение цвета индикаторов в различных средах"
| Лакмус | Метиловый оранжевый | реакция | Какие ионы | |
| -- | | | кислая | Н+> |
| | | | щелочная | OH-> |
| -- | | | нейтральная | H+= OH- |
Казалось бы, в растворах солей, при диссоциации которых не образуется ни ионов Н+, ни ионов ОН-, окраска индикаторов меняться не должна. Проверим это экспериментально.
Учитель демонстрирует опыты: в пробирки с растворами солей карбоната натрия, хлорида цинка и хлорида натрия добавляем по каплям индикатор лакмус (происходит изменение окраски индикатора в пробирках с растворами солей карбоната натрия, хлорида цинка, в растворе хлорида натрия окраска индикатора не изменилась).
Постановка проблемы: В растворах солей карбоната натрия, хлорида цинка, при диссоциации которых не образуется ни ионов Н+, ни ионов ОН-, окраска индикаторов изменилась. Чем это обусловлено?
Обучающиеся: Следовательно, в растворе хлорида цинка (лакмус красный) образуются ионы Н+, а в растворекарбоната натрия (лакмус синий) - ионы ОН-.
Соли находятся в растворе, следовательно молекулы воды являются источниками катионов водорода и гидроксид-ионов.
Учитель: Что представляет собой вода с точки зрения теории электролитической диссоциации?
Обучающиеся:
Вода – слабый электролит, она незначительно диссоциирует:
НОН ↔ Н+ + ОН –, и существует равенство концентрации для нейтрального раствора:
[H+] = [OH –] = 10 – 7 моль/л.
pH = 7
Таким образом, если pH = 7 – среда раствора нейтральная; pH > 7 – щелочная; pH
Взаимодействие ионов соли с водой с образованием слабого электролита - гидролиз. От греческого "гидро" - вода, "лизис" - разложение (что означает "разложение водой"). Итак, тема урока – Гидролиз солей.
Определение задач урока (обучающиеся + учитель): Что мы должны узнать о гидролизе солей на уроке:
- Почему соли реагируют по-разному с водой?
- Почему реакция среды в растворах одних солей кислая, других щелочная, а в третьих нейтральная?
- Какие продукты реакции образуются при гидролизе солей?
- Научиться записывать уравнения гидролиза солей.
- Решать задания ЕГЭ по теме «Гидролиз солей».
Учитель: Как можно решить поставленные нами задачи? (Через эксперимент)
3.Изучение нового материала
Поисково-экспериментальная деятельность обучающихся (Обучающиеся планируют ход эксперимента, делают выводы. Результат: осмысление понятия «гидролиз солей», выстраивание классификации солей).
Учитель: Исследуйте среду водных растворов солей с помощью индикаторов, представленных у вас на столах. Будьте готовы проанализировать полученные результаты и сделать выводы.
Инструктаж о правилах ТБ и ОТ во время проведения химического эксперимента.
Предполагается работа в группах:
Первая группа: растворы хлорида алюминия, сульфата цинка, сульфата железа (II).
Вторая группа: растворы сульфида натрия, карбоната калия, силиката натрия.
Третья группа: растворы сульфата натрия, хлорида кальция, бромида калия.
(1 группа – соли, растворы которых ведут себя по отношению к лакмусу как кислоты.
2 группа – соли, растворы которых ведут себя по отношению к лакмусу и фенолфталеину как щелочи.
3 группа соли, растворы которых не изменяют окраску индикаторов)
Обсуждение результатов химического эксперимента:
Первая группа: в растворах солей лакмус стал красным, метиловый оранжевый розовым, окраска фенолфталеина не изменилась.
Учитель: Какая реакция среды в растворах данных солей? (Кислая)
Почему растворы солей имеют кислую реакцию среды? (В этих растворах есть ионы H+)
Вторая группа: в растворах солей лакмус стал синим, метиловый оранжевый желтым, фенолфталеин малиновым.
Учитель: Какая реакция среды в растворах данных солей? (Щелочная)
Почему растворы солей имеют щелочную реакцию среды? (В этих растворах есть ионы ОH-)
Третья группа: в растворах солей лакмус - фиолетовый, метиловый оранжевый – оранжевый, фенолфталеин бесцветный. Растворы солей не изменили окраску индикаторов.
Учитель: Какая реакция среды в растворах данных солей? (Нейтральная)
Почему растворы солей имеют нейтральную реакцию среды? (В этих растворах нет свободных H+ и OH- -ионов)
Учитель: Откуда в растворе появились ионы H+ или OH-, если для приготовления раствора смешивали соль и воду? (Из воды)
Вопрос к первой группе: Как от воды могли отделиться ионы H+?
Обучающиеся: Видимо какая-то частица соли отрывает из молекулы воды частицу OH-.
Отрицательную частицу из молекулы воды может оторвать положительная частица из соли.
Учитель: Что же общего у катионов Al3+, Zn2+, Fe2+? Почему именно они присоединяют гидроксид-ионы?
Обучающиеся: Потому, что Al(OH)3, Zn(OH)2, Fe(OH)2 – cлабые основания.
Вопрос ко второй группе: Как от воды могли отделиться ионы ОH-?
Обучающиеся: Видимо какая-то частица соли отрывает из молекулы воды частицу H+.
Положительную частицу из молекулы воды может оторвать отрицательная частица из соли.
Учитель: Что же общего у анионов S2-, CO32-, SiO32-? Почему именно они присоединяют ионы водорода?
Обучающиеся: Потому, что H2S, H2CO3,H2SiO3– cлабые кислоты.
Вывод: При растворении многих солей в воде происходит связывание одного из ионов, образовавшихся при диссоциации воды (Н+ или ОН-) в слабый электролит с катионами или анионами солей. Это приводит к смещению равновесия диссоциации воды и накоплению другого иона.
Н2О↔ Н+ + ОН- (→).
Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли показывает кислую или щелочную среду.
Вопрос к третьей группе:
Учитель: Что же общего у ваших солей?
Обучающиеся: Соли Na2SO4, CaCl2, KBr – образованы сильными основаниями и сильными кислотами.
Видимо с водой не взаимодействуют остатки сильных электролитов кислот и оснований.
Вывод: Взаимодействовать с составными частями воды может только катион слабого основания или слабой кислоты.
Если соль образована сильной кислотой и сильным основанием, реакция ее раствора будет нейтральной: катионы металла и анионы кислотного остатка не взаимодействуют с молекулами воды, а значит, в растворах таких солей нет H+ и OH- -ионов.
Хлорид натрия NaCl - соль сильного основания NaOH и сильной кислоты HCl. Хлорид натрия диссоциирует с образованием с образованием ионов: NaCl ↔ Na+ + Cl-
Взаимодействие ионов в растворе протекает в том случае, если это приводит к связыванию ионов, то есть образованию мало растворимого или мало диссоциирующего вещества. Возможно ли взаимодействие ионов Na+ и Cl- с ионами H+ и OH-, образовавшимися при диссоциации воды? При взаимодействии ионов Na+ и ОН- мог бы образоваться гидроксид натрия NaОН. Однако гидроксид натрия – сильное основание и в растворе полностью диссоциирует на ионы. Поэтому взаимодействия между ионами Na+ и ОН - не происходит. Ионы H+ и Cl- также не взаимодействуют между собой: HCl - сильная кислота и в растворе полностью диссоциирована. Таким образом, связывания ионов в растворе хлорида натрия происходить не может. Поэтому хлорид натрия гидролизу не подвергается.
Общий вывод: Результат гидролиза зависит от того, каким основанием и какой кислотой образована соль. Возможны 4 варианта (таблица на доске и в инструктивных картах; заполняют обучающиеся).
| Кислота | ||
| сильная | слабая | |
| Сильное | Na2SO4, CaCl2, KBr Гидролиз не протекает Нейтральная среда (рН=7) | Na2S, K2CO3,Na2SiO3 Гидролиз по аниону Щелочная среда (рН > 7) |
| Слабое | AlCl3, ZnSO4, FeSO4 Гидролиз по катиону Кислая среда (рН | |
В результате рассуждений обучающиеся приходят к выводам:
1. Если соль образована сильной кислотой и слабым основанием, реакция ее раствора будет кислая. Причина этому – взаимодействие катиона – остатка слабого основания с молекулами воды:
В данном случае имеет место гидролиз по катиону.
2. Если соль образована слабой кислотой и сильным основанием, реакция ее раствора будет щелочная. Причина этому – взаимодействие аниона-остатка слабой кислоты с молекулами воды.
Этот процесс называется гидролизом по аниону.
3. Если соль образована сильной кислотой и сильным основанием, реакция ее раствора будет нейтральной: катионы металла и анионы кислотного остатка не взаимодействуют с молекулами воды, а значит, в растворах таких солей нет H+ и OH- -ионов.
Гидролиз не протекает.
Учитель: О том как ведут себя в растворе соли, образованные слабым основанием и слабой кислотой поговорим чуть позже.
Рассмотрим примеры гидролиза изученных типов солей:
Алгоритм составления уравнений обратимого гидролиза солей.
1.Определяем состав соли
2.Записываем уравнение диссоциации соли
3.Записываем ионное уравнение гидролиза; определянем среду раствора
4.Составляем молекулярное уравнение гидролиза
1.Соли, образованные слабым основанием и сильной кислотой (работаем по алгоритму):
1.Определяем состав соли:

 Zn(OH)2 – слабое основание
Zn(OH)2 – слабое основание
Z nCl2
nCl2
 HCl – сильная кислота
HCl – сильная кислота
В водном растворе происходит полная диссоциация хлорида цинка, так как он сильный электролит и незначительная диссоциация молекул воды:
2.Записываем уравнение диссоциации соли:
ZnCl2 = Zn2+ + 2Cl-
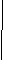


ZnCl2 = Zn2+ + 2Cl-
НОН ↔ ОН – + Н+

Катионы слабого основания Zn2+ участвуют в реакции гидролиза; образуется слабый электролит – катион ZnОН+; в растворе появляются свободные ионы водорода Н+ и среда становится кислой:
3.Записываем ионное уравнение гидролиза:
Zn2+ + 2Cl- + Н+ ОН- ↔ ZnОН+ + 2Cl- + Н+
Zn2+ + Н+ ОН- ↔ ZnОН+ + Н+ (сокращенное ионное уравнение)
(кислая реакция среды рН
4.Ионному уравнению соответствует молекулярное.
Составляем молекулярное уравнение гидролиза:
ZnCl2 + Н2О ↔ ZnОН+ Cl- + НCl
Образовалась основная соль хлорид гидроксоцинка
Названия основных солей, как и названия средних, следует составлять из названия аниона и названия катиона, в данном случае соль назовем хлорид гидроксоцинка.
А может ли гидроксокатион вступить в реакцию со следующей молекулой воды? Сообщаем, что это будет вторая ступень гидролиза, и что каждая следующая ступень протекает в тысячи раз слабее, чем предыдущая. Поэтому, как правило, рассматривается только первая ступень гидролиза. Хотя при сильном разбавлении и нагревании может в небольшой степени протекать гидролиз образовавшейся основной соли (вторая ступень).
2.Соли, образованные сильным основанием и слабой кислотой (работаем по алгоритму):
1.Определяем состав соли:

 NaOH – сильное основание
NaOH – сильное основание
N a2CO3
a2CO3
 H2CO3 – слабая кислота
H2CO3 – слабая кислота
В водном растворе происходит полная диссоциация карбоната натрия, так как он сильный электролит и незначительная диссоциация молекул воды:
2.Записываем уравнение диссоциации соли:
Na2CO3 = 2Na + + CO32-
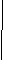


Na2CO3 = 2Na + + CO32-
НОН↔ ОН – + Н+

Анионы слабой кислоты CO32- участвуют в реакции гидролиза; образуется слабый электролит – анион HCO3- ; в растворе появляются свободные гидроксид-ионы ОН- и среда становится щелочной:
3.Записываем ионное уравнение гидролиза:
2Na + + CO32- + Н+ ОН- ↔ 2Na + + HCO3- + ОН-
CO32- + Н+ ОН- ↔ HCO3- + ОН- (сокращенное ионное уравнение)
(щелочная реакция среды рН > 7)
4.Ионному уравнению соответствует молекулярное.
Составляем молекулярное уравнение гидролиза:
Na2CO3 + Н2О ↔ Na+HCO3- + NaОН
Образовалась кислая соль гидрокарбонат натрия.
При сильном разбавлении и нагревании может в небольшой степени протекать гидролиз образовавшейся кислой соли (вторая ступень). Но, как уже было сказано ранее, в обычных условиях гидролиз протекает преимущественно по первой ступени.
3.Соли, образованные сильным основанием и сильной кислотой (работаем по алгоритму):
1.Определяем состав соли:

 NaOH – сильное основание
NaOH – сильное основание
N aCl
aCl
 HCl – сильная кислота
HCl – сильная кислота
В водном растворе происходит полная диссоциация хлорида натрия, так как он сильный электролит и незначительная диссоциация молекул воды:
2.Записываем уравнение диссоциации соли:
NaCl = Na+ + Cl-
НОН ↔ ОН – + Н+
В составе соли нет ионов, способных взаимодействовать с составными частями молекул воды и образовывать слабый электролит. Среда раствора остается нейтральной (рН = 7)
Самостоятельная работа обучающихся (Первичная проверка усвоения знаний): Пользуясь алгоритмом и примерами, записанными в инструктивной карте, составьте по два уравнения гидролиза солей, записанных на доске. (Один в паре составляет одно уравнение, второй – другое. Далее следует взаимопроверка)
Учитель: Настало время поговорить о том как ведут себя в растворе соли, образованные слабым основанием и слабой кислотой?
Обучающиеся прогнозируют результат опыта и аргументируют свой прогноз. (Реакция раствора такой соли будет нейтральной. В данном случае и катион и анион должны реагировать с молекулой воды).
Демонстрационный эксперимент: Добавляем раствор лакмуса в раствор ацетата аммония. Цвет не изменяется – реакция раствора нейтральна. Добавляем индикатор в раствор еще одной соли – сульфида аммония. И вдруг раствор лакмуса из фиолетового стал красным (обсуждение проблемы).
Решение: сила и слабость электролита понятия относительные. Сила электролита сероводородной кислоты оказалась больше, чем гидроксида аммония, поэтому реакция раствора сульфида аммония - кислая.
Учитель рассказывает о константах диссоциации кислот и оснований, учит пользоваться справочными данными.
Гидролиз в растворах солей, образованных слабым основанием и слабой кислотой, проходит в большей степени и по аниону, и по катиону. При этом образуется слабые малорастворимые основания и слабые кислоты. Характер среды в этом случае определяется относительной силой образовавшихся кислоты и основания.
(таблица "Константы диссоциации некоторых слабых электролитов в водных растворах")
Рассмотрим пример гидролиза данного типа солей:
1.Соли, образованные слабым основанием и слабой кислотой (работаем по алгоритму):
В этом случае гидролизу подвергаются как катион, так анион, образуются слабые электролиты
1.Определяем состав соли:

 NHOH – слабое основание
NHOH – слабое основание
C H3COONH4
H3COONH4
 CH3COOН – слабая кислота
CH3COOН – слабая кислота
В водном растворе происходит полная диссоциация карбоната аммония и незначительная диссоциация молекул воды:
2.Записываем уравнение диссоциации соли:
CH3COONH4 = NH4+ + CH3COO-
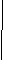





CH3COONH4 = NH4+ + CH3COO-
НОН ↔ ОН – + Н+


Катионы слабого основания NH4+ участвуют в реакции гидролиза; образуются слабые электролиты - NH4ОН(NH3 • Н2О) и CH3COOН.
Среда в растворах солей, образованных слабым основанием и слабой кислотой, зависит от силы образующихся кислоты и основания и может быть нейтральной, слабощелочной или слабокислой. Это зависит от констант диссоциации кислоты и основания.
Соль CH3COONH4 образована слабым основанием NH4OH и слабой кислотой CH3COOH одинаковой силы (Кд (NH4ОН) = 1,76 ·10-5 ~ Кд (CH3COOН) = 1,74 ·10-5). Среда раствора нейтральная.
3.Записываем ионное уравнение гидролиза:
NH4+ + CH3COO - + Н+ ОН- ↔ NH4ОН + CH3COOН
4.Ионному уравнению соответствует молекулярное.
Составляем молекулярное уравнение гидролиза:
CH3COONH4 + Н2О ↔ NH3 • Н2О + CH3COOН
| Кислота | ||
| сильная | слабая | |
| Сильное | Na2SO4, CaCl2, KBr Гидролиз не протекает Нейтральная среда (рН=7) | Na2S, K2CO3,Na2SiO3 Гидролиз по аниону Щелочная среда (рН > 7) |
| Слабое | AlCl3, ZnSO4, FeSO4 Гидролиз по катиону Кислая среда (рН | CH3COONH4, (NH4)2S, Cu(CH3COO)2 Гидролиз по катиону и аниону Нейтральная, слабокислая или слабощелочная среда |
До сих пор мы говорили об обратимом гидролизе солей. В разобранном нами случае (4 тип солей) гидролиз протекает также обратимо.
Учитель: Но гидролиз солей четвертого типа часто идет необратимо (до конца). Чаще всего такими солями являются соли, образованные слабым нерастворимым основанием и слабой неустойчивой, летучей или нерастворимой кислотой.
Продуктами гидролиза таких солей являются соответствующее основание и соответствующая кислота. В водном растворе такие соли не существуют, их нельзя получить реакцией обмена между водными растворами двух солей.
В таблице растворимости стоит прочерк (или запись Гд и Нг) – в водной среде разлагается.
Например, сульфид алюминия реагирует с водой с выделением сероводорода и образованием осадка гидроксида алюминия.
Al2S3+ 6H2O= 2Al(OH)3 + 3H2S
Еще один пример необратимого гидролиза солей - Совместный гидролиз солей
Поисково-экспериментальная деятельность обучающихся
Предполагается работа в парах. Учащиеся получают задание – выполнить 2 опыта.
Инструктаж о правилах ТБ и ОТ во время проведения химического эксперимента.
Опыт 1. К раствору карбоната натрия добавить раствор нитрата бария. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества по таблице растворимости.
Na2SO4 + Ba(NO3)2 = BaSO4↓ + 2NaNO3
белый осадок
Опыт 2. К раствору хлорида железа (III) добавить раствор карбоната натрия. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества по таблице растворимости.
В результате протекания реакции обмена между этими солями должны образоваться две новые соли: хлорид натрия и карбонат железа (III).
2FeCl3 + 3Na2CO3 = Fe2(CO3)3 + 6NaCl
В реакции солей FeCl3 и Na2CO3 обучающиеся наблюдают выпадение бурого осадка и выделение газа, не поддерживающего горение.
Ученики констатируют факт, что среди продуктов нет газа. Учитель рекомендует проверить по таблице растворимости соль Fe2(CO)3. Ученики устанавливают тот факт, что в таблице растворимости на месте этой соли стоит прочерк (Гд). Карбонат железа (III) – в растворе разлагается водой (смотри таблицу растворимости солей), т.е. подвергается полному гидролизу с образованием осадка гидроксида железа (III) и выделением углекислого газа CO2.
Чего мы не учли при написании уравнения реакции? (Взаимодействие веществ с водой).
В левую часть добавить вещество H2O, в правой части соль карбонат железа (III) заменить на осадок гидроксида железа (III) и углекислый газ. Соль хлорид натрия образована сильным основанием и сильной кислотой, поэтому гидролизу не подвергается, в уравнении реакции остается без изменений.
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2 + 6NaCl
2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3↓ + 3CO2
Учитель: Гидролиз - обратимый процесс, поэтому его равновесие может быть смещено изменением концентрации веществ или температуры раствора.
Факторы, влияющие на степень гидролиза.
Разбавление. При разбавлении раствора увеличивается число молекул воды, приходящихся на один гидролизующийся ион соли, поэтому согласно принципу ЛеШателье равновесие смещается вправо, степень гидролиза увеличивается.
Температура. Известно, что реакция нейтрализации всегда протекает с выделением теплоты (экзотермический процесс), следовательно, гидролиз (процесс, обратный реакции нейтрализации) сопровождается поглощением теплоты (эндотермический процесс):
Гидролиз (-Q)
C
 H3COONa + H2O CH3COOH + NaOH
H3COONa + H2O CH3COOH + NaOH
Нейтрализация (-Q)
Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Способы усиления и подавления гидролиза.
Какие факторы усиливают гидролиз?
-
Нагревание – при увеличении температуры равновесие смещается в сторону ЭНДОТЕРМИЧЕСКОЙ реакции – гидролиз усиливается;
-
Добавление воды – т.к. вода является исходным веществом в реакции гидролиза, то разбавление раствора усиливает гидролиз.
Как подавить процесс гидролиза?
Часто необходимо не допустить гидролиза. Для этого:
-
Раствор делают максимально концентрированным (уменьшают количество воды);
-
Для смещения равновесия влево добавляют один из продуктов гидролиза – кислоту, если идёт гидролиз по катиону или щёлочь, если идёт гидролиз по аниону.
Пример: как подавить гидролиз хлорида алюминия?
Хлорид алюминия AlCl3 – это соль, образованная слабым основанием и сильной кислотой – гидролизуется по катиону:
Al3+ + HOH ⇄ AlOH2+ + H+
Среда – кислая. Следовательно, для подавления гидролиза необходимо добавить еще кислоты. Кроме того, следует сделать раствор наиболее концентрированным.
Практическое применение гидролиза.
Поисково-экспериментальная деятельность обучающихся (применение понятия "гидролиз солей" для решения практических задач)
Инструктаж о правилах ТБ и ОТ во время проведения химического эксперимента.
Предполагается работа в группах:
1.Люди с древних времен стирают свои вещи. Но сейчас у нас в обиходе огромное количество моющих средств, а чем стирали раньше? Золой.
Составной частью золы является карбонат калия. За счет чего зола обладает моющими свойствами? Сравнить с раствором хозяйственного мыла. Сделать вывод.
2.Человеческий организм - это четко запрограммированная химическая лаборатория. Все химические реакции в нем происходят четко и быстро. Но иногда случаются неполадки. Например - изжога. Что это? Избыточное количество кислоты. Для устранения изжоги используют раствор питьевой соды (гидрокарбонат натрия). Что происходит при использовании соды?
3.Если на садовом участке у растений желтеют листья и они отстают в росте и развитии, скорее всего это хлороз. Это заболевание вызывает недостаточная кислотность почвы. Почему при хлорозе в почву добавляют удобрение сульфат аммония?
Сообщение обучающегося "Практическое применение гидролиза"
1) Еще в древности в качестве моющего средства использовали золу. В золе содержится карбонат калия, который в воде гидролизуется по аниону, водный раствор приобретает мылкость за счет образующихся при гидролизе гидроксид-ионов.
В настоящее время в быту мы используем мыло, стиральные порошки и другие моющие средства. Основной компонент мыла – это натриевые или калиевые соли высших жирных карбоновых кислот: стеараты, пальмиаты, которые гидролизуются.
Гидролиз стеарата натрия C17H35COONa выражается следующим ионным уравнением:
C17H35COO- + Н+ ОН- ↔ C17H35COOН + ОН-,
то есть раствор имеет слабощелочную среду.
В состав же стиральных порошков и других моющих средств специально вводят соли неорганических кислот (фосфаты, карбонаты), которые усиливают моющее действие за счет повышения рН среды.
2) Соли, создающие необходимую щелочную среду раствора, содержатся в фотографическом проявителе. Это карбонат натрия, карбонат калия и другие соли, гидролизующиеся по аниону.
3) Если кислотность почвы недостаточная, у растений появляется болезнь – хлороз. Ее признаки – пожелтение или побеление листьев, отставание в росте и развитии. Если
рН почвы > 7,5, то в нее вносят удобрения сульфат аммония, который способствует повышению кислотности, благодаря гидролизу по катиону, происходящему в почве:
NH4+ + Н+ ОН- ↔ NH3 • Н2О + Н+
Сильно кислотные почвы известкуют Са(ОН)2 или СаСО3, имеющими щелочную реакцию среды.
4) Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа (II) окисляется до соли железа (III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа (III).
5) На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
В воду, подвергающуюся очистке, после ее отстаивания добавляют раствор сульфата алюминия, который вступает в реакцию с гидрокарбонатом кальция, содержащимся в природной воде, с образованием средней соли карбоната алюминия. Эта соль, образованная слабой кислотой и слабым основанием, подвергается гидролизу и полностью разлагается водой. В результате получается гидроксид алюминия и углекислый газ.
Гидроксид алюминия является "осадителем". Первоначально он образует коллоидный раствор, затем он постепенно коагулирует (свертывается), образуя хлопья, которые и захватывают взвешенные в воде частицы органических и неорганических веществ.
Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
6) Образующийся при взаимодействии сульфата алюминия с водой осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань, и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится.
7) Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
8) Неоценима биологическая роль гидролиза некоторых солей, входящих в состав нашего организма.
Например, в составе крови содержатся соли гидрокарбонат и гидрофосфат натрия. Их роль заключается в поддержании определенной реакции среды. Это происходит за счет смещения равновесия процессов гидролиза:
HCO3- + H2O ↔ H2CO3 + OH-
HPO42- + H2O ↔ H2PO4- + OH-
Если в крови избыток ионов Н+, они связываются с гидроксид-ионами ОН- и равновесие смещается вправо. При избытке гидроксид-ионов ОН- равновесие смещается влево. Благодаря этому кислотность крови здорового человека колеблется незначительно.
9) Еще один пример. В составе слюны человека есть ионы HPO42-. Благодаря им в полости рта поддерживается определенная среда (рН = 7 - 7,5).
4.Закрепление знаний
Сегодня на уроке мы познакомились с еще одним типом химических реакции, которые играют огромную роль в окружающей нас жизни.
Мы рассмотрели три случая гидролиза: по катиону, по аниону, по катиону и аниону.
Задание 1. Даны формулы веществ: KCl, NH4NO3, Na2SO4, K2SO3, FeCl3K2S, (NH4)2S, Cu(CH3COO)2. Не расписывая уравнения гидролиза, определить, по какому иону идет гидролиз. В каких случаях гидролиз не идет.
Задание 2. Тест (из заданий ЕГЭ)
Часть А.
1. Раствор какого вещества имеет рН
1) СuSO4
2) NaOH
3) Na2CO3
4) KCl
2. Нейтральная среда получается при растворении в воде
1) сульфата алюминия
2) нитрата цинка
3) сульфата натрия
4) силиката калия
3. Гидролиз идет до конца при растворении в воде соли
1) Al2S3
2) Al2(SO4)3
3) Na2S
4) Na2SO4
4. Фенолфталеин изменяет окраску в водном растворе
1) Fe(NO3)3
2) Cr2(SO4)3
3) K2S
4) Na2SO4
Часть В.
1. Установите соответствие между формулой вещества и кислотностью среды его раствора
| Кислотность среды | |
| 1) NaI 2) Li2S 3) Ba(NO2)2 4) Ni(NO3)2 | А) рН = 7 Б) рН > 7 В) рН |
2. Установите соответствие между формулой соли и цветом лакмуса в ее растворе
| Цвет лакмуса | |
| 1) NaCl 2) Li2SiO3 3) Cr(NO3)3 4) (NH4)2SO4 | А) фиолетовый Б) синий В) красный |
3. Установите соответствие между формулой вещества и цветом лакмуса в её растворе.
| Кислотность среды | |
| 1) K2SiO3 2) ZnCl2 3) Mg(NO3)2 4) Li2SO4 | А) фиолетовый Б) синий В) красный |
5.Подведение итогов урока. Рефлексия
Выберите себе понравившееся начало предложения и допишите его:
Сегодня узнал (а), что могу… Я считаю полезным… Мне понравилось…
Мне было трудно… Теперь бы я хотел (а) ещё узнать…
6.Информация о домашнем задании
Задание для 1 группы
Из перечисленных ниже солей выбрать соли образованные сильной кислотой и слабым основанием: сульфат алюминия, хлорид натрия, сульфат калия. ацетат натрия, нитрат меди (II), силикат натрия, ацетат аммония. хлорид алюминия. Написать уравнения гидролиза одного из них.
Задание для 2 группы
Из перечисленных ниже солей выбрать соли образованные слабой кислотой и сильным основанием: сульфат алюминия, хлорид натрия, сульфат калия, ацетат натрия, нитрат меди (II), силикат натрия, ацетат аммония, хлорид алюминия. Написать уравнения гидролиза одного из них.
Задание для 3 группы
Из перечисленных ниже солей выбрать соли образованные сильной кислотой и сильным основанием: сульфат алюминия, хлорид натрия, сульфат калия, ацетат натрия, нитрат меди (II), силикат натрия, ацетат аммония, хлорид алюминия. Написать уравнения гидролиза одного из них.
Дополнительное задание (по выбору обучающихся)
При сливании раствора, содержащего 5 моль хлорида меди (II), с избытком раствора карбоната натрия выделяется газ и выпадает осадок. Определить массу выпавшего осадка.
Список использованной литературы
1.Настольная книга учителя. Химия. 11 класс / О.С. Габриелян – М.: Дрофа, 2006.
2.Химия в формулах. 8-11 кл.: Справочные материалы / В.Г. Иванов, О.Н. Гева. – М.: Дрофа, 2005.
3.Химия. 11 кл. Базовый уровень: учебник для общеобразовательных учреждений / О.С. Габриелян. - М.: Дрофа, 2010.
4.Химия. Учебник для 10 класса общеобразовательных учреждений. Новошинский И.И., Новошинская Н.С. - М.: Русское слово, 2010.
Здесь представлен конспект к уроку на тему «Гидролиз солей», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (11 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

