Конспект урока «Гидролиз солей» по химии для 9 класса
Муниципальное бюджетное общеобразовательное учреждение
«Средняя общеобразовательная школа №18 имени братьев Могилевцевых»
г. Брянска
Гидролиз солей
урок химии в 9 классе
Разработала
учитель химии высшей категории
Орлова Елена Юрьевна
Брянск
2013
Цели урока:
Образовательная – научить составлять реакции гидролиза и определять среду раствора, установить связь с прошлым опытом при составлении реакций, отработать практически навыки при работе с реактивами, выявить основные трудности при составлении реакций ионного обмена и гидролиза.
Развивающая – развитие способностей анализа и сравнения, рефлексии, коммуникативных способностей.
Воспитательная – воспитывать умение слышать других, отвечать за всех, взаимодействовать во время коллективной работы.
Оборудование: демонстрационная доска с растворами солей (NaCl, Na2CO3, CuCl2, CH3COONH4), пробирки, индикатор (лакмусовая бумага), распечатка по правилам техники безопасности, инструкция, алгоритм составления реакций гидролиза, затребованная помощь, раствор мыла.
Тип урока: объяснение нового материала.
Вид доски:
Таблица над доской
Li K Ca Na Mg Al Mu Zu Cr Fe Ni Su Pb H Cu Hg Ag Pt Au
Электрохимический ряд напряжения металлов
Таблица ряда активных кислот
Таблица
| Затребованная помощь | Таблица рН растворов | ||
| I II группа Na2CO3 + HOH= III группа CuCl2 + HOH= IV группа CH3COONH4+HOH= | Конверт №1 Реакции гидролиза в молекулярной форме | Конверт №2 Реакции гидролиза в ионной форме | рН желудочного сока=1,7 рН дождевой воды=6 рН водопроводной воды=7.5 рН крови=7.4 рН слез=7 рН кожи=6 |
Ход урока:
-
Организационный момент.
-
Актуализация знаний, необходимых для изучения темы.
-
Самостоятельная работа.
-
Анализ самостоятельной работы.
-
-
Объяснение нового материала.
-
Введение в тему, учебный диалог (мотивация) Работа с реактивами в группах.
-
Знакомство с алгоритмом составление реакций гидролиза
-
Исследовательская работа в группах по определению среды раствора с использованием алгоритма:
-
а) Инструктаж по выполнению задания.
б) Повторение правил техники безопасности.
4. Обсуждение результатов работы, рефлексия.
-
Закрепление изученной темы.
1.Определение в группах среды растворов, использующихся в быту моющих средств.
2.Самостоятельная работа (проверочная) с правом выбора задания.
3.Обсуждение результатов.
-
Домашнее задание с краткими комментариями по выполнению.
-
Итог урока.
План
I.Организационный момент
На предыдущих уроках Вы познакомились с разного типа реакциями. Прежде, чем начнем изучать новую тему, необходимо проверить, как Вы усвоили предыдущий материал - реакции диссоциации, т.к. эти знания понадобятся нам на сегодняшнем уроке.
II. Актуализация знаний
1.Самостоятельная работа на 2 варианта.
Написать диссоциацию следующих веществ:
I вариант II вариант
H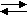
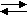 Cl HBr
Cl HBr
N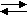
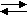 aOH KOH
aOH KOH
2.Объявление критерия выставления оценки. Самооценка.
Учитель: Кто выполнил задание без ошибок?
Какие могли быть допущены ошибки и как их исправить?
III. Объяснение нового материала.
1.Учитель: Сегодня мы познакомимся еще с одним типом реакций, который протекает в водной среде.
Тема урока – гидролиз солей.
Слово «гидролиз» греческого происхождения и состоит из двух корней. Попробуйте дать ему перевод на русский язык, вспомнив, что означает каждый корень.
Ученик: «Гидро» - вода, «лизис» - разложение
Учитель: Так что же называется гидролизом?
Ученик: Растворение в воде вещества.
Учитель: Какого вещества? Смотрите тему урока.
Ученик: Соли.
Учитель: Итак, гидролиз солей – это взаимодействие ионов соли с водой, которое приводит к образованию слабого электролита. Встречаемся ли мы в быту с реакциями гидролиза?
Ученик: Да.
Учащиеся приводят примеры растворения соли в воде.
Учитель: С реакциями гидролиза мы действительно встречаемся в быту постоянно. Кроме того, на нас обрушивается поток рекламной информации. Конечно, хотелось бы ей верить. Но, доверяй, да проверяй. И на этом уроке мы научимся определять среду раствора с помощью специального показателя, который называется водородным показателем и обозначается рН; определим, действительно ли мыло не сушит кожу, и что значит продукция рН – нейтральна. Знания, которые вы получите сегодня, пригодятся Вам в жизни.
2.Учитель: На уроке Вы будете работать с реактивами по инструкции, которая лежит на столе у каждого и записывать реакции, пользуясь алгоритмом, который тоже есть у каждого. Предварительно, давайте, отработаем шаги алгоритма составления реакций гидролиза (см. приложение к уроку №3). И затем, пользуясь алгоритмом, составим уравнения реакций гидролиза, работая в группах.
Учащиеся называют шаги алгоритма, проговаривая вслух напечатанный текст и объясняя, как, пользуясь электрохимическим рядом напряжения металлов и рядом силы кислот, определить силу основания и кислоты.
Учитель: Среду раствора можно определить с помощью водородного показателя, пределы которого находятся от 0 до 14 (см. вид доски). Соответственно, различают кислую, нейтральную и щелочную среду. Ее же можно определить и с помощью индикатора (см. приложение к уроку №2).
В таблице на доске даны примеры значения рН, давайте определим среду данных растворов.
Учащиеся проговаривают вслух значение рН приведенных растворов и определяют их среду.
3 Групповая работа:
а) Учитель: Весь класс разделен на 4 группы, каждая из которых работает с различными реактивами по инструкции (см. приложение №2)
Каждой группе предложены разные виды солей и вода
I группа - NaCl
II группа – Na2CO3
III группа – CuCl2
IV группа – CH3COONH4
Учитель: После того, как Вы напишите работу по инструкции, сразу же начинайте составлять реакции, пользуясь алгоритмом (см. приложение к уроку №3). Посовещавшись в группе, выберите 2-х представителей, один из которых записывает реакцию на доске с комментариями, второй - комментирует результаты проделанного опыта с места. Если при выполнении задания у Вас возникнут затруднения, Вы можете воспользоваться «Затребованной помощью» (см. вид доски), которая находится в конвертах на доске, при этом оценка не будет снижена. В конверте № 1 находится запись уравнений реакции в молекулярной форме, в конверте № 2 – в ионной форме.
Учитель: Прежде, чем Вы начнете работать с реактивами, что необходимо повторить?
Ученик: Правила по технике безопасности (см. приложение к уроку № 1)
б) Повторение правил по технике безопасности (фронтальный опрос).
Работа с реактивами и составление реакции.
4. Защита групповых работ, обсуждение. Само- и взаимооценка. Учащиеся записывают уравнения реакций в тетрадь.
IV Закрепление изученной темы.
1.Учитель: вы устроились на работу рекламным агентом моющих средств. Вам необходимо показать преимущество использования в быту некоторых моющих средств. Мною заранее были приготовлены растворы хозяйственного мыла, детского мыла, мыла «Dove» и пенки для мытья лица. Придумайте название для своей группы и проверьте с помощью лакмуса показатель среды каждого раствора и покажите преимущество использования в быту данного средства.
Ученик: группа №:1– (каждая группа придумывает название своей группы и озвучивает его)
Ученик: группа №:2–
Ученик: группа №:3 –
Ученик: группа №:4–
Учащиеся проверяют среду растворов и объявляют результаты.
2. Проверочная самостоятельная работа по выбору:
Учитель: У каждого на парте лежат цветные клеящиеся листочки:
Желтый лист – K2S
Красный лист – HgBr2
Зеленый лист – Al2S3
Выберите один из листочков и запишите реакции гидролиза. По мере выполнения задания, наклеить листочки на доску.
3.Проверка выполнения данного задания, коррекция знаний.
V. Д/з.
§6. Воспроизвести по памяти и записать алгоритм записи реакций гидролиза.
VI. Итог урока
Фронтальный опрос
-
Дать определение реакции гидролиза.
-
Прокомментировать алгоритм составления реакций гидролиза.
-
Что такое водородный показатель?
-
Как полученные знания могут пригодиться Вам в жизни?
Приложение к уроку №1
Правила техники безопасности
при работе в химической лаборатории
-
Работать по инструкции.
-
Проводите опыты с теми веществами, которые указаны учебником и в нужном по инструкции количестве.
-
Не пробуйте вещества на вкус.
-
При выяснении запаха веществ не подносите сосуд близко к лицу.
-
Твердые вещества берите из банок сухой ложкой или пробиркой.
-
Нагревая пробирку с жидкостью, берите ее так, чтобы открытый ее конец был направлен в сторону от себя и соседа.
-
Работать только над столом.
-
Производите опыты в чистой посуде. Банки и склянки закрывайте теми же крышками, какими они были закрыты.
-
Закончив работу, приведите рабочее место в порядок.
-
В случае ожога, пореза и попадания едкого вещества на кожу или одежду немедленно обращайтесь к учителю.
Приложение к уроку №2
Инструкция для выполнения групповой работы
-
Раствори немного соли в 1мл. воды.
-
С помощью индикатора определи среду раствора, для этого к исследуемому раствору добавь несколько капель индикатора. Обрати внимание на изменение цвета индикатора.
-
Постарайся не пользоваться таблицей- подсказкой:
| Цвет индикатора в среде | |||
| | кислой | щелочной | нейтральной |
| Лакмус | Красный | Синий | Фиолетовый |
| Фенолфталеин | Бесцветный | Малиновый | Бесцветный |
| Метиловый оранжевый | Красно- розовый | Желтый | Оранжевый |
-
Сделай вывод.
-
Напиши, пользуясь алгоритмом, реакцию гидролиза.
-
Перескажите алгоритм друг другу.
-
Оцени свою работу и работу группы.
Приложение к уроку №3
Алгоритм составления реакций гидролиза
-
Определи по электрохимическому ряду напряжения металлов, силу основания (сильное/слабое)
-
Определи по схеме силы кислот, остаток какой кислоты образует соль (сильный/слабый)
-
Запиши первую строчку уравнения реакции в молекулярной форме:
а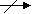 ) Соль, образованная сильным основанием и сильной кислотой гидролизу не подвергается; ( )
) Соль, образованная сильным основанием и сильной кислотой гидролизу не подвергается; ( )
б) Соль, образованная сильным основанием и слабой кислотой, дает в ходе гидролиза кислую соль и щелочь;
в) Соль, образованная слабым основанием и сильной кислотой, дает в ходе гидролиза основную соль и кислоту;
г) Соль, образованная слабым основанием и слабой кислотой, дает в ходе гидролиза основание и кислоту;
-
Запишите вторую строчку уравнения в ионной форме, пользуясь таблицей растворимости
-
Сократи в левой и правой частях уравнения одинаковые ионы и запиши третью строчку уравнения
-
Определи рН раствора, пользуясь шкалой, приведенной на доске.
Список использованной литературы:
1. Общая химия, учебник для ВУЗов; Н. Л. Глинка, 1985 ,- 731 с.
2. Общая и неорганическая химия. Угай Я.А.,М.: Высшая школа, 1997. - 527 с
3. Никольский А.Б., Суворов А.В. Химия, учебник для вузов; — СПб: Химиздат, 2001. — 512 c.
4. Химия. 11 класс. Габриелян О.С.,М.: Дрофа, 2002. - 368с.
5. Химия. 9 класс. Ф.Г.Фельдман, Г.Е.Рудзитис, М.:Просвещение, 1994.- 158с
Здесь представлен конспект к уроку на тему «Гидролиз солей», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.




 J HBr HCl H2SO4 HNO3 H2SO3 H3PO4 HF CH3COOH H2CO3 H2S H2SiO3
J HBr HCl H2SO4 HNO3 H2SO3 H3PO4 HF CH3COOH H2CO3 H2S H2SiO3