Конспект урока «Химические пигменты» по химии
Проектная деятельность в работе с одаренными детьми.
Изучение химии не всегда продвигается так, как мы этого хотим, возникает момент, когда требуется дополнительный импульс, стимул для изучения химии. Современные условия развития общества требуют переориентации обучения с усвоения готовых знаний, умений и навыков – на развитие личности ребенка способного стать успешным. И всегда встает вопрос: а как это сделать? На мой взгляд, именно с помощью личностно ориентированных технологий можно наилучшим образом решить эту задачу.
К таким технологиям относится метод учебного проекта, который в настоящее время является мощным средством для развития учащихся: и образовательного, и духовного, и нравственного. При выполнении проектов по химии ученики вырабатывают умение не только думать, находить информацию, анализировать, экспериментировать, принимать решение, работать индивидуально и в группах, но и развиваться творчески, потому что уроки химии способствуют раскрытию и реализации мыслительных и творческих способностей. Кроме того, проектная деятельность способствует укреплению и углублению знаний.
Метод учебных проектов включает в себя следующие этапы:
-
Подготовка к проекту и погружение в проект (определение темы и целей проекта).
-
Организация деятельности (планирование деятельности в группах).
-
Осуществление деятельности (сбор информации, её анализ и обобщение, оформление результатов, формулировка выводов, определение формы презентации).
-
Презентация проекта (отчёт, оценивание, подведение итогов).
На старшем этапе обучения проектная деятельность учащихся приобретает характер научно-исследовательской работы с определением цели и задач, выдвижением гипотезы исследования.
Особое внимание уделяю оценке проекта и его презентации. В качестве средств оценки могут быть использованы анкеты, оценочные шкалы для обсуждения качества работы, дневник рефлексивной самооценки.
Критерии оценки определяются творческим характером проектной работы и включают такие параметры как:
-
оценка собственного проекта;
-
оценка качества текста;
-
оценка качества презентации;
-
оценка вклада в работу над проектом каждого ученика;
-
оценка умения взаимодействовать в группе.
Результаты выполненных проектов должны быть материальны, т. е. оформлены каким-либо образом (видеофильм, доклад, альбом).
Метод проекта всегда ориентирован на самостоятельную деятельность учащихся (индивидуальную, парную, групповую), которые они выполняют в отведенное для этой работы время (от нескольких минут урока до нескольких недель, а иногда и месяцев). Чаще всего тематика проектов определяется практической значимостью вопроса, его актуальностью, а также возможностью его решения при привлечении знаний учащихся из разных областей, изучаемых в школе наук.
Роль учащихся и учителя в проектной деятельности
| Деятельность учащихся | Деятельность учителя | |
| Организационно-подготовительный | Определение темы проекта, его цели и задач, поиск необходимой информации, разработка плана реализации идеи, формирование группы | Формирование мотивации участников, создание инициативной группы учащихся, консультирование по выбору тематики проекта, помощь в подборке необходимых материалов, определение критериев оценки деятельности учащихся на всех этапах. |
| Поисковый | Сбор, анализ и систематизация необхо- димой информации, обсуждение ее в группе, выдвижение и проверка гипотез, оформление проекта, самоконтроль | Регулярное консультирование по содержанию проекта, помощь в систематизации и обобщении материалов, индивидуальная и групповая консультация по правилам оформления проекта, стимулирование умственной активности учащихся, отслеживание деятельности каждого участника, оценка промежуточных результатов, мониторинг совместной деятельности |
| Итоговый | Подготовка устной и электронной презентации, защита содержания проекта, рефлексия | Помощь в разработке отчета о работе, подготовка выступающих к устной защите, отработка умения отвечать на вопросы слушателей, участие в анализе проделанной работы, оценка вклада каждого из участников проекта |
Результаты своей работы юные химики представили в виде презентации на научно-практической конференции. Было очевидно, что, работая над проектом, учащиеся самостоятельно учатся добывать необходимую информацию, пользоваться справочной литературой, привлекая новые технологии, в том числе и сети INTERNET. Учитель становится их равноправным партером и консультантом. Участники проекта научились работать вместе, самостоятельно обсуждая полученные результаты, ознакомились с важнейшими приемами техники химического эксперимента: взвешиванием, растворением, осаждением, промыванием осадков и с другими операциями.
Я глубоко убеждена, что занятие учащихся проектной деятельностью обеспечивает самый высокий уровень личностно ориентированного обучения, влечет за собой овладение новыми видами знаний и умений, способами деятельности, создает условия для формирования образовательной траектории, служит развитию креативности.
Проект: Химические пигменты.
Предметом исследования был вопрос о том, как давно и какие пигменты используются в качестве красителей, как самим в лабораторных условиях получить неорганические пигменты, какие реактивы для этого нужны, при каких условиях следует проводить реакции.
В ходе работы выяснили, что: краски, красители, пигменты – это вещества, придающие определённый цвет, окраску. Существуют краски, красители, пигменты природные (получают из природного сырья) и искусственные (полученные путём химических реакций).
Использование природных красителей началось за 3000 лет до н.э. В Индии из растения рода Indigofera добывали краситель, который получил название индиго.
К одним из древнейших красителей относится также пурпур, который ещё в Х в. До н.э. финикийцы получали из улиток – багрянок.
Толчком к развитию химии красителей послужило открытие Н.Н.Зининым в 1842 г. реакции восстановления ароматических нитросоединений:
С6Н5NO2 + 6Н → С6Н5NН2 + 2Н2О .
Таким путём учёный получил анилин и некоторые другие аминопроизврдные ароматических соединений, что в дальнейшем послужило основой создания новой отрасли химической промышленности- анилиново -красочной.
В наши дни насчитывается более 15000 красителей самых различных оттенков, принадлежащих к разным классам соединений. Различают пигменты органические и неорганические, природные и синтетические, хроматические и ахроматические.
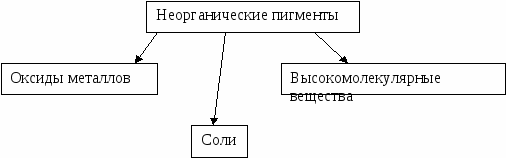
Применение красителей:
Соли многих металлов, так же как и оксиды, являются пигментами художественных красок. Красители используют для окраски тканей, пластмассы, приготовления красок, в парфюмерной промышленности.
Искусственные красители можно заменить природными, полученными из растений. Однако растительные краски не хранятся так долго, как анилиновые, поэтому их не применяют в промышленности.
Красители используют не только для окраски тканей, но и для приготовления напитков, кремов, карамели.
Белые пигменты.
Самый древний метод окраски в белый цвет – это побелка. Побелка стен жилищ трипольской культуры уже была устоявшейся традицией. Для побелки использовалась водная взвесь или суспензия гашёной извести или непосредственно мел. Меловую побелку делали преимущественно внутри помещения, т.к. она легко смывается водой.
Мел удобен для письма и используется в этих целях с давних пор.
Карбонат кальция к пигментам не относится. Его можно использовать в составе краски как белый наполнитель с каким-нибудь эффективным пигментом, например: титановыми белилами или цинковыми белилами.
Технология получения титановых белил довольно сложна, а вот цинковые белила вполне можно получить в лабораторных условиях.
Можно получить карбонат цинка из карбоната натрия и сульфата цинка, полученный осадок просушить, потом, прокалив, получить оксид цинка – цинковые белила.
Можно к раствору сульфата цинка прилить раствор щёлочи, полученный осадок просушить и прокалить в печи при температуре 150 – 2000С в течение 1 - 2 часов.
Зелёные пигменты.
Оксид хрома (III) получают из дихромата аммония в результате его разложения.
Ярь-медянка, или ярь. Этот пигмент начали получать очень давно. Существует старинный способ получения, когда медную пластинку подвешивают над уксусом. Можно получить этот пигмент, используя растворы сульфата меди, карбоната натрия и уксусной кислоты.
Голубые пигменты.
Голубые пигменты интересны тем, что позволяют существенно расширить зелёную цветовую гамму за счёт совместного использования голубого и жёлтого пигментов в разных пропорциях. Однако голубые пигменты представляют интерес и сами по себе.
Берлинская лазурь – в промышленности этот пигмент чаще называют железной лазурью. А в химии исторически укоренились термины «берлинская лазурь» и «турнбулева синь». В лабораторных условиях её можно получить из раствора хлорного железа (FeCl3), соляной кислоты и раствора жёлтой кровяной соли.
Кроме берлинской лазури есть и другие пигменты. Это: аммиакат меди (васильково синий цвет), кобальт синий, кобальт фиолетовый светлый, кобальт фиолетовый тёмный.
Жёлтые пигменты.
Свинцовый крон – пигмент интенсивного жёлтого цвета, поэтому он называется также жёлтым кроном. Получают его взаимодействием солей свинца и хромовокислого калия (или натрия).
Оксид свинца – свинцовый глёт – также имеет жёлтую окраску и раньше его использовали в качестве пигмента, но по интенсивности окраски он уступает свинцовому крону.
Жёлтый ультрамарин состоит главным образом из хромовокислого бария. Получить её можно взаимодействием раствора хлористого бария с хромовокислым калием. Железная жёлтая состоит из хромовокислого железа.
Кадмиевую жёлтую получают взаимодействием нитрата кадмия с сульфидом натрия.
Практическая работа:
Получение пигмента голубого цвета «Берлинская лазурь».
Оборудование:
10мл раствора хлорного железа (FeCl3), соляная кислота, 7,5мл 1молярного раствора жёлтой кровяной соли, вода, плитка электрическая, водный термометр, стеклянная палочка, фольтровальная бумага, воронка, стаканы (4шт.).
Ход работы:
В стакане нагреть до 600-700 10мл раствора хлорного железа, слегка подкисленного соляной кислотой, чтобы не выпадал осадок при нагревании этого раствора.
В другом стакане нагревают до такой же температуры 7,5мл 1 молярного раствора жёлтой кровяной соли К4[Fe(CN)6].
В третьем стакане ёмкостью 100мл нагревают 5-10мл чистой воды.
Затем оба раствора нужно прилить тонкими струйками при сильном помешивании в стакан с горячей водой, после того , как растворы слиты, жидкость с твёрдым осадком нужно помешать минут 10, а затем оставить до следующего дня.
Когда краска осядет, раствор сливают с осадка, промывают 2-3 раза чистой водой, фильтруют и высушивают.
Практическая работа:
Получение цинковых белил (I вариант).
Оборудование: растворы соды(Na2CO3) и сульфата цинка, соляная кислота, мерные стаканы, фарфоровая чашка, плитка, воронка, фильтровальная бумага, сосуд с водой.
Ход работы:
Влить 50мл раствора соды Na2CO3 в стакан и нагреть до кипения. Затем при сильном помешивании влить в раствор соды тонкой струёй раствор сульфата цинка (50мл). В результате реакции образуется рыхлый, объёмистый осадок ZnCO3. Дать осадку отстояться и уплотниться. Затем путём сливания удалить раствор Na2SO4, находящийся над осадком и промыть его несколько раз чистой водой, дать отстояться и снова слить жидкость с осадка. После промывания отделить ZnCO3 фильтрованием, просушить на фильтре, а затем сухой порошок поместить в фарфоровую чашку и прокалить на огне. Чтобы определить конец реакции разложения ZnCO3, взять небольшую пробу этого вещества, перенести в пробирку и прилить к ней несколько капель кислоты.
Работу оформить в таблицу:
| Что делали | Что наблюдали | Уравнение реакции | |
| 1.Получение карбоната цинка | | | |
| 2.Разложение карбоната цинка нагреванием. | | | |
Практическая работа:
Получение цинковых белил (II вариант).
Оборудование: раствор соли цинка, раствор щёлочи, спиртовка, спички, пробирки, воронка, фильтровальная бумага.
Ход работы:
К 5мл раствора сульфата цинка прилить 5мл раствора щёлочи. После выпадения студенистого осадка гидроксида цинка для удобства выделения продукта реакционную массу прокипятить 2-3мин. Осадок отфильтровать и просушить 1-2ч при температуре 150-2000С для полного удаления влаги.
Zn(OH)2 = ZnO + H2O
Работу оформить в таблицу:
| Что делали | Что наблюдали | Уравнение реакции | |
| 1.Получение гидроксида цинка | | | |
| 2.Разложение гидроксида цинка нагреванием. | | | |
Практическая работа: Получение зелёных пигментов.
Опыт №1 Получение ярь-медянки.
Оборудование: 1молярные растворы сульфата меди и карбоната натрия, уксусная кислота, вода, фильтр, воронка, спиртовка, фарфоровая чашка, стаканы, стеклянная палочка.
Ход работы:
К 50мл 1 молярного раствора сульфата меди прилить 5мл 1 молярного раствора карбоната натрия.
Выпавший осадок промыть несколько раз водой, затем растворить его в уксусной кислоте, избегая избытка последней. Если останутся какие-либо нерастворимые примеси, то жидкость профильтровать.
Полученный раствор упарить , не доводя жидкость до кипения, затем охладить и дать постоять для уплотнения осадка. После этого отделить кристаллическую ярь (медянку) от маточного раствора.
Кристаллы высушить.
Опыт №2 Получение ярь-медянки (по старинной технологии).
Оборудование: стеклянная банка (0,5л), полиэтиленовая крышка, нитки, медная пластинка, наждачная бумага, уксусная кислота (9%-ный раствор).
Ход работы:
Налить в 0,5литровую банку 75-100мл столового уксуса (9%-ного раствора уксусной кислоты), зачистить наждачной бумагой медную пластину и подвесить её по возможности ниже над слоем жидкости, плотно закрыв затем банку полиэтиленовой крышкой. Для удобства закрепления нити-подвески можно проколоть в крышке отверстие иглой. Если банку поставить в тепло, то через несколько дней будет отчётливо видно, что поверхность металла позеленела, а через 3-4 недели на ней образуются красивые иссиня-зелёные кристаллы медянки. Её нужно соскоблить.
Опыт №3 Получение зелёного крона (оксида хрома (III).
Оборудование: Дихромат калия, спиртовка, спички, асбестовая сетка, штатив.
Ход работы:
Насыпать на асбестовую сетку (или в фарфоровую чашку) немного дихромата калия, нагреть на спиртовке до начала реакции, потом нагревание прекратить.
Образовавшийся оксид хрома собрать, высыпать в склянку для хранения.
Практическая работа.
Получение жёлтого пигмента «Жёлтый крон».
Оборудование:
Стакан ёмкостью 200мл., стаканы, 50мл. 0,5 молярного раствора уксуснокислого свинца, 50мл. воды, 50мл. 0,5 молярного раствора хромовокислого калия, воронки, фильтровальная бумага, стеклянная палочка.
Ход работы:
В стакан ёмкостью 200мл. влить 50мл. 0,5 молярного раствора уксуснокислого свинца и добавить столько же холодной воды.
Затем сюда же прилить тонкой струёй при энергичном помешивании 50мл. 0,5 молярного раствора хромовокислого калия.
Осадку дать отстояться и тщательно промыть чистой водой.








Здесь представлен конспект к уроку на тему «Химические пигменты», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

