Конспект урока «Химические свойства неметаллов и их соединений. Кислотные дожди» по химии для 9 класса
Разработка урока «Химические свойства неметаллов и их
соединений. Кислотные дожди» 9 класс
учителя химии МБОУ ССОШ №13 Зимовниковского района
Ростовской области х.Гашун
Паляничкиной Ольги Григорьевны
Тема: Химические свойства неметаллов и их соединений.
Кислотные дожди
Цель: создать условия для формирования у учащихся представления о химических элементах – неметаллах и их химических свойствах, для знакомства учащихся с процессами горения, и гидратации полученных веществ, развития ценностного отношение к природе, и осознанности необходимости развития экологического подхода к принципам производства, продолжения работы по развитию умения записывать уравнения реакций, закрепления на практике полученные знания.
Оборудование и реактивы: компьютер, проектор, пробирки, спиртовки, штативы, газоотводные трубки, индикаторные бумажки, р-р серной кислоты, хлорид натрия, вода, карточки с заданиями, табель для оценок.
Ход урока.
1. Организационный момент.
Слайд 1-3.
- В конце 19в на один из металлургических заводов юга России приехал посетитель. Он долго ходил по цехам. Особенно его интересовали коксовые печи. Он подробно расспрашивал об их емкости, режиме работы, о количестве угля, перерабатываемого на кокс, о руде используемой при выплавке металла. В конце осмотра гость предложил хозяину продать ему дым от этих печей на 20 лет вперед.
- Мы не торгуем воздухом и дымом.
Но странный покупатель все таки настоял на своем.
- А для чего ему нужен был дым от печей? Попробуем ответить на этот вопрос в конце урока.
2. Актуализация знаний.
Слайд 4 -5.
- Поразмышляем, в печах происходит горение веществ, для горения необходим кислород, в результате взаимодействия кислорода и других химических элементов образуются оксиды.
Задание № 1.
Запишите уравнения реакций взаимодействия кислорода и серы, кислорода и фосфора, кислорода и углерода. Расставьте степени окисления в полученных веществах. Дайте этим веществам названия и определите, к какому классу веществ они относятся.
Слайд 6-7.
Задание №2.
Определите, какие свойства характерны данным оксидам:
CaO, Cl2O7, CO2, CuO, H2O, Na2O, N2O5, SO3, Аl2O3, K2O,
N2O3, Fe2O3, SiO2, P2O5, CO, Cu2O, MgO, SO2, Li2O, ВаО.
Запишите их, распределяя по группам.
3. Основная часть урока.
Слайд 8-9.
Задание №3.
Составьте уравнения реакции взаимодействия данных оксидов с водой, дайте названия полученным веществам : CO2, NO2, SO2.
Информационная часть урока.
Слайд 10.
«Кислотные дожди» образуются в результате взаимодействия паров воды с оксидом серы (IV) или с оксидом азота (IV), которые являются продуктами жизнедеятельности человека (например неполное сгорание топлива, выхлопные газы двигателей, газообразные отходы химического производства):
SO2+ H2O = H2SO3;
2NO2 + H2O = HNO3 + HNO2.
Слайд 11.
Термин «кислотные дожди» придумал в 1872 г. английский инженер
Роберт Смит. Они наносят большой ущерб природе. Земля, водоёмы,
растительность, животные и постройки становятся их жертвами. На территории России в среднем за год вместе с осадками выпадает более 4 млн. т. серы и 1,25 млн. т азота.
Слайд 12-13.
Повреждаются покровные ткани растений, изменяется обмен веществ в клетках, растения замедляют рост и развитие, уменьшается их сопротивляемость к болезням и паразитам.
Слайд 14.
Оксиды серы и азота образуются при сгорании каменного угля, нефти, при работе автомобилей, они растворяются в атмосферной влаге.
Слайд 15.
Разложение органических отходов также является источником загрязнения атмосферы веществами с кислотными свойствами.
Слайд 16.
Извержения вулканов – естественный источник соединений, попадание которых в атмосферу вызывает образование кислотных дождей.
Слайд 17.
Мировой рекорд принадлежит шотландскому городку Питлокри, где 20 апреля 1974 г. выпал дождь , по уровню кислотности соответствующий столовому уксусу.
Слайд 18.
В капле воды могут находится самые различные кислоты: HCl, H2S, H2SO4, HNO2, … . Мы попробуем получить аналог кислотного дождя.
Слайд 19-22.
Практическое задание.
Соберите прибор для получения соляной кислоты.
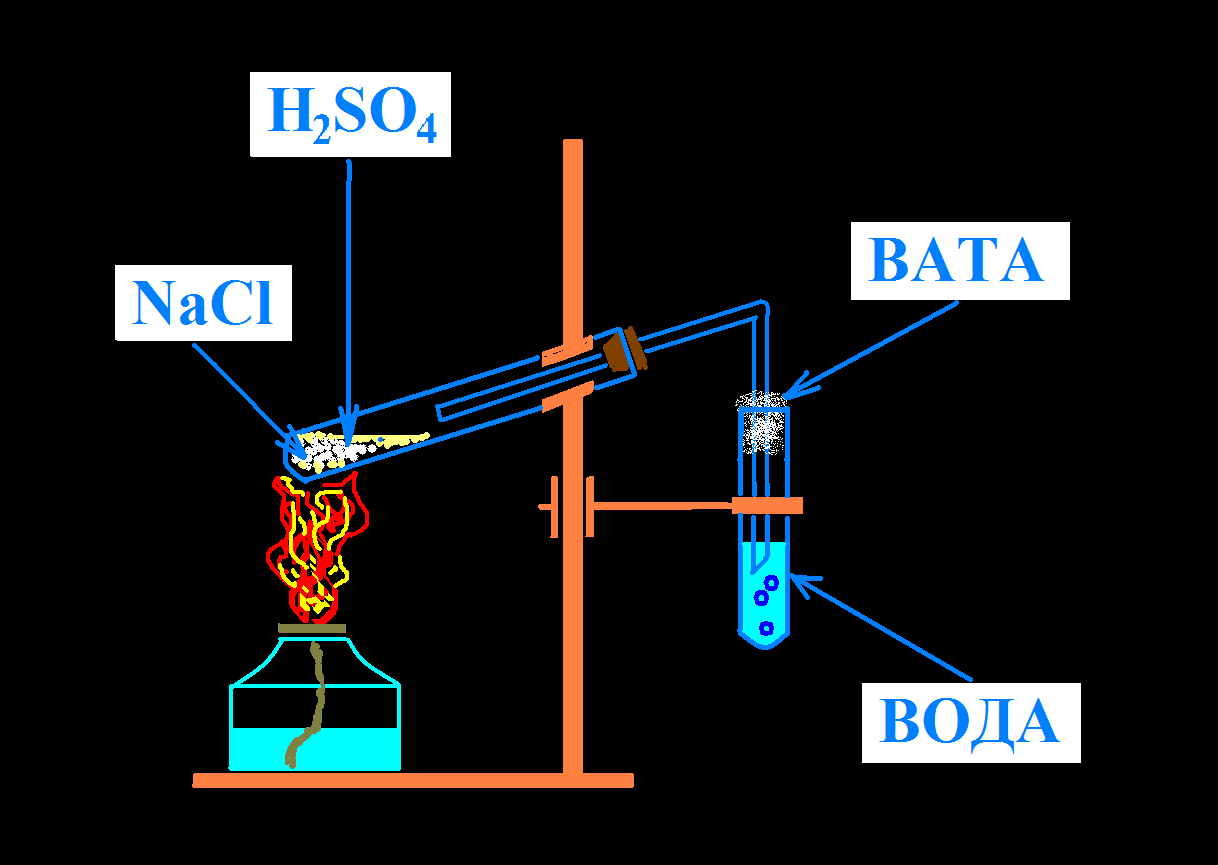
Закрепите пробирки, так как показано на рисунке, отрегулируйте их относительно пламени горелки.
Насыпьте в одну пробирку ¼ её объёма хлорида натрия, прилейте серную кислоту так, чтобы она только смочила вещество. Закройте пробкой с газоотводной трубкой. Нагревание проводите сначала по всей поверхности пробирки, а затем нагревайте нижнюю часть. Конец газоотводной трубки опустите во вторую пробирку с водой.
Слайд 23-24.
Задача.
В воздух (н.у.) попало облако оксида углерода(IV) объемом 35м3, при его прохождении сквозь водяной пар образовалось новое вещество, какая
масса воды потребовалась для реакции?
4. Подведение итогов урока.
Слайд 25-26.
- Сможете ли вы ответить на вопрос, поставленный в начале урока? Для чего потребовалось покупать дым печей?
- Что вы узнали из сегодняшнего урока?
- Какой вывод напрашивается после анализа полученной информации?
- Что человек может сделать для изменения ситуации на планете?
Подсчитать баллы и дать оценку работе в группах.
5. Домашнее задание.
Слайд 27.
Учебник: Химия. 9 класс: учеб.для общеобразоват.учреждений/
О.С.Габриелян. – 17-е изд., стериотип. – М.: Дрофа, 2010. – 270 с.
Литература
-
И.В.Маркина. Современный урок химии. «Академия развития», Ярославль. 2008г.
-
Е.П.Сгибнева, А.В.Скачков. Современные открытые уроки химии 8-9 классы. «Феникс», Ростов-на-Дону. 2002г.
-
Ю.Н.Казанцев. Химия. Материалы для индивидуальной работы 8-9 классы. «Айрис пресс», Москва. 2007г.
-
Л.М.Брейгер. Уроки-семинары в 9 классе по отдельным темам программы. «Учитель», Волгоград. 2001г.
Здесь представлен конспект к уроку на тему «Химические свойства неметаллов и их соединений. Кислотные дожди», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

