Конспект урока «Основные классы неорганических соединений» по химии для 8 класса
Муниципальное общеобразовательное учреждение
«Стрелецкая средняя общеобразовательная школа
Белгородского района Белгородской области имени Героя Советского Союза А.Е.Черникова »
Технологическая карта урока по химии в 8 классе по теме:
« Основные классы неорганических соединений»
Автор: Крекшина Нина Александровна
Учитель химии и биологии
2013 год
Технологическая карта урока « Основные классы неорганических соединений»
8 класс
Дидактическая цель: обобщить и систематизировать материал по теме «Основные классы неорганических соединений», создать условия для самостоятельной работы школьников по указанной теме
Тип урока: обобщение и систематизация знаний и способов деятельности
Задачи урока:
1. Создать условия для конкретизации понятий «оксиды, кислоты, основания, соли », создать условия для закрепления таких понятий как классификация веществ, названия, свойства и их применение. (предметный результат).
2. Способствовать развитию интеллектуальных умений учащихся (сравнение, синтез, анализ, вывод), максимально включая их в процесс самореализации, формирование адекватной самооценки; искать аналогии и работать в команде, пользоваться альтернативными источниками информации (метапредметный результат).
3. Формирование умений управлять своей учебной деятельностью, формирование культуры монологической речи (химического языка) и представление результатов исследовательской работы по выявлению среды раствора с помощью индикатора…… (личностный результат).
Методы обучения: проблемный, эвристический, практический
Формы организации познавательной деятельности обучающихся: коллективная, индивидуальная, групповая.
Средства обучения: презентация, учебник, рабочие тетради, видеосюжет «демонстрация опыта», задания на карточках, лабораторное оборудование: (пробирки, штатив, реактивы), карточки рефлексии, ЭОР (сайты http://www.fcior.edu.ru, http://school-collection.edu.ru)
| Деятельность учащихся | УУД | ЭОР | |
| Этап 1. Организационный | |||
| Приветствует ребят: «Я рад Вас сегодня видеть! Улыбнитесь. Пожелайте удачи друг другу. Поднимите руки вверх и почувствуйте свою уникальность, необычность, талантливость». «Посмотрите внимательно на доску, представьте, что это дверь в будущее, сегодня мы ее приоткроем». | Приветствуют учителя. Готовятся к уроку, фантазируют. | Личностные (смыслообразование) | |
| Этап 2. Проверка Д/з | |||
| Прежде чем мы познакомимся с темой урока, необходимо заполнить карточку с предложенным тестом. Учитель выборочно проверяет тетради (2-3 работы). | Учащиеся по вариантам работают с тестом . Тест 1. Тест 2. Учащиеся обмениваются тетрадями и ставят оценки. Код на слайде. | Личностные (самоопределение) Регулятивные (оценка, саморегуляция) Коммуникативные (определение способов взаимодействия) | Приложение №1. Интерактивная доска |
| Этап 3. Актуализация субъектного опыта | |||
| Учитель предлагает работу в паре: «Найдите ошибку в высказываниях ленивца Сита: а) «чтобы не было так скользко, зимой дороги посыпают солью хлоридом натрия, формула которой HCl»; б) «оксид кремния – SiO2 – хорошо растворим в воде”; в) «гидроксид кальция – Сu(OH)2 – используют для приготовления раствора для побелки подвалов» г) «в состав пищеварительного сока выделяющегося в желудке входит соляная кислота – H2SO4» Напишите шпаргалку для Сита. О каких веществах идет речь в тексте и к каким классам они относятся?» Мы сегодня за урок систематизируем и обобщим материал. | Ребята исправляет ошибки, оценивают свою деятельность в листах «самоконтроля» и пишут шпаргалку для Сита Ребята формулируют тему занятия ««Основные классы неорганических соединений веществ» | Личностные (смыслообразование) Познавательные (постановка и решение проблемы, логические универсальные действия) Коммуникативные (сотрудничество в поиске и сборе информации) Регулятивные (прогнозирование, оценка, саморегуляция) | |
| Этап 4. Обобщение и систематизация | |||
| 2.Составление «древа темы» Составьте классификацию неорганических веществ. 3.«Найди родственников" Распредели вещества по классам ( Класс разделён на четыре группы по названиям классов неорганических веществ: Оксиды, Кислоты, Основания и Соли). Из предложенного списка неорганических соединений выпишите вещества, относящиеся к классу, совпадающему с названием вашей группы. 4.«Третий лишний». Найти лишнюю формулу, вычеркнуть её и назвать класс веществ. 5.Учитель предлагает исследовательскую работу «Экспертиза. «Помогите, юному химику» решить экспериментальную задачу на определение соли, кислоты, основания. Техника безопасности. В этом химическом «щедерве», необходимо подобрать нужные слова. Лакмус был страстно влюблен в Кислоту и в её присутствии всегда….., а ревнивая Щелочь, которая была к нему неравнодушна, доводила его до …. Несчастный Фенолфталеин питал тайные, нежные чувства к Щелочи. Но зная её едкий характер, при малейшем к ней прикосновении становился….. 6.«Установите соответствие». Запишите формулы соответствующих гидроксидов. Отгадайте, что это за вещества? Вещества имеющие кислый вкус 7. В маршрутном листе у каждого учащегося есть экспресс-тест по кислотам. Учитель выборочно проверяет тетради (2-3 работы). Отгадайте, какое вещество находиться под этой шляпой? Учитель зачитывает текст. Просмотр презентаций разработанных учащимися дома о применении солей. 8.«Химические страсти» .Учитель предлагает повторить химические свойства кислот и кислотных оксидов в форме «Ромашка». Предлагает выбрать задания по своему уровню и решить их. На столе у каждого ученика три кружка: синий, желтый, красный, которые соответствуют уровням заданий (базовый, повышенный, высокий). Ученик выбирает свой уровень задания и поднимает. | . Ребята работают по предложенным схемам разного уровня. Проверяют по слайду презентации. Ставят себе оценку в лист «самоконтроля» Ребята работают по группам, заполняя таблицу Ребята работают по вариантам. На слайде презентации ответы и шкала оценивания. Практическая часть: Ребята (работа в группе) анализируют опыты и предлагают выводы. Ученики выполняют задание устно, продолжая фразу учителя. «Мозговой штурм» (работа в группе) Ученики работают индивидуально, выбирая себе задания по уровню Презентации озвучивают ученики Ученики выполняют задания в парах. Ученики самостоятельно пишут уравнения возможных химических реакций, индивидуально выбирая себе задание по своему уровню. | Личностные (смыслообразование) Познавательные (общеучебные универсальные действии, логические универсальные действия) Регулятивные (прогнозирование, оценка, саморегуляция, коррекция)) | Построение «дерева темы» слайд презентации Приложение №2. Приложение №3. Приложение №4. Приложение №5. Слайд презентации Видиосюжет Приложение №6. Приложение №7. Презентация «Соли». «Ромашка» Приложение 8. Слайд презентации |
| Этап 5. Информация о домашнем задании | |||
| Габриелян О.С. Учебник Химия 8 класс §38-42 Мини-сказка «Об оксидах, кислотах…», создать презентации о применении оксидов, оснований. | Ученики выбирают задания и пишут себе рекомендации «как мне успешно выполнить Д/з). | Личностные (самоопределение) Регулятивные (оценка, саморегуляция) | |
| Этап 6. Подведение итогов учебного занятия | |||
| Учитель дает оценку работе класса, отмечает наиболее проблемные вопросы изученной темы, нацеливает на подготовку сетевых заданий. | Ученики сравнивают свою личную успешность и активность по сравнению с предыдущим уроком. По желанию озвучивают «мое личное достижение за этот урок». Заполнение «Оценочного листа» По цепочке ученик продолжают материал «серия выводов на уроке». | Регулятивные (оценка, саморегуляция) Познавательные (общеучебные универсальные действия, логические универсальные действия) | |
| Этап 7. Рефлексия | |||
| Учитель инициирует рефлексию учащихся по поводу своего психо-эмоционального состояния, мотивации своей деятельности и взаимодействия с учителем и одноклассниками. Учитель благодарит школьников за урок. | Ученик выбирает две пословицы, которые соответсвовали ему на уроке. | Регулятивные (оценка, саморегуляция) | Источники сети Интернет по теме «Классы неорганических соединений» |
Литература.
1. Габриелян О.С. Химия. Учебник для 8-го класса. - М.: Дрофа, 2005.
2)Тимакова Л.Г. Тетрадь с печатной основой по неорганической химии.8-й класс. - Харьков учебно-методический центр «Школьник»,1998.
3.)Кнунянц И.Л. Большой энциклопедический словарь. Химия. М.Научное издательство «Большая Российская энциклопедия».1998.
4.)Кузьменко Н.Е., Ерёмин В.В.Химия для школьников старших классов и поступающих в вузы. - Из. «Дрофа».1995.
Используются материалы интернета и учителей курсов
сайты http://www.fcior.edu.ru, http://school-collection.edu.ru
Маршрутный лист
Раздаточные материалы для урока
Приложение №1
Тест 1. Вопросы для 1 варианта
-
В каком соединении марганец проявляет наибольшую степень окисления?
а) МnО; б) МnO2; в) МnО4;
2. Какая из следующих формул соответствует оксиду азота(II)?
а) NO; б) NO2; в) N2О; г) N2О3.
3. Выберите формулу сероводородной кислоты.
а) Н2S; б) Н2SO3; в) Н2SО4; г) Н2SiO3
4. Какое из этих оснований при попадании на кожу человека вызывает образование язв?
а) Са(ОН)2; б) Аl(ОН)3; в) LiОН; г) NаОН.
5. Какая из этих солей практически не растворяется в воде?
а) Fе(NO3)2; б) РЬСl2; в) ВаSО4; г) NаСl.
Тест 2. . Вопросы для 2 варианта
1. Какая степень окисления хлора в хлорной кислоте НСlО4?
а)+2; б)-1; в)+3; г)+7.
2. Данный оксид составляет 80% массы клетки и выполняет в ней чрезвычайно важные функции.
а) Н2О; б) СО2; в) СаО; г)Nа2О
3. Какая из этих кислот содержится в желудочном соке?
а) НСl; б) НF; в) НВг; г) HI.
4. Формула гидроксида, который соответствует оксиду меди(I), - это:
а) Сr(ОН)3; б) Сu(ОН)2; в) Са(ОН)2; г) СuОН.
5. Какое из этих, названий не соответствует веществу, формула которого СаСО3?
а) Мел; б) мрамор; в) галенит;
г) известняк.
Приложение №2
-
Найдите ошибку (работа в паре)
Найдите ошибку в высказываниях ленивца Сита:
а) «чтобы не было так скользко, зимой дороги посыпают солью хлоридом натрия, формула которой HCl»;
б) «оксид кремния – SiO2 – хорошо растворим в воде”;
в) «гидроксид кальция – Сu(OH)2 – используют для приготовления раствора для побелки подвалов»
г) «в состав пищеварительного сока выделяющегося в желудке входит соляная кислота – H2SO4»
Напишите шпаргалку для Сита
-
Классификация. Заполните схему (составление древа). Приём реставрация.
Приложение 3


 1.
1.
Сложные вещества
_



 _____________ __________________ ________________ ______________
_____________ __________________ ________________ ______________
_________ __________ __________________ ________________
амфотерные _______________ _____________ ________________
______ ________ _________
кислые основные
____________________
_______________________________________________________________________________________________________________________


 2. Сложные вещества _______________
2. Сложные вещества _______________
_



 _____________ __________________ ________________ ______________
_____________ __________________ ________________ ______________
_________ __________ __________________ ________________
______________ _______________ _____________ ________________
______ ________ _________
-
«Найди родственников»
-
Вариант 1. Выписать в таблицу
все оксиды и кислоты и дать им названия :
Nа2SО3, Н2SО4, СrО3, НNO3, МgО, NaNО3, КОН
| Кислоты | Основания | Соли | |
| | | | |
| | | | |
| | | | |
| | | | |
Вариант 2. - Выписать в таблицу
все основания и соли и дать им названия
Мg(ОН)2, Н2SО4, ZnСl2, НNO3, МgО, NаNO3, КОН
| Кислоты | Основания | Соли | |
| | | | |
| | | | |
| | | | |
| | | | |
-
«Третий лишний»
Вариант 1. Найти лишнюю формулу, вычеркнуть её и назвать класс веществ:
1) Н20, К2SO4, SO2 - . . .;
2) ВаSО4, НСl, СuСl2 - . . . ;
3)NaОН, СuО, Сu(ОН)2 - . . . ;
4) Н2SО3, НСl, КNO3 - . . ..
4. «Третий лишний»
Вариант 2. Найти лишнюю формулу, вычеркнуть её и назвать класс веществ:
1) Н2SO3, LiNO3, Н2SO4 - . . .;
2) NаОН, Ва(ОН)2, Н2S - . . . ;
3) Nа2СO3, Р2O5, МgO - . . .;
4)АlРО4, СuSО4, Zn(ОН)2 - . . ..
-
Экспертиза. «Помоги Юному химику»
Цель: Распознать экспериментальным путем, в какой пробирке находится соль, кислота, щелочь
1) Продумайте результаты проведенных расследований.
2) Учащиеся делают анализ и формулирует обоснованный вывод.
6. «Установите соответствие»
Вариант 1.
Nа2SO4 - ……………
К2SiO3 -……………….
Ca3(PO4)2 -…………….
Ва(NO3)2 - ……………..
«Установите соответствие»
Вариант 2.
FеС13 - ……………..
ZnSO4 - ………………
АgNО3 - …………….
Fe2(SO4)3 -…………..
-
Экспресс-тест
1 вариант
| 4. Пара кислот, содержащих сложные ионы: 1. азотная и соляная 2. соляная и сероводородная 3. сероводородная и фосфорная 4. фосфорная и азотная | |||
| 2. Установите соответствие
| 5. Установите соответствие:
| ||
| 3. При разбавлении концентрированной серной кислоты необходимо небольшими порциями приливать: 1) кислоту в воду 2) воду в кислоту | 6. Запишите определение : Кислоты … - из атомов,…и кислотных, …состоящие, …сложные вещества, …водорода, …остатков |
Экспресс-тест
2 вариант
| 4. Пара кислот, содержащих сложные ионы: 1. азотная и фосфорная 2. соляная и йодоводородная 3. сероводородная и кремниевая 4. сернистая и азотная | |||
| 2. Установите соответствие
| 5. Установите соответствие:
| ||
| 3. Выпишите номер правильного ответа. Формула непрочной кислоты: 1) НNO3 2) Н2SO4 3) Н2CO3 4) Н3РO4 | 6. Какой цвет приобретает лакмус в кислоте: 1) синий 2) фиолетовый 3) красный 4) бесцветный |
«Химические страсти»
-
Группа 1 «Химические свойства Оксидов»
Выберите одно из заданий и выполните его
Группа 1 Закончите уравнения реакций
K 2O + H2O
2O + H2O
N a2O + SiO2
a2O + SiO2
C uO + HCl
uO + HCl
S O3 + KOH
O3 + KOH
Группа 1
Из предложенного списка выберите вещества реагирующие с оксидом меди(2) : H2O, NaOН, C u(OH)2 , Р2О5 , HCl , СаО
u(OH)2 , Р2О5 , HCl , СаО
Группа 1
Из предложенного списка выберите вещества реагирующие с оксидом серы(6) : H2O, NaOН, C u(OH)2 , Р2О5 , HCl , СаО
u(OH)2 , Р2О5 , HCl , СаО
Группа 1
Напишите уравнения химических реакций, характеризующие химические свойства оксида железа(3)
Группа 1
Cu ↔ CuO →СиС12 → Си(NО3)2
Группа 2 «Химические свойства Оснований »
Выберите одно из заданий и выполните его
Группа 2 Закончите уравнения реакций
K OН + СuCl2
OН + СuCl2
N aOН + SiO2
aOН + SiO2
C u(OH)2
u(OH)2
S O3 + KOH
O3 + KOH
Группа 2
Из предложенного списка выберите вещества реагирующие с гидроксидом кальция : H2O, Na3РО4, C u(OH)2 , Р2О5 , HCl , СаО
u(OH)2 , Р2О5 , HCl , СаО
Группа 2
Из предложенного списка выберите вещества реагирующие с гидроксидом железа(3) : H2O, NaOН, C u(OH)2 , Р2О5 , HCl , СаО
u(OH)2 , Р2О5 , HCl , СаО
Группа 2
Напишите уравнения химических реакций, характеризующие химические свойства гидроксида железа(3)
Группа 2
Р → Р2О5 → Н3РО4 → К3РО4
Группа 3 «Химические свойства Кислот »
Выберите одно из заданий и выполните его
Группа 3 Закончите уравнения реакций
Z n + HCl
n + HCl
H 2SO4 + KOH
2SO4 + KOH
H Cl + FeO
Cl + FeO
H NO3 + Na2SiO3
NO3 + Na2SiO3
C u + HCl
u + HCl
Группа 3
Из предложенного списка выберите вещества реагирующие с соляной кислотой : H2O, Na3РО4, C u(OH)2 , Р2О5 , HNO3 , СаО, Zn.
u(OH)2 , Р2О5 , HNO3 , СаО, Zn.
Группа 3
Из предложенного списка выберите вещества реагирующие с серной кислотой : H2O, Вa(OН)2, C u(OH)2 , Р2О5 , HCl , СаО, Fe.
u(OH)2 , Р2О5 , HCl , СаО, Fe.
Группа 3
Напишите уравнения химических реакций, характеризующие химические свойства серной кислоты
Группа 3
Са → СаО → Са(ОН)2 → СаSО4
Группа 4 «Химические свойства Солей »
Выберите одно из заданий и выполните его
Группа 4 Закончите уравнения реакций
Z n + СuCl2
n + СuCl2
H 2SO4 + K2SiO3
2SO4 + K2SiO3
K OH + Fe2(SO4)3
OH + Fe2(SO4)3
C aCl2 + K2SO4
aCl2 + K2SO4
Группа 4
Из предложенного списка выберите вещества реагирующие с хлоридом меди(2) : H2O, Na3РО4, C u(OH)2 , Р2О5 , HNO3 , СаО, Zn.
u(OH)2 , Р2О5 , HNO3 , СаО, Zn.
Группа 4
Из предложенного списка выберите вещества реагирующие с сульфатом железа(2) : H2O, Вa(OН)2, C u(OH)2 , Р2О5 , HCl , СаО, Fe.
u(OH)2 , Р2О5 , HCl , СаО, Fe.
Группа 4
Напишите уравнения химических реакций, характеризующие химические свойства сульфата меди
Группа 4
S → SО2 → H2SО3 → СаSО3
«Ромашка»


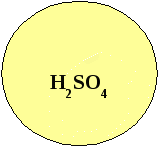
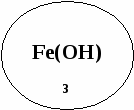



«Ромашка»








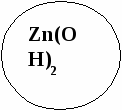


1 – 3 -Надо еще поработать, изучи еще раз параграфы в учебнике.
4 – 5 -Очень хорошо. Но не ограничивайте себя учебником.
5– 6 - У вас отличные знания. Но научитесь использовать их в жизни!
Рефлексия
1. Сделал дело – гуляй смело.
2. Счастье тот добывает, кто уменьем
ума набирает.
3. Работа – не волк, в лес не убежит.
4. Одна голова – хорошо, а две – лучше.
5. Что посеешь, то и пожнешь.
6. Не тот хорош, кто лицом пригож,
а тот хорош, кто на дело гож.
Оценочный лист
| Название заданий | Оценка ( по 5 бал. системе) | |
| 1. | Тестирование | |
| 2. | Классификация | |
| 3. | «Найди родственников» | |
| 4. | «Третий лишний» | |
| 5. | Экспертиза | |
| 6. | «Установите соответствие» | |
| 7. | Экспресс – тест по кислотам | |
| 8. | «Химические страсти» | |
| Итог | | |
Используются материалы интернета и учителей курсов
Здесь представлен конспект к уроку на тему «Основные классы неорганических соединений», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

