Конспект урока «Состав и свойства воды» по химии
Тема: «Состав и свойства воды».
Цель – изучить состав, физические и химические свойства воды.
Задачи:
Образовательные
– продолжить развитие знаний учащихся о воде как сложном веществе;
- осуществить дальнейшее формирование знаний учащихся о взаимосвязи состава, строения и свойств и применении веществ;
- с помощью химического эксперимента подтвердить познаваемость мира.
Воспитательные
- продолжить формирование навыков самостоятельной работы;
- продолжить формирование стойкого позитивного интереса к предмету;
- воспитывать потребность во взаимопомощи, ответственность не только за свои знания, но и за знания товарищей.
Развивающие
- продолжить развитие памяти, мышления, культуры речи, умения сравнивать, анализировать, обобщать, делать выводы.
Ход занятия.
Учащиеся делятся на 3 группы по 5 -6 человек. В каждой группе есть консультант, заранее назначенный и прошедший инструктаж. Его задача проверять правильность выполнения заданий учащимися, при необходимости оказать помощь.
-
Организационный момент.
-
Актуализация знаний.
Вода! У тебя нет ни вкуса, ни цвета, ни запаха,
Тебя не возможно описать, тобою наслаждаются,
Не ведая, что ты такое.
Нельзя сказать, что ты необходима для жизни:
Ты сама жизнь… Ты самое большое богатство в мире…
Антуан де Сент – экзюпери.
Сегодня на занятии речь пойдёт о самом важном химическом соединении – о воде.
Учащиеся делают краткие сообщения по следующим темам: «Запасы воды и её распространение в природе», «Значение воды».
Итак, ребята вы знаете, что вода является самым распространенным веществом на Земле.
Вода содержится в растительных и животных организмах, является главным компонентом организма человека и среды его обитания. Число ролей, которые вода играла и продолжает играть необозримо велико.
Свойства воды уникальны и резко отличаются от свойств других веществ.
-
Состав и свойства воды – химический практикум.
12 опытов
4. Подведение итогов.
3. Состав и свойства воды – химический практикум.
Опыт 1
Определение интенсивности запаха воды.
Опыт 2.
Определение прозрачности воды.
Опыт 3.
Поверхностное натяжение воды – «непроницаемая ткань».
Опыт 4.
Поверхностное натяжение воды – «плавающая скрепка».
Опыт 5.
Растворимость веществ в воде.
Опыт 6.
Определение примесей в воде.
Опыт 7.
Растворимость веществ в воде.
Опыт 8.
Определение водородного показателя воды (pH среды).
Опыт 9.
Определение сульфат-ионов в водопроводной и минеральной воде.
Опыт 10.
Определение хлорид-ионов в водопроводной и минеральной воде.
Опыт 11.
Определение карбонат-ионов в водопроводной и минеральной воде.
Опыт 12.
Определение ионов железа (III) в водопроводной и газированной воде.
Опыт 1.
Определение интенсивности запаха воды.
Оборудование: 4 пробирки, 4 пробки, штатив для пробирок, дистиллированная вода, водопроводная вода, минеральная вода, вода из водоёма.
Ход работы.
Проведите опыт сначала с дистиллированной водой, водопроводной водой, минеральной водой, а затем с водой из водоема и сравните результаты.
-
Налейте исследуемую воду в пробирку до 2/3 объёма.
-
Закройте пробкой.
-
Сильно встряхните в закрытом состоянии.
-
Отметьте характер и интенсивность запаха.
-
Дайте оценку интенсивности запаха воды в баллах, пользуясь таблицей 1.
Таблица 1.
| Интенсивность запаха (балл) | |
| Отсутствие ощутимого запаха | 0 |
| Очень слабый запах – не замечается потребителями, но обнаруживается специалистами | 1 |
| Слабый запах – обнаруживается потребителями, если обратить на это внимание | 2 |
| Запах легко обнаруживается | 3 |
| Отчетливый запах – неприятный и может быть причиной отказа от питья | 4 |
| Очень сильный запах – делает воду непригодной для питья | 5 |
-
Результаты занесите в таблицу 2.
-
Сделайте выводы.
Таблица 2.
| Интенсивность запаха (балл) | Прозрачность воды; высота столбца | Выводы | |
| | | | |
| | | | |
| | | | |
| | | |
Опыт 2.
Определение прозрачности воды.
Оборудование: плоскодонный стеклянный мерный цилиндр, печатный текст, линейка, дистиллированная вода, водопроводная вода, минеральная вода, вода из водоёма.
Ход работы.
Проведите опыт сначала с дистиллированной водой, водопроводной водой, минеральной водой, а затем с водой из водоема и сравните результаты.
-
Установите плоскодонный стеклянный цилиндр на печатный текст.
-
Вливайте исследуемую воду, следя за тем, чтобы можно было читать через воду текст.
-
Отметьте, на какой высоте вы не будете видеть шрифт или шрифт будет расплываться.
-
Измерьте высоту столбцов линейкой.
-
Результаты занесите в таблицу 2.
-
Сделайте выводы.
Опыт 3.
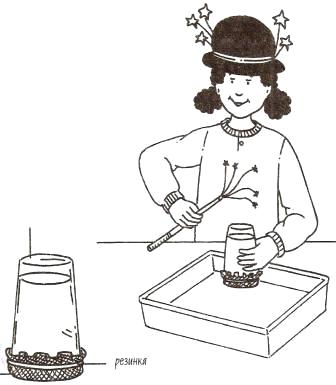
Поверхностное натяжение воды – «непроницаемая ткань».
Оборудование: Стеклянная банка 250 мл, марля, резинка, колба с водопроводной водой, стеклянная миска.
Ход работы.
-
Поставьте банку в миску.
-
Накройте банку марлей.
-
Закрепите плотно марлю на месте резинкой. Края марли прижми к стенкам банки.
-
Налейте через марлю полную банку воды.
-
Одной рукой возьмите банку вместе с марлей, а другой рукой накрой её сверху.
-
Переверните банку вверх дном над миской.
-
Медленно уберите руку, закрывающую банку. Что произойдет?
Объяснение поверхностное натяжение— способности молекул на поверхности жидкости сцепляться друг с другом, образуя тонкую пленку. Вода заполняет отверстия в ткани и «запечатывает» их благодаря поверхностному натяжению. Кроме того, воздух, так же, как и вода, состоит из молекул. В воздухе молекулы все время находятся в движении, создавая постоянное атмосферное давление. Когда ты переворачиваешь стакан, в нем не остается воздуха, поэтому там отсутствует и атмосферное давление. Давление воздуха снаружи стакана на ткань оказывается больше, чем давление воды внутри него. Давление воды на ткань изнутри стакана возникает из-за силы земного притяжения, или гравитации, воздействующей на воду. Притяжение, или гравитация — это сила, с которой объекты притягиваются друг к другу. Она зависит от их массы. Совокупность атмосферного давления на поверхность ткани и силы поверхностного натяжения воды и позволяет ткани удерживать воду.
Опыт 4.
Поверхностное натяжение воды – «плавающая скрепка».
Оборудование: Стакан, водопроводная вода, 3 канцелярские скрепки.
Ход работы. 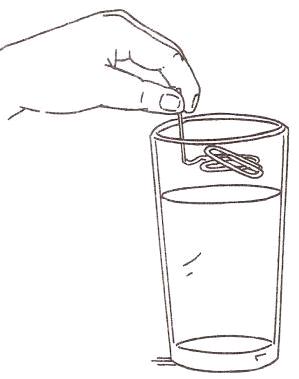
-
Налей в стакан воды.
2. Бросьте скрепку в стакан с водой.
3. Сделай из одной скрепки крючок с плоской загнутой частью, как показано на рисунке
4. Положи скрепку на плоский участок крючка, сделанного из другой скрепки. Держи его горизонтально как можно ближе к поверхности воды, но не касаясь её.
5. Медленно опусти скрепку в воду.
Советы. Если скрепка будет тонуть, попробуй потереть её об свечку, прежде чем опускать в воду.
Объяснение Скрепка может плавать по поверхности воды благодаря особому свойству воды – поверхностному натяжению. Молекулы воды полярны. Положительно заряженный конец одной молекулы притягивается к отрицательно заряженному концу другой. На каждую молекулу со всех сторон действует притяжение других молекул, окружающих её. Однако самый поверхностный слой молекул воды лишён соседства других молекул сверху, поэтому в этом слое молекулы притягиваются только к молекулам, находящимся под ними и вокруг них. Это притяжение создаёт на поверхности воды нечто вроде тонкой натянутой плёнки. Поверхностного натяжения воды достаточно для того, чтобы выдержать все скрепки. Если ты хочешь, чтобы скрепка поплыла, очень важно опускать её на воду медленно и строго горизонтально. Если скрепка входит в воду под углом или резко опускается в неё, поверхностная плёнка рвётся и скрепка не может удержаться на воде.
Ответьте на вопросы.
- Запасы воды и её распространение в природе.
- Какова роль воды?
- Физические свойства воды:
а) цвет; б) запах; в) вкус; г) плотность; д) температура плавления; е) температура кипения;
- Почему марля пропускает воду только в одном направлении?
- Почему скрепка не тонет?
- Что такое поверхностное натяжение?
- Какое строение имеет молекула воды? (собрать молекулу воды).
- Что такое живая и «мёртвая» вода?
Опыт 5.
Растворимость веществ в воде.
Оборудование: 4 стакана, колба с холодной водой, термос с горячей водой, мерный цилиндр, стеклянная палочка, весы, гири, часы, сахар рафинад, сахар песок, фарфоровые чашки.
Ход работы.
Проводите опыт сначала с холодной водой, а затем с горячей и сделайте вывод.
-
Взвесьте кусочек сахара рафинад на весах (2 образца).
-
Взвесьте такое же количество сахара песка (2 образца).
-
Налейте по 150 мл холодной воды в 2 стакана.
-
Поместите навески сахара (рафинад и песок) в 2 пластиковых стакана с холодной водой.
-
Перемешайте стеклянной палочкой.
-
Отметьте время растворения. Результаты занесите в таблицу 3.
Таблица 3.
| Ненасыщенный раствор | Насыщенный раствор | Выводы | |||||
| Объём воды | Масса сахара | Время растворения сахара песка | Время растворения сахара рафинад | Масса сахара рафинад (добавили) | Время растворения сахара рафинад | ||
| Холодная | | | | | | | |
| Горячая | | | | | | | |
-
Проделайте такой же опыт только с раствором сахара в горячей воде.
-
Приготовьте насыщенный раствор сахара. В раствор сахара с холодной водой, перемешивая, добавляйте кусочки сахара рафинад до тех пор, пока сахар перестанет растворяться.
-
Отметьте время растворения. Результаты занесите в таблицу 3.
-
Сделайте вывод.
Ответьте на вопросы.
- Дайте определение раствору.
- Какие факторы влияют на растворимость веществ в воде?
- Почему в горячей воде кусочек сахара растворяется быстрее, чем в холодной?
- Какие бывают растворы по растворимости?
- Какой раствор называется ненасыщенным?
- Какой раствор называется насыщенным?
- Как ненасыщенный раствор сделать насыщенным?
- Как сделать насыщенный раствор ненасыщенным?
- Какие растворы чаще всего используют?
Опыт 6.
Определение примесей в воде.
Оборудование. Инструкции по технике безопасности, сухое горючее, держательные щипцы, 4 пробирки с водой: № 1 – дистиллированная вода, № 2 – водопроводная вода, № 3 – вода из водоёма, № 4 – минеральная вода, штатив для пробирок, часы.
Ход работы.
1. Изучите инструкцию по технике безопасности – работа с нагревательными приборами.
-
Закрепите пробирку держательными щипцами.
-
Зажгите сухое горючее.
-
Нагрейте воду ( 5 мл) до кипения.
-
Отметьте время закипания в каждой пробирке.
-
Потушите сухое горючее.
-
Занесите результаты в таблицу 4.
-
Сделайте выводы
Таблица 4.
| Название воды | Объём воды | Время закипания | Вывод | |
| | | | | |
| | | | | |
| | | | | |
| | | | |
Ответьте на вопросы.
- На какие группы делят вещества по физическим свойствам?
- Дайте определение чистым веществам? Приведите примеры.
- Какие вещества называются смесями?
- Какие бывают смеси? Приведите примеры.
- Каких веществ больше содержится в природе?
- От чего зависит температура закипания воды?
- Как в домашних условиях ускорить время закипания воды при приготовлении пищи?
Опыт 7.
Растворимость веществ в воде.
Оборудование: образцы различных солей в пробирках, штатив для пробирок, стеклянные палочки, мерный цилиндр, вода, таблица растворимости.
Ход работы.
В пробирках вам выданы различные образцы солей. Рассмотрите растворимость веществ в воде.
1. Налейте по 5-10 мл воды в каждую пробирку.
2. Перемешайте стеклянной палочкой.
3. Рассмотрите, все ли вещества растворились в воде.
4. Результаты занесите в таблицу 5.
5. Полученные результаты сравните с таблицей растворимости.
6. Сделайте выводы.
Таблица 5.
| Химическая формула | Внешний вид | Растворимость в воде | Вывод | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | | |
| | | | |
Ответьте на вопросы.
- Кем была представлена химическая теория растворов?
- На какие группы делят вещества по растворимости в воде?
- Приведите примеры веществ:
А) растворимых в воде;
Б) нерастворимых веществ;
В) малорастворимых в воде.
Состав воды. Опыт 8,9,10,11,12.
Опыт проводите с водопроводной и минеральной водой.
Оборудование: инструкции по технике безопасности, водопроводная вода, минеральная вода, штатив для пробирок, пробирки – 10 штук, универсальная индикаторная бумага, азотная кислота, соляная кислота, хлорид бария, нитрат серебра, перекись водорода, цианистый аммоний.
Опыт 8.
Определение водородного показателя воды (pH среды).
-
В пробирку поместите 2,5 мл анализируемого раствора.
-
Испытайте pH среды универсальной индикаторной бумагой.
-
Сравните полученные результаты со шкалой.
-
Результаты занесите в таблицу 6.
-
Сделайте вывод.
Опыт 9.
Определение сульфат-ионов в водопроводной и минеральной воде.
-
Изучите инструкции № 2, 5.
-
В пробирку поместите 2,5 мл анализируемого раствора.
-
Добавьте 6–8 капель раствора азотной кислоты (HNO3).
-
Затем добавьте 3-4 капли раствора хлорида бария (BaCI2).
-
Образование осадка говорит о присутствии сульфат-иона.
-
Результаты занесите в таблицу 6.
-
Сделайте вывод.
Опыт 10.
Определение хлорид-ионов в водопроводной и минеральной воде.
-
Изучите инструкцию №
-
В пробирку поместите 2,5 мл анализируемого раствора.
-
Добавьте 3-4 капли раствора нитрата серебра (AgNO3).
-
Образование осадка говорит о присутствии хлорид-иона.
-
Результаты занесите в таблицу 6.
-
Сделайте вывод.
Опыт 11.
Определение карбонат-ионов в водопроводной и минеральной воде.
-
Изучите инструкцию № 2.
-
В пробирку поместите 2,5 мл анализируемого раствора.
-
Налейте такой же объём раствора соляной кислоты (HCI).
-
Выделение пузырьков газа говорит о присутствии карбонат-ионов.
-
Результаты занесите в таблицу 6.
-
Сделайте вывод.
Опыт 12.
Определение ионов железа (III) в водопроводной и газированной воде.
-
Изучите инструкцию № 2 .
-
В пробирку поместите 2,5мл анализируемого раствора.
3. Добавьте 3-4 капли раствора соляной кислоты (HCI).
4. 3-4 капли перекиси водорода (Н2О2)
5. 3-4 капли цианистого аммония
6. Появление розовой окраски говорит о присутствии ионов-железа.
-
Результаты занесите в таблицу 6.
-
Сделайте вывод.
Таблица 6.
| рН среды | Сульфат -ионы | Хлорид- ионы | Карбонат -ионы | Ионы железа (III) | Вывод | |
| Водопроводная вода | | | | | | |
| Минеральная вода | | | | | |
Ответьте на вопросы.
- Почему вода бывает разного цвета и чем это может быть обусловлено?
- Какой состав природной воды?
- Какие катионы и анионы были обнаружены в водопроводной и минеральной воде?
- К чему может привести избыточное содержание ионов … в воде?
- Какая вода называется минеральной?
- На какие группы делят минеральные воды в зависимости от содержания солей (химического состава) и минерализации (бальнеологии)?
Поскольку вода содержит соли, определяющие цвет, но и жесткость, ответьте на вопрос:
- Что такое жесткость воды?
- Какие факторы обуславливают жесткость воды?
- Какая бывает жесткость воды?
- Какими последствиями чревато употребление жесткой воды?
- Как жесткость воды влияет на процесс приготовления пищи?
- К чему может привести применение жесткой воды?
- Как можно устранить жесткость воды?
Дополнительная информация.
Состав природной воды.
-
Ионы Na, K, Ca, Mg, CI, SO4, HCO3, CO3 ;
-
Органические вещества (белки, ферменты, углеводы)
-
Газы (азот, кислород, углекислый газ, сероводород, аммиак);
-
Микроэлементы ( медь, хром, марганец, кобальт, никель, серебро, золото);
-
Биогенные вещества (соединения азота, фосфора, кремния).
ПДК (предельно допустимые концентрации).
CI – 350 мг/л Fe – 0,005 мг/л Cu – 0,005 мг/л
SO4 – 400 мг/л Ca – 20 мг/л Ni – 0,01 мг/л
NO3 – 9,1 мг/л Mg – 5 мг/л Pb – 0,01 мг/л
Заболевания, которые вызваны избыточным содержанием ионов…
CL, SO4 – желудочно – кишечный тракт;
NO3 – отравление, опухоли, органы дыхания;
I – зоб;
F – зубы;
Cu, Ca – камни почек, сердечно-сосудистые заболевания;
Zn – мышцы двигательного аппарата;
Cd, Hg, Mn – почки;
Hg, Pb – заболевания ЦНС;
Ba – органы зрения
As, AL, Hg, Ti – волосы, ногти.
Жесткость воды
Определение жесткости, виды жесткости, единицы измерения жесткости
Жесткость воды - мера содержания в воде растворенных солей кальция и магния. Источником их являются, в основном, известняки и доломиты. Различают постоянную жесткость, временную жесткость и общую жесткостьводы.
Постоянная жесткость воды (некарбонатная) Жп - обусловливается содержанием сульфатов, хлоридов и других (кроме бикарбонатов) солей кальция и магния. При нагревании или кипячении воды они остаются в растворе.
Временная жесткость воды (устранимая, карбонатная) Жвр - обусловливается содержанием бикарбонатов. При нагревании или кипячении воды бикарбонаты переходят в нерастворимые карбонаты, при этом жесткая вода умягчается. Обычно карбонатная жесткость составляет 70-80% от общей жесткости.
Общая жесткость воды Ж - определяется как суммарное содержание в воде солей кальция и магния, выражается как сумма карбонатной и некарбонатной жесткости:
Ж = Жп + Жвр
Жесткая вода образует накипные отложения в водонагревательных и охлаждающих системах. В первом приближении это заметно на стенках, например, чайника. При хозяйственно-бытовом использовании жесткой воды наблюдается перерасход моющих средств вследствие образования осадка кальциевых и магниевых солей жирных кислот.
Классификация природных вод по жесткости, бытовое определение жесткости воды
При оценке жесткости воды обычно воду характеризуют следующим образом:
| Жесткость, мг-экв/л | |
| очень мягкая вода | до 1,5 мг-экв/л |
| мягкая вода | от 1,5 до 4 мг-экв/л |
| вода средней жесткости | от 4 до 8 мг-экв/л |
| жесткая вода | от 8 до 12 мг-экв/л |
| очень жесткая вода | более 12 мг-экв/л |
В соответствии с ГОСТ 4151-72 общая жесткость воды измерялась в мг-экв/л. С введением с 01.01.89 года изменения №1 единицей измерения жесткости являлся моль/м3.
С 01.01.2005 введен ГОСТ Р 52029-2003 Вода. Единица жесткости. По новому ГОСТу жесткость выражается в градусах жесткости (°Ж), что соответствует концентрации щелочноземельного элемента, численно равной 1/2 его моля, выраженной в мг/дм3 (г/м3). Ниже приводятся соотношения национальных единиц жесткости воды, принятых в других странах (ГОСТ Р 52029-2003).
Соотношения национальных единиц жесткости воды
Данные взяты из текста ГОСТа
| Обозначение единицы жесткости | Россия | Германия | Великобритания | Франция | США | |
| Россия | °Ж | 1 | 2,80 | 3,51 | 5,00 | 50,04 |
| Германия | °DH | 0,357 | 1 | 1,25 | 1,78 | 17,84 |
| Великобритания | °Clark | 0,285 | 0,80 | 1 | 1,43 | 14,3 |
| Франция | °F | 0,20 | 0,56 | 0,70 | 1 | 10 |
| США | ppm | 0,02 | 0,056 | 0,070 | 0,,10 | 1 |
Примечания:
°Ж = 20,04 мг Ca2+ или 12,15 Mg2+ в 1 дм3 воды;
°DH = 10 мг CaO в 1 дм3 воды;
°F = 10 мг CaCO3 в 1 дм3 воды;
ppm = 1 мг CaCO3 в 1 дм3 воды;
°Clark = 10 мг CaCO3 в 0,7 дм3 воды.
Численные значения жесткости измеренные в мг-экв/л, моль/м3, и °Ж, несмотря на различия в обозначении, равны между собой.
Источники:
-
Справочник по свойствам, методам анализа и очистке воды: В двух частях. Часть 1. / Киев: Наукова думка, 1980. - 680 с.
-
ГОСТ Р 52029-2003 Вода. Единица жесткости.
Вода минеральная
Минеральная вода – вода, содержащая биологически активные минеральные и органические компоненты, обладающая специфическими физико-химическими свойствами, которые оказывают лечебное воздействие на организм человека.
Минеральные воды чаще всего бывают подземными, реже – поверхностными.
Минеральные воды выходят на поверхность в виде естественных минеральных источников или выводятся при помощи буровых скважин.
Изучением минеральных вод и их полезных свойств занимается наука бальнеология.
Классификация минеральных вод с точки зрения бальнеологии:
-
Столовые минеральные воды – минерализация до 1 г/л
-
Лечебно-столовые минеральные воды – минерализация от 1 до 10 г/л
-
Лечебные минеральные воды – минерализация более 10 г/л или высокое содержание биологически активных элементов: железа, брома, йода, сероводорода, фтора и т.д., при этом общая минерализация может быть невысокой.
Классификация минеральных вод по химическому составу:
-
Гидрокарбонатные минеральные воды
-
Хлоридные минеральные воды
-
Сульфатные минеральные воды
-
Натриевые минеральные воды
-
Кальциевые минеральные воды
-
Магниевые минеральные воды
Большинство минеральных вод имеет смешанный состав, что повышает лечебный эффект при их применении.
Классификация минеральных вод в зависимости от газового состава и наличия специфических элементов:
-
Углекислые (кислые) минеральные воды
-
Сульфидные (сероводородные) минеральные воды
-
Бромистые минеральные воды
-
Йодистые минеральные воды
-
Мышьяковистые минеральные воды
-
Радиоактивные (радоновые) минеральные воды
Лечение минеральными водами можно проводить только под наблюдением врача!
Здесь представлен конспект к уроку на тему «Состав и свойства воды», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

