Конспект урока «Углеводы. Глюкоза. C6H12O6; С11 (Н2О) m.Строение, свойства, применение» по химии

Подготовила: учитель химии высшей категории Цебрук И.Г.
ГУ Качарская средняя школа г. Рудный
Тема: Углеводы. Глюкоза. C6H12O6; С11 (Н2О) m.Строение, свойства, применение.
Оборудование: глюкоза, уксусная кислота, Ag2O, щелочной раствор гидроксила меди (II), шаростержневая модель молекулы глюкозы, пробирки, спиртовка.
Целепологание:
1) обобщение и систематизация знаний учащихся по теме «Сложные эфиры. Жиры», «Зависимость свойств органических веществ от химического строения»;
2) создание условий для развития умения самостоятельно приобретать знания, используя различные источники информации;
3) формирование умений прогнозировать и объяснять свойства вещества в зависимости от их состава и химического строения;
4) формирование опыта творческой деятельности, опыта делового общения;
5) развитие творческого мышления, памяти, внимания, наблюдательности;
6) развитие социальной активности учащихся через межпредметные связи химии с историей, биологией, медициной, литературой;
7) формирование уважительного отношения к труду.
Методы: проблемная беседа с выдвижением гипотез и проверкой их демонстрационным и лабораторным экспериментом.
Темой «Углеводы» заканчивается изучение кислородсодержащих, органических соединений курс органической химии в XI классе.
(греч. γλυκός – сладкий)
(франц. glykys - виноградный сахар)
6СО2 + 6Н2О → 6О2 ↑ + углеводы – самая уникальная реакция на Земле
углеводы С11 (Н2О) m n ≥ 3
УГЛЕВОДЫ– в растениях – 80% сухого вещества;
в организме человека 2%
Пища человека на 70% состоит из углевода.
То, что неясно,
следует выяснить.
Конфуций
I АКТУАЛИЗАЦИЯ ПРЕЖНИХ ЗНАНИЙ
С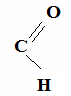 ложные эфиры. Жиры. Мыла.
ложные эфиры. Жиры. Мыла.
1 . Выберите из формул:
. Выберите из формул:
А) СН3 – ОН; В) СН3 – СН2 -
Б) СН3 – СН2 – - (СН2)2 - СН3;
Г) СН3 – (СН2)6 – СООН те, которые надо вставить в пропуски.
I вариант …..+ СН3 – СООН → СН3 - - СН3 + Н2О
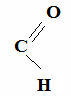
II вариант СН3 – СН2 - + НО – (СН2)2 – СН3 → … + Н2О
2. Укажите соответствие: I вариант
1) С4Н9СООН А) пропаноль
2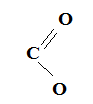 ) СН3 - - С4Н9 Б) валериановая к-та
) СН3 - - С4Н9 Б) валериановая к-та
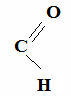
3) СН3 – СН2 - В) бутилацетат
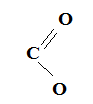
II вариант
1) С2Н5 - - СН3 А) стеариновая к-та
2) С17Н35 – СООН Б) глицерин
3

 ) СН2 – СН – СН2 В) метилпропионат
) СН2 – СН – СН2 В) метилпропионат
ОН ОН ОН
3. Какие реакции называются:
I вариант - гидролизом II вариант – этерификацией
А) отщепление воды; Б) присоединение водорода;
В) образование сложного эфира; Г) взаимодействие с водой.
4. Составьте два изомера сложному эфиру из второго задания.
5. Напишите формулу:
I вариант – жидкого мыла II вариант – твердого мыла
6. Укажите агрегатное состояние жира
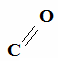
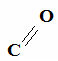
С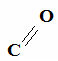
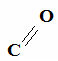 Н2 – О - - С16Н33 СН2 – О - - С17Н33
Н2 – О - - С16Н33 СН2 – О - - С17Н33
СН – О - - С3Н7 СН – О - - С15Н29
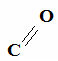

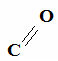
СН2 – О- - С17Н35 СН2 – О - - С8Н17
I вариант I вариант
I I ФОРМИРОВАНИЕ НОВЫХ ПОНЯТИЙ И СПОСОБОВ ДЕЙСТВИЙ 1)Строение молекулы глюкозы
I ФОРМИРОВАНИЕ НОВЫХ ПОНЯТИЙ И СПОСОБОВ ДЕЙСТВИЙ 1)Строение молекулы глюкозы
Углеводы – группа природных кислородсодержащих органических соединений получили свое название в связи с тем, что в начале казалось, будто все эти соединения имеют состав, выраженный в общем виде формулой С11 (Н2О) m, где n ≥ 3. название углеводы закрепилось. Хотя и противоречило истине:
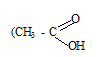 ,
, 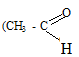 они не являются углеводами)
они не являются углеводами)
Чтобы исследовать вещество его надо получить в чистом виде. Так, чистая глюкоза – вещество белого цвета, плавится при t0 ≈1800, хорошо растворяется в воде, сладкая на вкус (многие из вас вероятно употребляли таблетки глюкозы. Они подтверждают, что глюкоза – вещество сладкое, но сахар слаще).
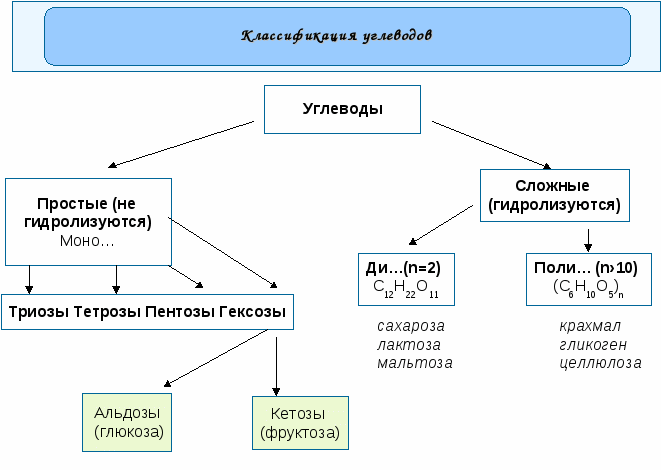
СН2 O простейшая формула по данным элементарного анализа. Состав глюкозы (в середине XIX века) установил И. Берцелиус - С6Н12О6
Каково же химическое строение глюкозы? Какие функциональные группы входят в ее состав?
ПРАКТИКУМ
Экспериментальная постановка проблемы и последующая групповая дифференцированная работа (разделение между группами задач).
Группы отчитываются перед классом о своей работе.
Группа: Ведущий – организует обсуждение проблемы, вовлекает в него всех членов группы.
Аналитик – заданы вопросы участникам по ходу обсуждения проблемы, подвергал сомнению высказанные идеи, формулировки.
Секретарь – референт – фиксирует все, что относится к решению проблемы. Он выступает перед классом, чтобы представить мнение своей группы.
Наблюдатель – оценивает участие каждого члена группы в решении проблемы.
| Ваши предположения | Проверка на опытах предположения учащихся | |
| | | |
| Появление проблемной ситуации | Возможная гипотеза | Решение проблемы |
| | | |
1) Глюкоза не окрашивает лакмус и не образует солей (значит, она не является кислотой);
2) Она дает реакцию серебряного зеркала (принадлежит к альдегидам);
3) При восстановлении глюкозы образуется известный нам гексан (значит в основе скелета молекулы находится неразветвленная цепочка из шести атомов углерода); 4)С гидроксидом меди (2) образует васильковый р-р(значит глюкоза многоатомный спирт)
5) Известен сложный эфир глюкозы, в молекуле которого содержится пять остатков уксусной кислоты (значит глюкоза пятиатомный спирт);
Число гидроксильных групп в молекуле глюкозы выяснил в своих работах (в конце восьмидесятых годов XIX века) А.А. Колли. Он доказал, что в молекулу глюкозы входит пять гидроксидных групп (получил пентаацетилглюкозу).
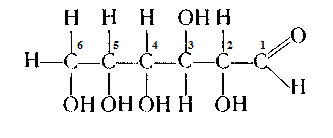
Три взаимопревращающиеся формулы – без символов, образующих колец и соединений с ними - Н
НО С6Н2ОН СН2ОН ОН ОН НО















 ОН
ОН 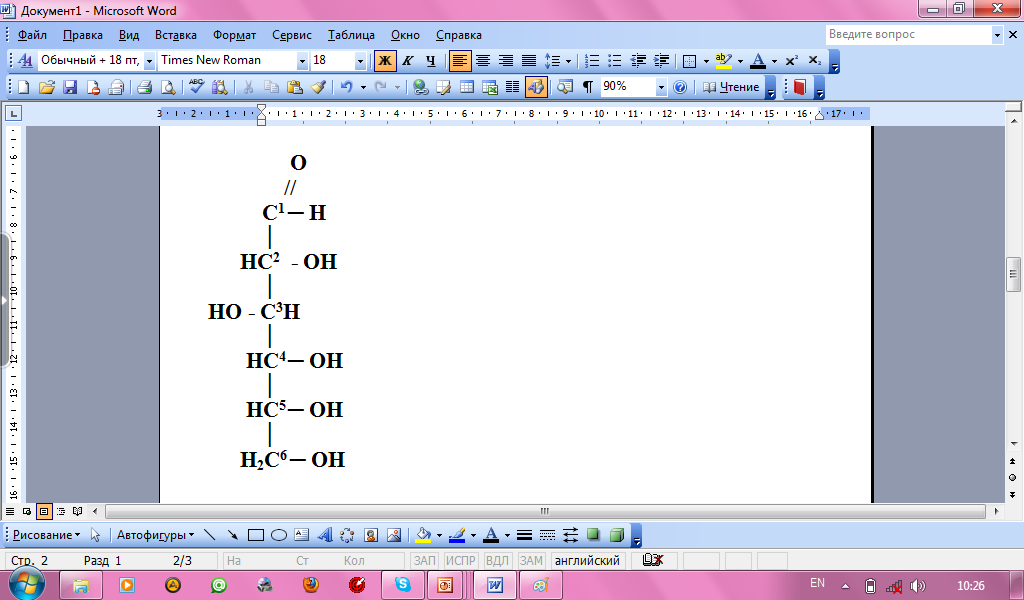
ОН
L – форма ß – форма
36% 64%
За открытие формулы химического строения глюкозы Хеуорс был награжден Нобелевской премией в 1937 г.
2)ИЗОМЕРЫ ГЛЮКОЗЫ
а


 ) Явление, когда вещества, способны существовать в нескольких взаимопревращающихся изомерных формулах, А.М. Бутлеров назвал динамической изомерией, позже это явление названо таутомерией. Он впервые раскрыл сущность этого явления L – форма глюкозы линейная ß - форма глюкозы.
) Явление, когда вещества, способны существовать в нескольких взаимопревращающихся изомерных формулах, А.М. Бутлеров назвал динамической изомерией, позже это явление названо таутомерией. Он впервые раскрыл сущность этого явления L – форма глюкозы линейная ß - форма глюкозы.
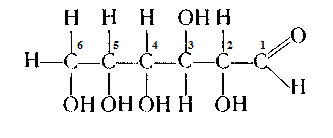
б) (четыре ассиметричных атомов углерода)
Наличие ассиметричного атома углерода (с четырьмя различными заместителями) - являются одной из причин оптической изомерии. Число оптических атомов этого вещества (N) зависит от числа ассиметричных атомов углерода ; N=2n2. У глюкозы таких изомеров 16.
в) Структурная изомерия (фруктоза)
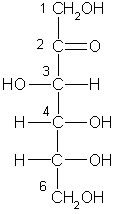 в 1,7раза слаще сахарозы, которую принимают за стандарт сладости.
в 1,7раза слаще сахарозы, которую принимают за стандарт сладости.
СВОЙСТВА ВЕЩЕСТВА – ЭТО ФУНКЦИИ ЕГО ХИМИЧЕСКОГО СТРОЕНИЯ .
3)ХИМИЧЕСКИЕ СВОЙСТВА ГЛЮКОЗЫ
1) Восстановление до сорбита (шестиатомного спирта)
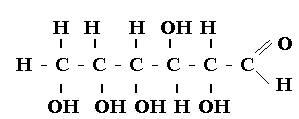
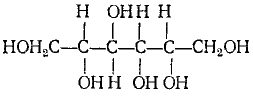
+ [Н2]
[Н2]
Глюкоза Сорбит
И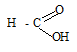
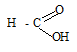 з сорбита получают витамин С
з сорбита получают витамин С
2)Окисление глюкозы.
а
 ) СН2ОН – (СНОН)4 + 2 Сu(OH)2 CH2OH – (CHOH)4 - + Cu2O + 2H2O
) СН2ОН – (СНОН)4 + 2 Сu(OH)2 CH2OH – (CHOH)4 - + Cu2O + 2H2O
б) Реакция серебряного зеркала.
3) Биохимическое брожение
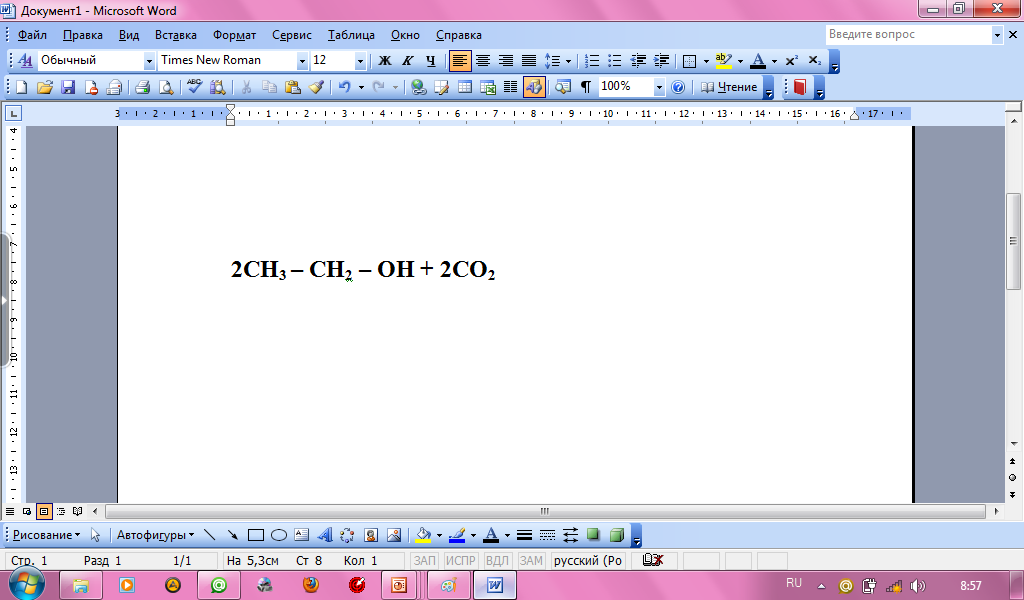
Спиртовое


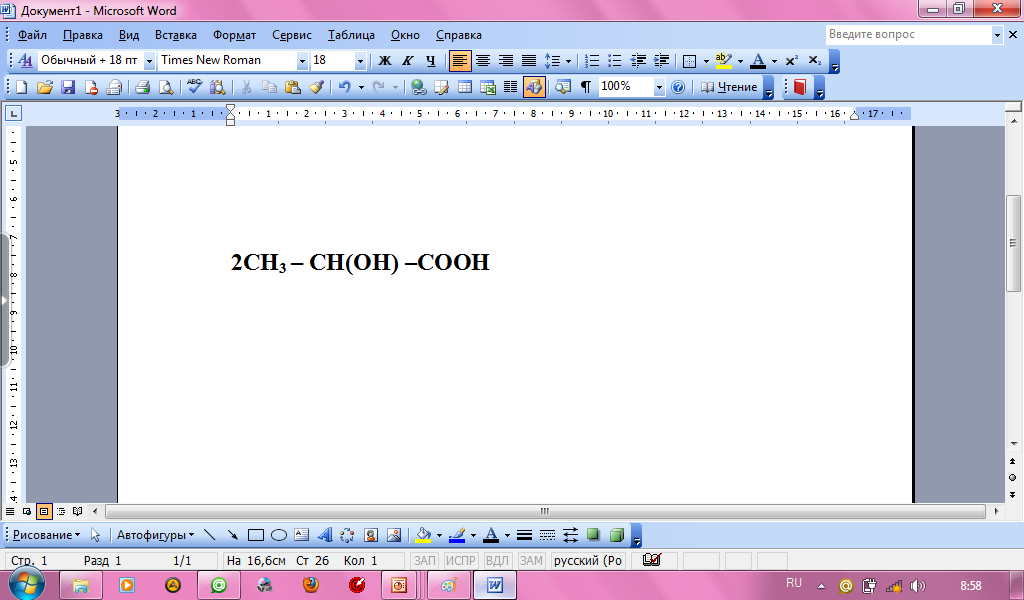
Молочнокислое

С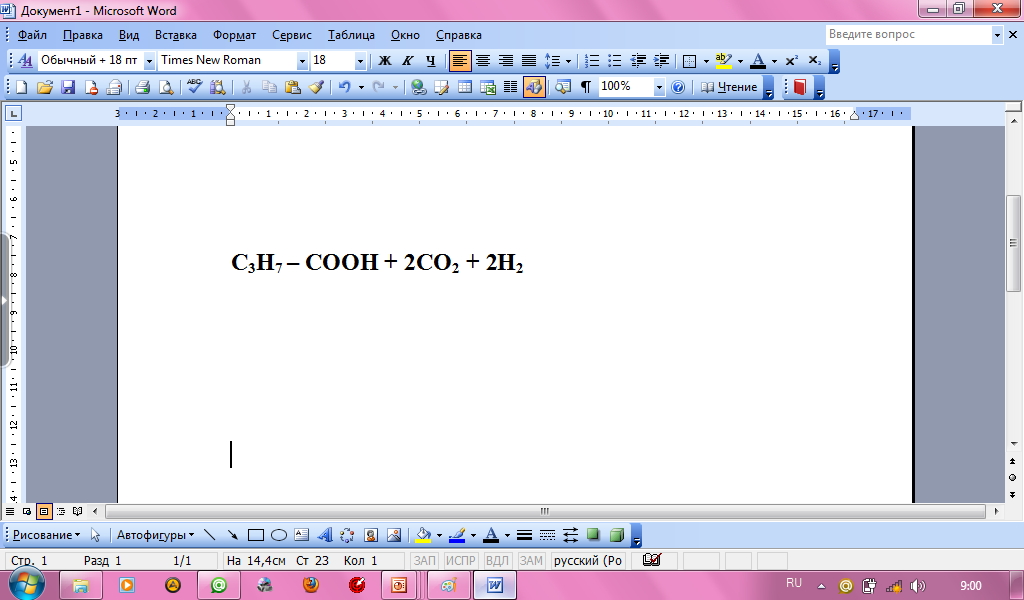 6Н12О6
6Н12О6
Маслянокислое

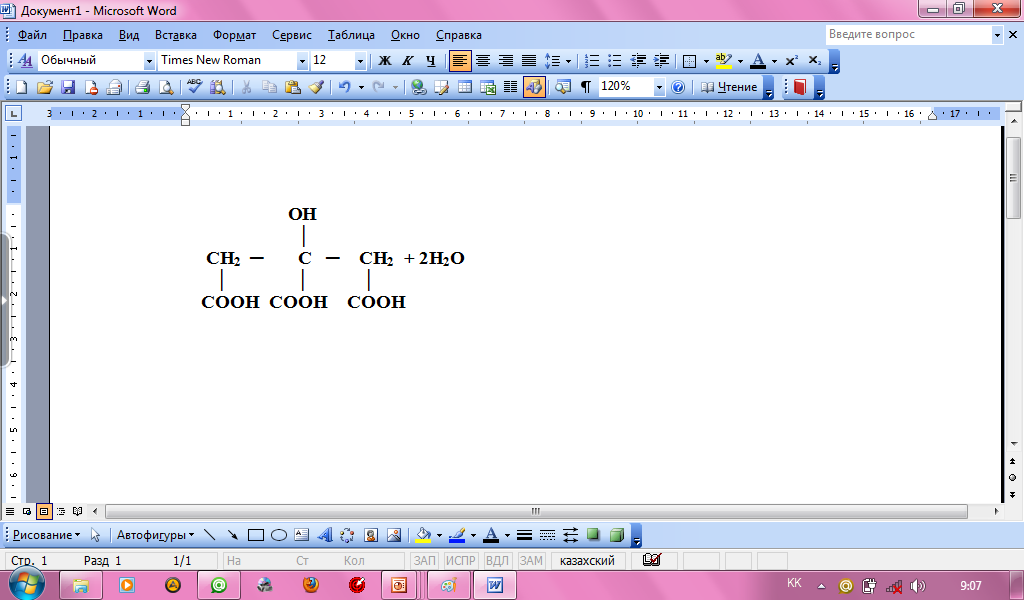
Лимоннокислое

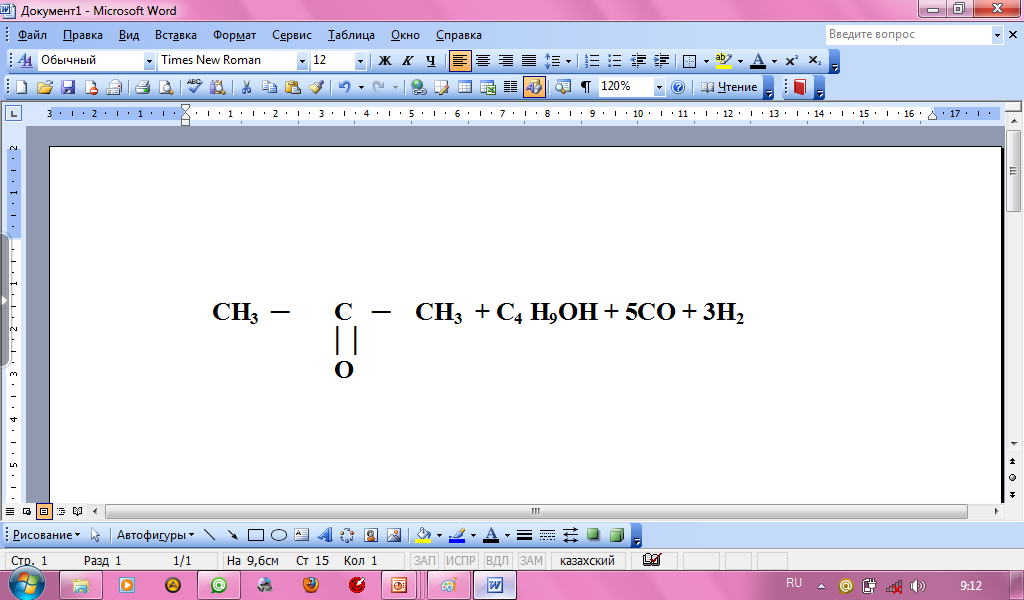
Ацетонобутиловое

(из 2 молекул глюкозы)
1. Приготовление спирта, пива, вина, выпечки хлеба
2. Красное вино, квашенные овощи. Все виды молочнокислой продукции (кефир, сыр, ряженка…)
3. Практического применения не имеет.
4. Промышленное производство лимонной кислоты (плазма, для переливания крови, в качестве противопоказания при отравлении щелочами, а в виде соли железа – как препарат для повышения гемоглобина).
4) Вступает в реакцию образуя сложный эфир.
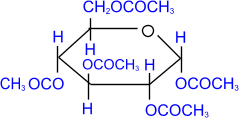
- пентаацетил – глюкоза
5) В 1915 году немецкие химики Рупп и Гольце показали, что глюкоза взаимодействует с синильной кислотой и цианидами с образованием нетоксичного соединения циангидрина глюкозы:
CH2OH-(CHOH)4-COH +НСN = CH2OH-(CHOH)4-CH(OH)(CN)
Считают, что это обстоятельство было причиной неудачной попытки отравить Распутина в 1916 г. в доме Юсупова. В. Пикуль роман-газета «Нечистая сила» 1991 г. №3 стр. 53
6) Окисление глюкозы кислородом воздуха (глюкоза, лаон, 1%-р-р метиленового синего, плоскодонная колба500 мл) (изменение цвета)
7) Взаимодействие глюкозы с Сu(ОН)2 в щелочной среде при обычной температуре приводит к образованию сахарата меди -вещества синего цвета.

 O
O
С
 6Н7О(ОН)5 + Cu(OH)2 →C6H7O(OH)3 Cu + 2H2О
6Н7О(ОН)5 + Cu(OH)2 →C6H7O(OH)3 Cu + 2H2О
O
Эта реакция используется для обнаружения сахара в моче.
4)НАХОЖДЕНИЕ
Глюкоза содержится в живых организмах, как в свободном виде, так и в виде эфиров фосфорной кислоты.
Глюкоза встречается практически в каждой клетки растительных и живых организмов.
Г люкоза называемая виноградным сахаром среди моносахаридов по своей распространенности в природе, по важному биохимическому
люкоза называемая виноградным сахаром среди моносахаридов по своей распространенности в природе, по важному биохимическому
значению занимает особое место.
5)ПОЛУЧЕНИЕ
-
Универсальная реакция в природе
6СО2 + 6Н2О → 6О2 + углеводы (С6Н12О6)
2) Из крахмала → глюкоза
(С6Н12О5)n + nН2О nC6H12O6
(рус.химик К.С. Кирхгоф 1811 г.)
О
//
3) 6H ─ С → С6Н12О6
\
Н
Метаналь (рус.химик А.М. Бутлеров 1861 г.)
Виноградный сахар получают из винограда. Химический состав виноградного сахара С6 Н12 О6 (его еще называют глюкозой), и получают его в наши дни почти исключительно из картофеля и кукурузы. Конечно же, глюкоза имеется в винограде, так же, как и в других фруктах, в пчелином меде, в различных растениях, но не в таком количестве, чтобы имело смысл ее промышленное получение.
Глюкоза была впервые получена в 1811 году русским химиком К.С. Кирхгофом при гидролизе крахмала.
6)ПРИМЕНЕНИЕ
1. В медицине как питательное вещество и компонент кровозаменяющих и противошоковых жидкостей , для консервации крови.
2. В пищевой промышленности, в производстве витамина аскорбиновой и глюконовой кислот, биотина, лечебных средств (гепарин, витамин В15, стрептомицин)
3. Брожение глюкозы, содержащейся в соке винограда и фруктов – одна из стадий в производстве вина.
4. Глюкоза применяется при отделки тканей, в производстве зеркал, в кондитерском производстве.
Мышечная работа совершается главным образом за счет энергии, выделяющейся при окислении глюкозы (31% энергии, освобождающейся при расщеплении глюкозы до молочной кислоты, запасается в виде АТФ…)
При сжигании одного моля глюкозы в одну стадию выделяется 2881,2 КДж
С6 Н12 О6 + 6О2 → 6СО2 + 6Н2О + 2881,2 КДж
III ФОРМИРОВНАИЕ УМЕНИЙ И НАВЫКОВ
(ЗАКРЕПЛЕНИЕ)
-
Сколько разных форм глюкозы вам известно? (3)
-
Каково строение глюкозы в твердом виде? (циклическая)
-
Что происходит с ней при растворении в воде? В растворе существует одна форма строения глюкозы или несколько? (3)
-
Какие функциональные группы входят в состав глюкозы, карбонильная, карбоксильная, сложно эфирная?
-
Могут ли все формы глюкозы реагировать одновременно? (Нет, т.к.формы глюкозы отличаются своим строением)
-
Сохраняет ли продукт восстановления глюкозы особенность давать реакцию серебряного зеркала или нет? (нет т.к. отсутствует альдегидная группа)
-
Экспериментальная задача:
Проведите реакции, доказывающие, что изюм или спелое яблоко содержит глюкозу. Отметьте признаки и запишите уравнения химических реакций.
8. Человек за сутки выдыхает ( в среднем) 1,2 кг СО2. Сколько молей глюкозы может произвести при фотосинтезе растение из этого СО2? (V = 4,55 моль, m = 819 грамм).
IV ДОМАШНЕЕ ЗАДАНИЕ
КОМПЕТЕНТНОСТНО-ОРИЕНТИРОВАННОЕ ЗАДАНИЕ
1 ) Для превращения одной молекулы СО2 в глюкозу при фотосинтезе, идущем по схеме 6СО2 + 6Н2О hv C6Н12О6 + 6О2 затрачивается в среднем 12 квантов оранжево – красного света. Какое количество этих квантов затрачивается на получение 1 кг. глюкозы? Ответ: 24*1025 квантов
) Для превращения одной молекулы СО2 в глюкозу при фотосинтезе, идущем по схеме 6СО2 + 6Н2О hv C6Н12О6 + 6О2 затрачивается в среднем 12 квантов оранжево – красного света. Какое количество этих квантов затрачивается на получение 1 кг. глюкозы? Ответ: 24*1025 квантов
2) Почему при длительном жевании хлеба появляется во рту сладковатый вкус?
3)Параграф 11,11.1
Здесь представлен конспект к уроку на тему «Углеводы. Глюкоза. C6H12O6; С11 (Н2О) m.Строение, свойства, применение», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

