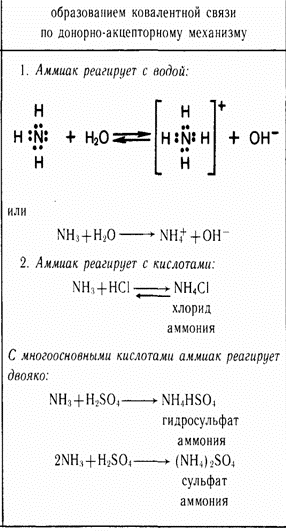
Конспект урока «Аммиак. Физические и химические свойства аммиака, получение, применение» по химии
Дата_____________ Класс_______________
Тема: Аммиак. Физические и химические свойства аммиака, получение, применение.
Цели урока: знать строение молекулы аммиака, физические и химические свойства, области применения; уметь доказывать химические свойства аммиака: записывать уравнения реакций аммиака с кислородом, водой, кислотами и рассматривать их с точки зрения теории электролитической диссоциации и окислительно-восстановительных процессов.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.
Аммиак – NH3
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы
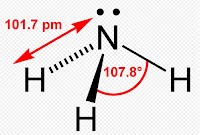
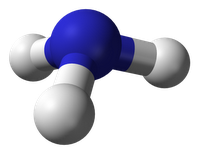
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
2. Физические свойства аммиака
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
| В промышленности | |
| Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O (NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O Внимание! Гидроксид аммония неустойчивое основание, разлагается:NH4OH ↔ NH3↑ + H2O При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:
| Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж Условия: катализатор – пористое железо температура – 450 – 500 ˚С давление – 25 – 30 МПа Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода). |
4. Химические свойства аммиака
Для аммиака характерны реакции:
-
с изменением степени окисления атома азота (реакции окисления)
-
без изменения степени окисления атома азота (присоединение)
| с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O |
| с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O
|
| с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
|
| аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2
|
5. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH3. Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон, например, нейлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка. В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
3. Закрепление изученного материала
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
4. Домашнее задание
П. 17, упр.6-11, задача 1 на стр.52
Здесь представлен конспект к уроку на тему «Аммиак. Физические и химические свойства аммиака, получение, применение», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.