Конспект урока «методическая разработка урока по химии»
Муниципальное бюджетное общеобразовательное учреждение
« Средняя общеобразовательная школа села Алексеевка »
Базарно – Карабулакского района Саратовской области
Конспект урока по химии
в 9 классе
«Роль металлов в Великой Отечественной войне»
подготовила
учитель биологии и химии
Николаева Светлана Владимировна
2013
Роль металлов в Великой Отечественной войне .
9 класс
Тип урока: комбинированный
Форма проведения: урок - исследование
Цели: активизация мыслительной деятельности учащихся, вовлечение учащихся в процесс подготовки к уроку, используя краеведческий материал, расширение кругозора детей, развитие умений работы в коллективе.
Задачи:
Образовательная: углубить и систематизировать знания о физических свойствах металлов, о месторождениях металлосодержащих руд и выявить значение металлов для победы в Великой Отечественной войне, познакомить учащихся с достижениями советских химиков в годы второй мировой войны.
Развивающая: продолжить формировать умения проводить параллели между различными областями наук; развивать познавательный интерес к предмету, реализуя межпредметные связи курсов химии, истории, литературы, географии, развивать навыки работы с картой, дополнительной литературой; анализировать, логически мыслить, собирать информацию, способствовать тренировке памяти.
Воспитательная: Воспитывать в учащихся чувство патриотизма, преданности и любви к своей Родине, уважительное отношение к ветеранам войны и тыла, способствовать воспитанию чувства гордости за самоотверженный труд учёных в годы войны, показать и подтвердить значение химических знаний для жизни.
Оборудование: магнитофон, модели кристаллических решеток металлов, образцы металлов, коллекции руд, минералов и горных пород, видеофильмы, таблицы, справочно – информационный стенд, физическая карта России, опорный конспект, компьютер, мультимедийный проектор, реактивы для демонстрации опытов (см. приложение №1).
Подготовительные мероприятия: учащиеся получили индивидуальные задания - подготовить сообщения: «Химические вещества на страже Роди -ны»(в с. Алексеевка)
Оформление: периодическая таблица Д.И.Менделеева, плакат с высказыванием академика В.Л. Комарова «Защита Родины, изгнание врагов из её пределов есть защита культуры и прогресса, науки и искусства, света и разума»., рисунки и фотографии оружия, портреты ученых, выставка книг о войне.
План урока:
-
Организационный момент. Начало урока:
сообщение темы, задач, плана работы – мотивация (к 68- летию Победы)
2. Основная часть – формирование новых знаний
-
Вступительное слово учителя
-
Ориентировочно – мотивационный этап (основные понятия, подготовка к активной учебно – познавательной деятельности). В исследовании каждой из групп учителем созданы проблемные ситуации или поставлены проблемные вопросы.
-
Проблемно – поисковый этап (работа в группах, самостоятельное приобретение знаний учащимися).
-
Этап рефлексии (презентация полученных результатов)
-
Демонстрационный этап
3.Закрепление знаний – викторина «Металлы тоже воевали»
4. Итоги. Выводы.
5. Домашнее задание (дифференцированное).
Ход урока.
Пейзажи мирной жизни…(песня «Широка страна моя родная» стихи В. Лебедева – Кумача, музыка И.Дунаевского) 
Учитель: Великая Победа! Она была необходима человечеству, чтобы сохранить на земле жизнь, и поэтому память о годах войны вечна, как сама жизнь! Время – это река, где наши жизни – только молекулы воды. И сколько бы времени не прошло с начала Великой Отечественной войны, мы должны помнить о том, что Великая Отечественная война была смертельным противоборством не только оружия и терпения, не только идей и стратегий. Это было сражение производств, экономик и наук. Вместе с солдатами в сорок пятом победили рабочие и мастера, инженеры, доктора наук, военные медики и сугубо гражданские химики.
Девизом нашего урока я взяла слова А.С. Пушкина:
«УВАЖЕНИЕ К МИНУВШЕМУ – ВОТ ЧЕРТА,
ОТЛИЧАЮЩАЯ ОБРАЗОВАННОСТЬ ОТ ДИКОСТИ».
Вдумайтесь! Пять суровых и жестоких лет войны. За эти годы промышленность дала армии:
-
миллионы винтовок, миллионы пулеметов;
-
сотни тысяч танков и самоходных орудий, самолетов.
Миллионы. Миллионы. Миллионы…
Задумайтесь над этими цифрами – за ними небывалый в истории трудовой подвиг народа.
На фронтах Отечественной войны сражались десятки тысяч представителей науки, проявляя мужество, стойкость и преданность Родине.
«Война потребовала грандиозных количеств стратегического сырья…бесконечное разнообразие различных химических веществ, начиная со сплавов и кончая сложными продуктами переработки нефти, угля и пластмассами, - всё это сейчас требуется в громадных количествах.… Только шесть химических элементов не нашли себе применения в военной технике…»- писал в те годы Александр Евгеньевич Ферсман.
В годы войны были открыты месторождения марганцевых руд, к северу от озера Балхаш найдены жилы с кварцем и молибденом; среди безводных хребтов Казахстана – чёрные угольные породы, богатые ванадием; в Казахстане открыты источники редких металлов – лития, молибдена, ванадия. Были открыты месторождения огнеупоров, кварцевых песков, глин, каолинов, графитов, кобальта, ниобия, алюминиевых руд, так необходимых для чёрной и цветной металлургии.
Война требовала скорейшего внедрения научных достижений в производство. Учёные разрабатывали новые виды боеприпасов, горючего, военной техники. Свою работу в лабораториях учёные рассматривали как боевое задание фронта.
…У каждого была своя война,
Свой путь вперёд,
Свои участки боя,
И каждый был
Во всём самим собой,
И только цель
У всех была одна. ( М. Алигер)
-В годы Великой Отечественной войны ярко проявился патриотизм ученых нашей страны, и они сплотили все силы для защиты человеческой культуры от фашизма.
В связи с эвакуацией промышленных предприятий в восточные районы страны, потребовалась перестройка всей экономики этих районов. Для победы необходимы были новые сырьевые ресурсы, в частности – металлы. Ребята, сегодня мы должны собрать всю информацию, которую знаем про металлы, в единое целое. Должны обсудить их свойства, месторождения и понять, каково значение химических элементов-металлов в истории Великой Отечественной войны, как помогали металлы ковать победу над фашистской Германией.
Металлов много есть, но дело не в количестве:
В команде работящей металлической,
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов,
Пред египтянином, китайцем, древним греком
И каждым современным человеком.
Самостоятельное изучение теоретического материала (работа в группах)
Класс разбивается на шесть творческих групп (отделов).
-
Отдел исследования физических свойств металлов.
-
Месторождения металлов и положение их в Периодической системе.
-
«Поиск»
-
«Металлы тоже ковали Победу»
-
Информационный отдел
-
Демонстрационный отдел
Отчёт учащихся по полученным заданиям:
Задания группам содержатся в инструктивных карточках, доступны и по сложности соответствуют составу групп. Необходимый теоретический материал раздаётся учащимся (см.приложения). После изучения материала они проводят обсуждение (в группе) – осмысливают содержание, выбирают самое главное, затем выступают по своей теме, проводят эксперимент, отвечают на вопросы.
В ходе обсуждения физических свойств, учащиеся обращаются к образцам металлов на демонстрационном столе, плакатам, моделям кристаллических решеток, к информации на опорном конспекте (у каждого учащегося на столе).
Демонстрация фрагмента видео «Общие свойства металлов» (из ЭМК по химии 9 кл.) – приложение № 9
Демонстрация через проектор:
Штурмовик ИЛ-2. СССР |
Вопрос учителя: «О каком металле идет речь?»
Учитель начинает, корректирует, направляет, ученики из группы «Поиск» и «Металлы тоже воевали» дополняют своим материалом.
Учитель. Немцы разрушили в СССР почти 32000 промышленных предприятий, 4100 железнодорожных станций, 40000 больниц, 84000 школ, техникумов и ВУЗов, 43000 библиотек. Полностью или частично разрушено и сожжено 1710 городов и более 70000 сел и деревень…
Враг сеял смерть…
В разрывах даль…
Страна пожарами объята…
В сердцах и ярость, и печаль…
Но гас огонь и гнулась сталь
О волю русского солдата.
На митинге советских ученых в 1941 году академик А.Е. Ферсман сказал: “Война потребовала грандиозного количества основных видов стратегического сырья. Потребовался целый ряд новых металлов для авиации, бронебойной стали; магний, стронций для осветительных ракет и факелов; больше йода и самых разнообразных веществ. Необходимо было своими знаниями создать лучшие танки, самолеты, чтобы скорее освободить все народы от нашествия гитлеровской банды, чтобы снова наука могла спокойно заниматься своим мирным трудом, чтобы она могла поставить на службу человечеству всю сумму природных богатств, положить всю менделеевскую таблицу к ногам освобожденного и радостного человечества”.
Выпуск химической продукции к концу войны приблизился к довоенному уровню, а в 1945 году он достиг 92% от уровня 1940 года.
Учитель : И, конечно же, Великая победа это заслуга не только металлов. Не нужно забывать людей, которые впервые применили эти металлы и добились введения в производство изделий из их сплавов.
Проецируется на экран:
Бериллиевая бронза (сплав меди и 1–2,5% Ве с добавками 0,2–0,5% Ni и Со) используется в самолетостроении. А сплав Ве, Mg, Al, Ti необходим в создании ракет и скорострельных авиационных пулеметов, впервые примененных в годы войны.
На основе Mg и Al изготовлялись прочные и сверхлегкие сплавы для самолетостроения.
Сплав титана (до 88%) с другими металлами идет на изготовление танковой брони. В 1943 г. Гитлер издал приказ вступать в бой с советскими танками ИС-3 на расстоянии не более 1 км. Состав брони у этого танка был такой, что его не могли пробить фашистские снаряды. Титан применяют также в радиотехнике.
Хромовые стали нужны для изготовления огнестрельных орудий, корпусов подводных лодок.
Более 90% всех металлов, которые использовались в Великой Отечественной войне, приходилось на железо. Fe – главная составляющая часть чугунов и сталей.
Кобальтовая сталь использовалась для изготовления магнитных мин.
Дульнозарядный миномет и мина |
Сплав Cu (90%) и Sn (10%) – пушечный металл. Сплав Cu (68%) и Zn (32%) – латунь – использовали для изготовления артиллерийских снарядов и патронов.
Без германия не было бы радиолокаторов.
Тантал – важнейший стратегический материл для изготовления радарных установок, передаточных радиостанций.
Из вольфрамовых сталей и сплавов изготавливают танковую броню, оболочки торпед и снарядов.
Учитель:
Советские ученые внесли свой вклад в победу над фашистской Германией. Ученые-химики создавали новые способы производства взрывчатых веществ, топлива для реактивных снарядов “Катюш”, высокооктановых бензинов, каучука, материалов для изготовления броневой стали, легких сплавов для авиации, лекарственных препаратов.
Это химики Александр Евгеньевич Ферсман, Александр Николаевич Несмеянов, Николай Дмитриевич Зелинский и другие. (Демонстрация фотографий ученых – см. приложение № 10)
- Наконец пришла долгожданная Победа. Через 5 лет изнурительной борьбы. Мы склоняем головы перед светлой памятью о тех, кто не вернулся с войны. Памяти химиков–фронтовиков посвятил свое стихотворение старший преподаватель ДХТИ, бывший фронтовик З.И. Барсуков:
Кто про химика сказал: “Мало воевал”,
Кто сказал: “Он мало крови проливал?”
Я в свидетели зову химиков–друзей, -
Тех, кто смело бил врага до последних дней,
Тех, кто с армией родной шел в одном строю,
Тех, кто грудью защитил Родину мою.
Сколько пройдено дорог, фронтовых путей…
Сколько полегло на них молодых парней…
Не померкнет никогда память о войне,
Слава химикам живым, павшим - честь вдвойне.
Ребята, сейчас мы совершим с вами экскурсию в прошлое. Вы готовили к уроку краеведческий материал «Химические вещества на страже Родины». Вам слово.
Выступление учащихся из информационного отдела.
При подготовке к уроку они встречались с ветеранами войны, тружениками тыла с. Алексеевка, собрали материал для сообщений по данной теме:
В годы войны в Алексеевке «валяли» валенки (использование серной кислоты) и отправляли их на фронт; также было налажено производство поташа – карбоната калия (для мыла). Эта территория в селе, где был цех, до сих пор называется местными жителями – «поташка».
Демонстрация презентации (см. приложение № 8)
Хотелось бы надеяться, что мощь этой прекрасной науки – химии – будет направлена не на создание новых видов оружия, не на разработку новых отравляющих веществ, а на решение глобальных общечеловеческих проблем.
Завершаем урок мы символическим салютом в честь тех, кто ковал победу на полях сражений и в тылу. (Звучит песня “День Победы” – фоном).
Учащиеся из «демонстрационного» отдела показывают опыт “салют”. (Приложение 1))
В конце урока предлагается викторина “Металлы тоже воевали” (Приложение 2)
Как видите, ребята, Великая Победа, была достигнута всеобщими усилиями героического советского народа и не последнюю роль в ней сыграли ученые, химики, металлурги, конструкторы.
Так не забудь их подвигов, товарищ!
Склонись к подножью в скорбной тишине
Они за землю, за тебя сражались,
Живи за них, дыши за них вдвойне!
Подведение итогов работы на уроке (положительную оценку получает каждый ученик).
Выводы.
Сегодня на уроке мы с вами охватили только часть материала о великой роли химии, в том числе металлов для победы в Великой Отечественной войне. Немаловажную роль в исходе войны сыграли не столько сами металлы, сколько знания людей об их свойствах, применении этих свойств на практике. Это ещё раз доказывает огромную важность и значимость химических знаний для жизни, ведь химия по сути своей это и есть – жизнь. И только от людей зависит, будет она разрушать или созидать.
Д/З: параграф №6, с.29-32; №2 на «3», на «4» №4 с.25, на «5» индив.зад. – см. приложение №7 (без реакций) – написать соответствующие реакции и расставить коэффициенты.
Выполнение учащимися заданий на закрепление новых знаний в рабочей тетради к учебнику О.С. Габриеляна: «химия 9 класс».
На «3» -№ 1 с.26, на «4» - №4 с.24, на «5» - №7 с. 27.
Приложение №1
Опыт «Салют»
Оборудование: железный тигель, штатив с кольцом, фарфоровый треугольник, спиртовка, лист бумаги, стеклянная палочка, порошки железа и древесного угля, сухой мелкокристаллический перманганат калия.
На чистом листе бумаги (или на стекле) тщательно смешиваем стеклянной палочкой или шпателем равные количества (примерно по 1-2 чайной ложки) порошков железа, древесного угля и перманганата калия. Полученную смесь переносим в железный тигель, закрепленный в фарфоровом треугольнике, который находится на кольце штатива. Нагреваем тигель в пламени спиртовки. Через некоторое время из тигля начинают разлетаться раскаленные частички железа в виде снопа искр. С появлением искр спиртовку следует поставить. (Опыт эффективнее проводить в затемненном помещении).
Опыт «фейерверк»: жёлтый цвет – бертолетова соль 2г, 1г серы, 1г безводной соды; зелёный цвет – 3,5 г бертолетовой соли, 1 г серы, 1,5 г карбоната бария; красный цвет – 2 г бертолетовой соли, 5,5 г серы, 0,5 г угля (в порошке) и 17 г нитрата стронция.
Опыт «Салют -2»: в чистые фарфоровые чашки наливаем по 5 мл этилового спирта. В спирт добавляем по 1 г мелкорастёртых хлоридов натрия, калия, лития, бария. Смеси поджигаем. Гамму цветов можно разнообразить, используя другие соли.
Приложение №2
Вопросы группе «Месторождения металлов …»:
Что называют металлами?
Металлами называют вещества с определенным набором физических и химических свойств. Понятия “металл” применяют к двум разным объектам: к химическому веществу и химическому элементу.
В каком виде встречаются металлы в природе?
(В виде руд, в самородном виде.) В свободном состоянии в природе встречаются только некоторые металлы: золото, платина, палладий, родий. Большинство металлов встречаются в природе в виде соединений: оксидов, сульфидов, хлоридов, сульфатов и т.д
- Приведите примеры руд, содержащих металлы (Хромовые -1, железная-2, марганцовая-3, никелевая-4, вольфрамовая-5, молибденовая-6, оловянная-7, алюминиевая-8, медная-9, ртутная-10.)
- Приведите пример металла, встречающегося в самородном виде, и найдите соответствие с условными знаками на доске. (Золото – 11.)
- Какие месторождения металлосодержащих руд были выявлены за годы Великой Отечественной войны?
На физической карте России отмечают условными знаками месторождения полезных ископаемых, работа с коллекциями.
-
Оловянные месторождения на Дальнем Востоке.
-
Свинцовые – в Средней Азии.
-
Вольфрамовые – в Кузнецком Алатау и на Алтае, в Средне Азии.
-
Медные – на Среднем Урале.
-
Молибден – к северу от озера Балхаш.
-
Источники редких металлов – лития, молибдена, ванадия – Казахстан.
-
Руды кобальта, необия, алюминиевые – Уральские горы.
- Ведение войны требовало повышенного расхода алюминия. Поиски алюминиевого сырья на Урале возглавил академик Д.В. Наливкин. На северном Урале были обнаружены большие запасы высокосортных бокситов. В 1944 году в восточном Казахстане академиком В.А. Кузнецовым было открыто месторождение ниобий – танталовых руд.
- Таким образом, мы выяснили, что наша страна богата месторождениями металлосодержащих руд. И этот фактор сыграл огромную роль в победе русской армии над фашистской Германией.
Положение металлов в Периодической системе? (С использованием справочно-информационного стенда).
Первая, вторая и третья группы периодической системы Менделеева целиком состоят из металлов (кроме водорода и бора), а также побочные подгруппы остальных групп заняты металлами. Металлы во внешнем электронном слое имеют 1-3 электрона и легко отдают их, проявляя при этом восстановительные свойства. Чистые металлы в твердом состоянии – это кристаллы, в которых частицы вещества расположены в определенном геометрическом порядке, образуя кристаллическую решетку, в углах которой находятся положительно заряженные ионы, а между ними перемещаются свободные электроны. Существование свободных электронов в металлах подтверждается следующими фактами:
-
металлы обладают большой электрической проводимостью;
-
при нагревании все металлы испускают поток свободных электронов.
Кристаллические решетки большинства металлов имеют геометрическую форму куба или шестигранной призмы. Расположение атомов в кристаллической решетке оказывает большое влияние на свойства металлов: физические, механические, химические.
В парообразном состоянии металлы одноатомны. В технике металлы делят на следующие группы: черные, цветные, редкие и драгоценные.
Приложение №3
Для группы «Физические свойства металлов».
- Почти все химические элементы таблицы Д.И.Менделеева принесли пользу Родине. Немаловажна роль металлов.
- Физические свойства металлов
Наиболее важными физическими свойствами металлов являются тепло- и электропроводимость. Характерной особенностью металлов является металлический блеск, что связано с их способностью отражать свет. Все металлы, кроме ртути, при обычной температуре твердые вещества.
Характерные свойства металлов – ковкость и тягучесть. Наибольшей ковкостью обладают золото, серебро, медь, а наименьшей – марганец.
По температуре плавления металлы сильно отличаются друг от друга: температура плавления ртути – 39о С, температура плавления вольфрама – 3370о С.
1. Агрегатное состояние. В основном, все твердые вещества, имеют металлическую кристаллическую решетку. Исключение, ртуть – жидкая.
2. Температуры кипения и плавления разнообразны. Температура плавления ртути – 39 градусов Цельсия, галлия – 29,8 (плавится в руках), у цезия – 28, вольфрам – 3390 градусов Цельсия, это самый тугоплавкий металл, используется в нитях электроламп.
3. Твердость. Самые мягкие – щелочные металлы и свинец, режутся ножом. Самый твердый – хром, царапает стекло.
4. Плотность. Литий – самый легкий металл, осмий – самый тяжелый. Плотность легких металлов ниже 5 г/см.куб, тяжелых – больше 5.
5. Электропроводность и теплопроводность. Благодаря свободным электронам, в кристаллической решетке металлы проводят электрический ток. Самые лучшие проводники – серебро, медь, золото, алюминий, железо. Худшие проводники – ртуть, свинец, вольфрам. Теплопроводность соответствует электропроводности.
6. Ковкость, пластичность, прочность. При механическом воздействии происходит смещение слоев атомов, благодаря свободным электронам, разрыва связей не происходит. Высокая пластичность у золота, серебра, меди, олова, железа, алюминия.
7. Металлический блеск, серый цвет, непрозрачность.
Приложение № 4.
Теоретический материал для группы «Поиск»
Алюминий. Химический знак Al (алюминий). Алюминий – серебристо-белый металл, легкий, пластичный, с высокой электропроводимостью. Химически активен (на воздухе покрывается защитной пленкой). По распространенности в природе занимает 3-е место среди элементов и 1-е среди металлов.
Положение в периодической системе: 3 период, 3 группа, главная подгруппа, р - элемент.
«Крылатый металл» алюминий в виде сплавов с Mg, Mn, Be, Na, Si использовался в самолетостроении для обшивки самолетов, изготовления лопастей винтов. Из сплава алюминия, меди и марганца делали корпуса судов на подводных крыльях, баки для хранения и перевозки сжиженного газа. Тончайший алюминиевый порошок использовали для получения горючих и взрывчатых смесей.
. Начинка зажигательных бомб состояла из смеси порошков алюминия, магния и оксида железа, детонатором служила гремучая ртуть. При ударе бомбы о крышу срабатывал детонатор, воспламеняющий зажигательный состав, и все вокруг начинало гореть. Горящий зажигательный состав нельзя потушить водой, так как раскаленный магний реагирует с ней. Поэтому для тушения огня применяли песок. Алюминий использовали для активной защиты самолетов. Так, при отражении налетов авиации на Гамбург операторы немецких радиолокационных станций обнаружили на экранах приборов неожиданные помехи, которые делали невозможным распознавание сигналов от приближающихся самолетов. Помехи были вызваны лентами из алюминиевой фольги, которые сбрасывали самолеты союзников. При налетах на Германию было сброшено примерно 20 тысяч тонн алюминиевой фольги.
В годы войны был разработан В.Г. Головкиным непрерывный способ производства литой алюминиевой проволоки диаметром до 9 мм. Потребность в ней была громадной. Каждому, кто летал на самолете, приходилось видеть бесконечные ряды заклепок на крыльях и фюзеляже. Но, видимо, далеко не все знают, что число этих заклепок на истребителе военного времени доходило до 100 –200 тысяч штук, а на бомбардировщике – даже до миллиона…
В декабре 1944 года на окраине небольшого польского городка органами советской контрразведки была задержана подозрительная женщина, которая “теряла” у колонны машин с боеприпасами “автоматические ручки”. При проверке было установлено, что это диверсионное зажигательное средство со сложным воспламенителем, с корпусом из сплава, имеющего в основе алюминий. Из этого сплава изготавливали и корпуса зажигательных бомб. Алюминиевые соли органических кислот составляют основу “напалма”, применявшегося американскими войсками в войне с Южным Вьетнамом, португальскими колонизаторами в Анголе. Так алюминий был поставлен на службу войне.
Ванадий. Химический знак V (ванадий). № 23. Ванадий называют “автомобильным” металлом. Ванадиевая сталь дала возможность облегчить автомобили, сделать новые машины прочнее, улучшить их ходовые качества. Из этой стали изготовляют солдатские каски, шлемы, броневые плиты на пушках. Хромованадиевая сталь еще прочнее. Поэтому ее стали применять широко в военной технике: для изготовления коленчатых валов корабельных двигателей, отдельных деталей торпед, авиамоторов, бронебойных снарядов.
Положение в периодической системе: 4 период, четный ряд, 5 группа, побочная подгруппа, d-элемент.
Литий. Химический знак Li (литий).
Положение в периодической системе: 2 период, 1 группа, главная подгруппа, s-элемент.
В годы Великой Отечественной войны гидрид лития стал стратегическим сырьем. Он бурно реагирует с водой, при этом выделяется большой объем водорода, которым заполняли аэростаты и спасательное снаряжение при авариях самолетов и судов в открытом море. Добавка гидроксида лития в щелочные аккумуляторы увеличивала срок их службы в 2 - 3 раза, что было ценно для партизанских отрядов. Трассирующие пули с добавкой лития при полете оставляли сине - зеленый след. Соединения лития использовались и на подводных лодках для очистки воздуха.
Лантан. Химический знак La (лантан).
Положение в периодической системе: 6 период, четный ряд, 3 группа, побочная подгруппа, d-элемент.
Сплав лантана, церия и железа дает так называемый кремень, который использовался в солдатских зажигалках. Из него же изготовляли специальные артиллерийские снаряды, которые во время полета при трении о воздух искрят (можно наблюдать за их ночным полетом). Лантановые стекла применяли в полевых оптических приборах.
Цинк. Химический знак Zn (цинк).
Положение в периодической системе: 4 период, нечетный ряд, 2 группа, побочная подгруппа, d-элемент.
Сплав меди и цинка - латунь - хорошо обрабатывается давлением и имеет высокую вязкость, его использовали для изготовления гильз патронов и артиллерийских снарядов. Более половины добываемого цинка расходовалось на изготовление оцинкованного железа и оцинкованной проволоки. Сплавы баббит и гарт использовались в полиграфии, в частности для изготовления листовок и газет на оккупированной территории.
Вольфрам. Химический знак W (вольфрам).
Положение в периодической системе: 6 период, четный ряд, 6 группа, побочная подгруппа, d-элемент.
Вольфрам относится к числу самых ценных стратегических материалов. Из вольфрамовых сталей и сплавов изготавливают танковую броню, оболочку торпед и снарядов, наиболее важные детали самолетов и двигатели.
Германий. Химический знак Ge (германий).
Положение в периодической системе: 4 период, нечетный ряд, 4 группа, главная подгруппа, p-элемент.
Без германия не было бы радиолокаторов. В начале Великой Отечественной войны на основе свойства германия превращать тепловую энергию в электрическую советские ученые создали генераторы для питания раций партизанских отрядов.
Свинец. № 82 Химический знак Pb (плюмбум).
Свинец - синевато-серый металл, тяжелый, мягкий, ковкий. На воздухе покрывается оксидной пленкой, стойкой к химическим воздействиям. Используют для изготовления пластин для аккумуляторов, оболочек электрических кабелей, защиты от гамма-излучения, как компонент типографских и антифрикционных сплавов, полу проводных материалов.
Положение в периодической системе: 6 период, нечетный ряд, 4 группа, главная подгруппа, р – элемент.
С изобретением огнестрельного оружия на изготовление пуль для ружей, пистолетов и картечи для артиллерии стали расходовать много свинца. Свинец – тяжелый металл, его плотность 11,34. Именно это обстоятельство послужило причиной массового использования свинца в огнестрельном оружии. Свинцовыми метательными снарядами пользовались еще в древности: пращники армии Ганнибала метали в римлян свинцовые шары. И сейчас пули отливают из свинца, лишь оболочку их делают из других, более твердых металлов. Любая добавка к свинцу увеличивает его твердость, но качественно влияние добавок неравноценно. В свинец, идущий на изготовление шрапнелей, добавляют до 12% сурьмы, а в свинец ружейной дроби – не более 1% мышьяка. Без инициирующих взрывчатых веществ ни одно скорострельное оружие действовать не будет. Среди веществ этого класса преобладают соли тяжелых металлов. Используют, в частности, азид свинца PbN6. Свинец не раз решал исход грандиозных военных баталий, за что его стали называть “смертоносным” металлом. В производстве подшипников для военной техники очень важны сплавы свинца – баббиты, свинцовые бронзы.
Медь, №29
Химический знак Сu (купрум).
Положение в периодической системе: 4 период, нечетный ряд, 1 группа, побочная подгруппа, s-элемент.
Медь – металл красного (в изломе розового) цвета, ковкий и мягкий, хороший проводник тепла и электричества. Медь химически малоактивна, в атмосфере, содержащей углекислый газ, пары воды и др. покрывается патиной – зеленоватой пленкой. Главное применение – производство проводов. Изготавливают также теплообменники, вакуум-аппараты, трубопроводы. Более 30 % меди идет на сплавы.
В годы Великой Отечественной войны главным потребителем меди была военная промышленность. Сплав меди (90%) и олова (10%) – пушечный металл. Гильзы патронов и артиллерийских снарядов обычно желтого цвета. Они сделаны из латуни – сплава меди (68%) с цинком (32 %). Большинство артиллерийских латунных гильз используется неоднократно. В годы войны в любом артиллерийском дивизионе был человек (обычно офицер), ответственный за своевременный сбор стреляных гильз и отправку их на перезарядку. Высокая стойкость против разъедающего действия соленой воды характерна для морских латуней. Это латуни с добавкой олова.
Металлы: олово, цинк и медь - образуют бронзу. Из бронзы во всем мире изготавливают памятники воинам. В Трептов–парке в г. Берлине у памятника воинам Советской Армии, павшим при штурме столицы фашистской Германии, отлиты 5 огромных (до 5 м в диаметре) бронзовых венков, лежащих на братских могилах. Там же, в Мемориальном зале Мавзолея, воинам Советской Армии на постаменте из черного лабрадора в золотом ларце хранится книга с именами героев, павших смертью храбрых при героическом штурме столицы Германии..
Молибден. Химический знак Mo (молибден).
Положение в периодической системе: 5 период, четный ряд, 6 группа, побочная подгруппа, d-элемент.
Молибден называют «военным» металлом, так как 90% его идет на военные нужды. Стали с добавкой молибдена (и других микроэлементов) очень прочны, из них отливали стволы орудий, винтовок, ружей, детали самолетов, автомобилей. Введение в состав сталей молибдена в сочетании с хромом и вольфрамом повышает их твердость, из этих сталей делали танковую броню. Молибденовая сталь прочна, остра, тверда, гибка, из нее делали клинки, сабли, мечи, ножи.
Хром. Химический знак Cr (хром).
Положение в периодической системе: 4 период, четный ряд, 6 группа, побочная подгруппа, d-элемент. Хромовые стали нужны были для изготовления огнестрельных орудий, броневых плит, корпусов подводных лодок, рессор, пружин, шарикоподшипников.
Серебро, № 47. Химический знак Ag (серебро).
Положение в периодической системе: 5 период, нечетный ряд, 1 группа, побочная подгруппа, s-элемент.
. Обеззараживающие свойства серебра и его соединений использовали в медицине, соединения серебра с бромом – в фотографии.
Серебро в сплавах с индием использовалось для изготовления прожекторов (для противовоздушной обороны). Зеркала прожекторов в годы войны помогали обнаружить врага в воздухе, на море и на суше; иногда с помощью прожекторов решались тактические и стратегические задачи. Так, при штурме Берлина войсками Первого Белорусского фронта 143 прожектора огромной светосилы ослепили гитлеровцев в их оборонительной полосе, и это способствовало быстрому исходу операции.
На основе каких свойств было основано применение металлов и их сплавов в Великой Отечественной войне?
Приложение № 5.
Материал для учащихся из группы «Металлы тоже ковали Победу».
Да, для всех нас металлы ассоциируются с прочностью. И этой ассоциацией пользуются писатели и поэты. Например, о человеке с жесткой речью говорят: “С металлом в голосе”, о стойком характере – железный характер. Так давайте поговорим о железе.
Химический знак Fe (феррум)№ 26.
Положение в периодической системе: 4 период, четный ряд, 8 группа, побочная подгруппа, d-элемент.
Железо представляет собой блестящий белый металл с синеватым отливом. Железо хорошо намагничивается и размагничивается.
Колоссальная масса железа истрачена на земном шаре в ходе войн. Только за Первую мировую войну было израсходовано не менее 200 млн. тонн стали. За Вторую мировую – примерно 800 млн. тонн. За последние три года войны было произведено 660 тыс. тонн орудий, 1 млн. 350 тыс. ручных и станковых пулеметов, около 6 млн. автоматов. На железо приходится более 90 % всех использованных металлов. Сколько этого металла было выброшено в снарядах, бомбах, минах, гранатах! Чтобы судить о масштабах расхода железа в Великой Отечественной войне, назовем одно число: миллион бомб сбросили фашисты на Сталинград!
Сплавы железа в виде броневых плит и литья толщиной 10-100 мм использовались при изготовлении корпусов и башен танков, бронеавтомобилей, самоходных артиллерийских установок, бронепоездов. Толщина брони военных кораблей и установок береговой обороны доходит до 50 мм. Ответственные узлы боевых самолетов тоже защищает броня.
Железо занимает 5 место по распространенности в земной коре. На его долю приходится 1,5 % от общего числа атомов земной коры. Железо присутствует всегда в растениях и животных организмах. Одной из важнейших функций железа в организме человека является связывание молекулярного кислорода и перенос его в ткани. Химически чистое железо получают из оксида железа водородом или электролизом водных растворов солей железа.
В таблице Менделеева трудно найти какой-либо иной элемент, с которым так неразрывно связалась бы жизнь всего человечества. Нет другого элемента, при участии которого проливалось бы так много крови, терялось бы столько жизней, происходило бы столько несчастий. Как сказал А. Блок:
Век девятнадцатый железный,
Воистину железный век,
Тобою в мрак ночной, беззвездный
Беспечный брошен человек.
“Железные рудники доставляют человеку превосходнейшее и зловреднейшее орудие. Ибо этим орудием вспахиваем мы землю, сажаем кустарники, обрабатываем дикие лозы с виноградом, понуждаем их каждый год молодеть. Этим орудием выстраиваем дома, разбиваем камни и употребляем железо на все подобные подробности.
Но тем же самым железом производим битвы и грабежи и употребляем его не только вблизи, но и посылаем окрыленное вдаль, то из бойниц, то из мощных рук, то в виде оперенных стрел. Самое порочное ухищрение ума человеческого, ибо, чтобы смерть поскорее настигла человека, сделали ее крылатою и железу придали перья. Того ради да будет вина приписана человеку, а не природе.” А ведь героя произведения испугало совсем уж безобидное, на наш взгляд, оружие – мечи, копья, стрелы. Чтобы он сказал, если бы увидел современные пушки и пулеметы, танки и крейсеры. Да, железо – прочный металл, но еще крепче сплав железа с углеродом, который называется сталью.
“В бою железо дороже золота” - гласит татарская пословица. И русские говорили: “При рати железо дороже золота. Железом и золото добуду”. Железо являлось основным металлом, из которого изготовляли многочисленные и разнообразные орудия для истребления людей. Недаром копье и щит, характерные принадлежности бога войны Марса, древние мудрецы сделали символом, обозначающим железо. Оно действительно верно и безотказно служило Марсу.
Более 90% всех металлов, которые использовались в Великой Отечественной войне, приходится на железо. Железо – главная составная часть чугунов и сталей, а по их выплавке судят о мощности государства. Но железо – не только борьба, война, разрушение; железо – металл созидания. Это основа всей металлургии, машиностроения, железнодорожного транспорта, судостроения, грандиозных инженерных сооружений.
Никель – серебристо-белый металл, значащийся в периодической системе Менделеева под №28, тугоплавкий, твердый, не изменяющийся на воздухе, - был такой же сложной проблемой для Германии, как горючее, а может, и сложней. Ведь горючее из нефти можно хоть чем-то заменить. Никель же незаменим. Без никеля нет брони. Без брони нет танков. Без танков нет победы на военных дорогах второй мировой войны.
На службу войне были поставлены и другие металлы. В первой половине прошлого столетия никель добывался в небольших количествах и стоил очень дорого. Он считался поэтому ювелирным металлом. Позднее никель стали добавлять в стальную броню. Долгие годы это было его основное применение. Однако позже он стал неотъемлемой составляющей бронированных орудий и танков.
Когда советские танки Т-34 появились на полях сражений, немецкие специалисты были поражены неуязвимостью их брони. По приказу из Берлина первый же захваченный Т-34 был доставлен в Германию. Здесь за него взялись химики. Они установили: русская броня содержит большой процент никеля, что делает ее сверхпрочной. Недостаток никеля в стали привел к тому, что к 1944 г. имперские военные заводы вынуждены были изготовлять танковую броню повышенной толщины, и “тигры”, и “пантеры”, и “фердинанды”, одетые в нее, оказывались тяжелее и слабее советских танков и самоходок”.
Перед входом в Нижнетагильский краеведческий музей стоит знаменитый танк Т-34. Осенью 1941 г., когда враг был уже в пригородах Москвы, а западные и южные районы страны были оккупированы, Нижний Тагил стал одной из главных кузниц оружия для фронта. В то время стояла задача создать танк, который не боялся бы ни пулемета, ни колючей проволоки. Три качества этой машины — мощность огня, скорость, прочность брони — должны были так сочетаться, чтобы ни одно из них не приносилось в жертву другим. Нашим конструкторам во главе с М. И. Кошкиным удалось создать лучший танк периода Второй мировой войны. В осеннюю распутицу, когда немецкие танки безнадежно вязли в грязи, Т-34 оставался единственным танком, которому было не страшно бездорожье. Башня танка поворачивалась с рекордной скоростью: она делала полный оборот за 10с вместо обычных 35с. Благодаря небольшому весу и размеру танк был очень маневренный. Броня с повышенным содержанием никеля не только оказалась самой прочной, но и имела самые выгодные углы наклона, поэтому была неуязвимой.
Производство “тридцатьчетверок”, как их называли, было налажено в самые короткие сроки, хотя ценой тому были дни и ночи напряженного труда. Люди, у которых в холодном цехе пальцы примерзали к металлу, неделями не покидали рабочих мест и в конце декабря 1941 г. отправили на фронт первый эшелон с боевыми машинами. Тепло отозвался о танке Т-34 прославленный маршал И. С. Конев. Он писал: “Не было лучшей боевой машины ни в одной армии. До самого конца войны Т-34 оставался непревзойденным. Как мы были благодарны за него нашим уральским рабочим и инженерам!”
Магний, № 12. Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. Металлурги используют магний для раскисления стали и сплавов.
Тантал, № 73. Специалисты по военной технике считают, что из тантала целесообразно изготовлять некоторые детали управляемых снарядов и реактивных двигателей. Тантал – важнейший стратегический металл для изготовления радарных установок, передаточных радиостанций; металл восстановительной хирургии.
Кобальт, № 27. Кобальт называют металлом чудесных сплавов (жаропрочных, быстрорежущих). Кобальтовая сталь использовалась для изготовления магнитных мин.
Стронций, № 38. Стронций – металл фейерверков, потех и салютов. Соединения стронция применяют в пиротехнике для получения красных огней. При взрыве атомной или водородной бомбы образуется радиоактивный изотоп Sr-90, который вызывает тяжелое заболевание организма.
Олово, № 50. Олово – серебристо-белый металл, мягкий, пластичный. При определенной плотности на воздухе тускнеет, покрывается пленкой оксида, стойкой к химическим реагентам. Олово – компонент многих сплавов. Идет на покрытие металлов для защиты их от коррозии, на изготовление белой жести для консервных банок.
Сплав олова с другими металлами используется для изготовления подшипников. Из олова изготовляли блестящие оловянные солдатские пуговицы. При низкой температуре атомы олова перестраивают свою кристаллическую решетку и металл разрушается, “заболевает”. Название этой болезни – оловянная чума. Солдатские пуговицы нельзя хранить на морозе. Хлорид олова (IV) – жидкость, использовалась для образования дымовых завес.
Металлы олово и медь образуют сплав – бронзу. Из бронзы во всем мире изготовляют памятники воинам
Калий, № 19. В военном деле применяются соединения калия. Если говорят просто “селитра”, то имеют в виду нитрат калия. Этим веществом человечество пользуется уже больше тысячи лет для получения черного пороха. Обыкновенный порох – это смесь мелко измельченных: серы, селитры и угля. Еще два соединения – хлорат калия (бертолетова соль) KClO3 и дихромат калия K2Cr2O7 – применяются в спичечном производстве и пиротехнике.
Для ведения войн были необходимы не только железо, никель, алюминий, но и золото, много золота.
Стихотворение Михаила Дудина “Благословенный полдень”.
Благословенный полдень ликованья,
Весь мир в цвету. Они прошли вперед.
Я видел лица, блеск военной стали,
На гимнастерках звонкие медали,
На темных касках пуль тяжелый след,
Литого солнца золотую россыпь,
И этот шаг – торжественную поступь.
Воистину, им равных в мире нет.
Золото – благородный металл желтого цвета, ковкий, химически весьма инертен, на воздухе и при нагревании не изменяется. Первый из открытых человеком металлов. В природе встречается главным образом самородное золото. Золото обычно используется в виде сплавов с другими металлами. При сохранении основных свойств золото в сплавах обладает большой твердостью и прочностью, и позволяет его экономить. Из сплавов золота с платиной делают химически стойкую аппаратуру. Золото и его сплавы используют также для золочения и изготовления ювелирных изделий. Содержание золота в ювелирных изделиях, монетах, медалях выражают пробой.
На шумной площади, взобравшись на скамью,
Какой-то шарлатан румянокожий
Взывает к публике прохожей:
Я средство ото всех болезней продаю!
Вот порошок неслыханного свойства:
Он придает ума глупцу,
Честь – подлецу,
Трусливому – геройство…
Его влиянью нет придела и границ,
Всего поможет вам достичь он,
Пред ним все клонится, все упадает ниц…
Он в полном смысле энциклопедичен!
Я подошел и заглянул в бутыль –
Простая золотая пыль.
Приложение № 6.
Викторина по теме "Металлы тоже воевали".
1.Какие металлы содержатся в гильзе артиллерийского снаряда?
2. Как используется магний в военном деле?
3. Почему хранилища с жидким горючим окрашивают белой краской или серебрянкой?
4. Какой металл называют воплощением надежд и тревог?
5. Какой металл может "болеть чумой"?
6. Какой металл и почему называют "крылатым"?
7. Какой металл добавляется в сталь для придания танкам Т-34 особой прочности брони?
8. Какой металл придает ума глупцу, честь - подлецу, трусливому - геройства?
9. Какой металл используют для изготовления пуль для ружей и пистолетов?
10. Какой металл А.Е. Ферсман назвал "металлом консервной банки"?
11.В воздух взвилась красная сигнальная ракета. Соли какого металла обусловили её окраску?
12. Какие металлы использовались для праздничного салюта в День Победы ?
Приложение № 7 к индивидуальным д/з.
Победа ковалась и в тылу трудом многих советских людей, видных ученых.
Вспомним начало войны, 1941 г. Немецкие танки рвались к Москве, Красная Армия буквально грудью сдерживала врага. Не хватало обмундирования, продовольствия и боеприпасов, но самое главное – катастрофически не хватало противотанковых средств. В этот критический период на помощь пришли ученые-энтузиасты: в два дня на одном из военных заводов был налажен выпуск бутылок КС (Качурина–Солодовникова), или просто бутылок с горючей смесью. Это незамысловатое химическое устройство уничтожало немецкую технику не только в начале войны, но и даже весной 1945 г. – в Берлине.
Что представляли собой бутылки КС? К обыкновенной бутылке прикреплялись резинкой ампулы, содержащие концентрированную серную кислоту, бертолетову соль, сахарную пудру. (Демонстрация модели бутылки.) В бутылку заливали бензин, керосин или масло. Как только такая бутылка при ударе разбивалась о броню, компоненты запала вступали в химическую реакцию, происходила сильная вспышка, и горючее воспламенялось.
Реакции, иллюстрирующие действие запала (на экран проецируются уравнения реакций):
3KClO3 + H2SO4 = 2ClO2 + KСlO4 + K2SO4 + H2O,
2ClO2 = Cl2 + 2O2,
C12H22O11 + 12O2 = 12CO2 + 11H2O.
Три компонента запала берутся в отдельности, их нельзя смешивать заранее, т.к. получается взрывоопасная смесь.
![]()
Многие наши сверстники в военные годы во время налетов дежурили на крышах домов, тушили зажигательные бомбы. Начинкой таких бомб была смесь порошков Al, Mg и оксида железа, детонатором служила гремучая ртуть. При ударе бомбы о крышу срабатывал детонатор, воспламенявший зажигательный состав, и все вокруг начинало гореть. На экране приведены уравнения реакций, происходящих при взрыве бомбы:
4Al + 3O2 = 2Al2O3,
2Mg + O2 = 2MgO,
3Fe3O4 + 8Al = 9Fe + 4Al2O3.
Горящий зажигательный состав нельзя потушить водой, т.к. раскаленный магний реагирует с водой:
Mg + 2Н2O = Mg(ОН)2 + Н2![]() .
.
Во время ночных налетов для освещения цели бомбардировщики сбрасывали на парашютах осветительные ракеты. В состав такой ракеты входили порошок магния, спрессованный с особыми составами, и запал из угля, бертолетовой соли и солей кальция. При запуске осветительной ракеты высоко над землей красивым ярким пламенем горел запал; по мере снижения свет постепенно делался более ровным, ярким и белым – это загорался магний. Наконец, когда цель была освещена и видна так же хорошо, как и днем, летчики начинали прицельное бомбометание.
![]() Магний использовали не только для создания осветительных ракет. Основным потребителем этого металла была военная авиация. Магния требовалось много, поэтому его добывали даже из морской воды. Технология извлечения магния такова: морскую воду смешивают в огромных баках с известковым молоком, затем, действуя на выпавший осадок соляной кислотой, получают хлорид магния. При электролизе расплава MgCl2получают металлический магний (на экран проецируются уравнения реакций):
Магний использовали не только для создания осветительных ракет. Основным потребителем этого металла была военная авиация. Магния требовалось много, поэтому его добывали даже из морской воды. Технология извлечения магния такова: морскую воду смешивают в огромных баках с известковым молоком, затем, действуя на выпавший осадок соляной кислотой, получают хлорид магния. При электролизе расплава MgCl2получают металлический магний (на экран проецируются уравнения реакций):
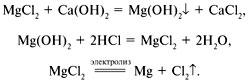
Было бы несправедливо не вспомнить сегодня о порохе. Во время войны в основном использовался порох бездымный и реже черный дымный. второй представляет собой смесь нитрата калия (75%), угля (15%) и серы (10%).
В отличие от U-80 двигатели более поздних подводных лодок работали по «горячему процессу»: Н2О2разлагался на водяной пар и кислород. В кислороде сжигалось жидкое топливо. Водяной пар смешивался с газами, образующимися от сгорания топлива. Полученная смесь приводила в движение турбину.
Советская подводная лодка типа «Щука» |
В наши дни подводный флот приобрел стратегическое значение. Атомные силовые установки во много раз увеличили дальность действия подводных лодок. Непрерывный контроль за составом воздуха, которым дышат подводники, его очистка и кондиционирование стали важны, как никогда. Роль химических средств очистки и регенерации воздуха по-прежнему первостепенна. Поэтому подводники с полным правом могут сказать: «Химия – это жизнь».
Трудная задача стояла перед войсками противовоздушной обороны. На нашу Родину были брошены тысячи самолетов, пилоты которых уже имели опыт войны в Испании, Польше, Норвегии, Бельгии, Франции. Для защиты городов использовали все возможные средства. Так, помимо зенитных орудий небо над городами защищали наполненные водородом шары, которые мешали пикированию немецких бомбардировщиков. Во время ночных налетов пилотов ослепляли специально выбрасываемыми составами, содержащими соли стронция и кальция. Ионы Са2+ окрашивали пламя в кирпично-красный цвет, ионы Sr2+ – в малиновый.
Для заполнения шаров водородом в военном деле использовался силиконовый способ, основанный на взаимодействии кремния с раствором гидроксида натрия. Реакция идет по уравнению:
Si + 2NaOH + H2O = Na2SiO3 + 2H2![]() .
.
Часто для получения водорода использовали гидрид лития. Таблетки LiH служили американским летчикам портативным источником водорода. При авариях над морем под действием воды таблетки моментально разлагались, наполняя водородом спасательные средства – надувные лодки, жилеты, сигнальные шары-антенны:
LiH + H2O = LiOH + H2.
Бомбардировщик «Норт Америкен» В-25. |
Искусственно созданные дымовые завесы помогли сохранить жизни тысяч советских бойцов. Эти завесы создавались при помощи дымообразующих веществ. Прикрытие переправ через Волгу у Сталинграда и при форсировании Днепра, задымление Кронштадта и Севастополя, широкое применение дымовых завес в берлинской операции – это далеко не полный перечень использования их в годы Великой Отечественной войны. Одним из первых дымообразующих веществ был белый фосфор. Дымовая завеса при использовании белого фосфора состоит из частичек оксидов (Р2О3, Р2О5) и капель фосфорной кислоты.
![]() В начале войны, когда от торпед и бомб, привязанных к специально обученным акулам, тонуло немало кораблей, возникла необходимость в надежном средстве защиты от акул. В решении этой проблемы приняли участие многие охотники на акул и ученые. Эрнест Хемингуэй помог этим исследованиям – он показал места, где сам не раз охотился на морских хищниц. Оказалось, что акулы просто не переносят сульфата меди(II). Акулы за версту обходили приманки, обработанные этим веществом, и с жадностью хватали приманки без сульфата меди.
В начале войны, когда от торпед и бомб, привязанных к специально обученным акулам, тонуло немало кораблей, возникла необходимость в надежном средстве защиты от акул. В решении этой проблемы приняли участие многие охотники на акул и ученые. Эрнест Хемингуэй помог этим исследованиям – он показал места, где сам не раз охотился на морских хищниц. Оказалось, что акулы просто не переносят сульфата меди(II). Акулы за версту обходили приманки, обработанные этим веществом, и с жадностью хватали приманки без сульфата меди.
Приложение №7
Пояснения к презентации:
(листаю календарь)
1941г. Немецкие танки рвутся к Москве, Красная Армия буквально грудью сдерживает врага. Не хватает обмундирования, продовольствия и боеприпасов, но самое главное не хватает противотанковых средств. В этот критический для страны период на помощь приходят ученые-энтузианисты. В два дня на одном из военных заводов налаживается выпуск бутылок
КС (Качугина – Солодовникова) или просто бутылок с зажигательной смесью.
Это незамысловатое химическое устройство уничтожает немецкую технику не только в начале войны, но и в 1942-1943 под Сталинградом и на Курской дуге, в 1944 – у Ясс и даже весной – в Берлине. Обратите внимание на картину Панфилова «Подвиг панфиловцев». На переднем плане боец, в руках он держит бутылку с зажигательной смесью.
Что представляли собой эти бутылки КС?
Бутылка с бензином, лигроином, маслом, керосином, ампулы с серной кислотой, бертолетовой смесью и сахарной пудрой. Как только такая бутылка при ударе разбивалась о броню, компоненты вступали в химическую реакцию, и горючее воспламенялось.
Учитель
Ребята, вы обратили внимание на то, что вещества: серная кислота, сахарная пудра и бертолетова соль – хорошо вам известны.
Обратите внимание на химическую реакцию, написанную на доске?
Глядя на эту реакцию, что можно сказать, к какому типу она относится?
Какие реакции называют окислительно-восстановительными?
Давайте уравняем приведенную реакцию, иллюстрирующую действие бутылок КС?
+5 +4 +7
-
3 KClO3 + H2SO4(к) = 2ClO2 + KClO4 + K2SO4 + H2O

+5 +4
Cl +1е Cl 2

+5 +7
C l -2 е Cl 1
l -2 е Cl 1
ClO2 = Cl2 + O2
C 12H22O11 + O2 CO2 + H2O
12H22O11 + O2 CO2 + H2O
Ребята, как вы думаете, можно ли смешать концентрированную серную кислоту и сахарную пудру?
Какое свойство концентрированной кислоты мы здесь видим? (специфическое обугливание органических веществ)
Учитель
Ребята, как тяжело было вашим сверстникам в военное время.
Во время налетов вражеской авиации подростки дежурили на крышах домов. Основной их задачей была борьба с зажигательными бомбами, которые во множестве сбрасывали на города и промышленные районы.
Учитель
Такая бомба представляла собой смесь порошков алюминия и магния и оксида железа.
Давайте напишем взаимодействие этих металлов на воздухе?
 4 Al + 3 O2 2 Al2O3
4 Al + 3 O2 2 Al2O3
 2 Mg + O2 2 MgO
2 Mg + O2 2 MgO
-
Как вы думаете, какого типа эта реакция?
-
Что мы называем процессом окисления?
-
Что происходит со степенью окисления элементов при процессах окисления?
-
Что вы можете сказать о второй реакции, записанной на доске?
-
Уравняйте эту реакцию без составления электронного баланса?
-
3
 Fe3O4 + 8 Al 9 Fe + 4 Al2O3
Fe3O4 + 8 Al 9 Fe + 4 Al2O3
-
Ребята, мы составили с вами реакции, иллюстрирующие взаимодействие алюминия и магния на воздухе, а сравните, пожалуйста, активность этих металлов.
-
А теперь, ответь те на вопрос, можно было потушить горящий зажигательный состав водой? ( ПОСТАНОВКА ПРОБЛЕМЫ)
- РЕШЕНИЕ ПРОБЛЕМЫ: Давайте попробуем написать реакцию взаимодействия магния с водой и дадим обоснованный ответ?
0 +1 +2 0
2 Mg + 2 H2O 2MgO+ 2 H2
Mg + 2 H2O 2MgO+ 2 H2

0 +2
Mg -2е Mg 1 окисление, восстановитель
 +1 0
+1 0
2 H +2 е H2 1 восстановление, окислитель
H +2 е H2 1 восстановление, окислитель
Вывод: тушить водой нельзя, т.к. раскаленный магний выделяет водород, который может при горении взорваться.
-
А чем необходимо тушить?/ песком/
При отсутствии песка ребята их сбрасывали с крыш домов на землю/.
-
Скажите, зачем в состав зажигательной бомбы входили битум и нефть?
/ это легко воспламеняющееся вещество. Рассекаясь по большой площади жидкости, увеличивали радиус действия/.
Было бы несправедливо не вспомнить сегодня о порохе. В основном во время Великой Отечественной войны использовался бездымный порох, который был создан Д. И. Менделеевым. Основой бездымного пороха является взрывчатое вещество нитроцеллюлоза.
Грозные боевые машины тех лет - легендарная «Катюша», знаменитый штурмовик ИЛ-2, которого панически боялись фашисты и называли его «черной смертью», были вооружены реактивными снарядами, топливом для которых служили бездымный порох.
Гораздо в меньших количествах использовался дымный порох, черный.
-
Расставьте степени окисления в реакции горения черного пороха?
3 . 2КNO3 + 3C + S K2S + 3CO2 + N2
. 2КNO3 + 3C + S K2S + 3CO2 + N2
Наступает 1942 г (перелистываю лист календаря). Обратите внимание на картину Марченко «На окраинах Сталинграда». Это была неординарная битва.
1942г.- Сталинградская битва. Её называют «Каннами ХХ века», и такое сравнение уместно. При Каннах Ганнибал взял в плен множество легионеров римской армии. И в Сталинградской битве враг тоже был разбит в окружении. Немецко-фашистские войска потеряли в кольце более 300 тыс. солдат. Такого разгрома не знала история с древнейших времен и до нашего времени.
1943г. Историческая битва на Курской дуге явилась одним из важнейших и решающих событий Великой Отечественной войны.
Учитель.
Самое грозное и страшное сражение произошло на третьем ратном поле России у станции Прохоровка. Оно отмечено в истории войн как великая битва танков и самоходных орудий.
Жаркое лето 12 июля 1943г. Навстречу нашим танкам двигались «тигры», «пантеры», а за ними шли средние танки и самоходно-артиллерийские установки «фердинанд». Образовались две мощные лавины танков. Хваленные фашистские «тигры» и «пантеры», лишенные в ближнем бою преимущества своего вооружения, успешно расстреливались нашими танками Т-34 с коротких расстояний.
- Ребята, что по- вашему, позволило выдержать Т-34 натиск немецких танков?
/ использование сталей и сплавов /.
В годы войны кобальт стали применять для создания жаропрочных сталей и сплавов.
Победа Красной Армии на Курской дуге завершила коренной перелом во II мировой войне. Сегодня эта земля называется ЗЕМЛЕЙ РОССИЙСКОГО ПОДВИГА.
Приложение №8. Презентация.
Приложение №9
 Приложение №10 – см. папку «химия и война»
Приложение №10 – см. папку «химия и война»
Используемая литература:
М. Фримантл «Химия в действии» - «Мир» - 91г. В 2х томах
В.А. Крицман «Книга для чтения по неорганической химии» - М., «Просвещение» - 93 г. – 2 ч.
« Химия» - прилож. к «1 сентября» - №24, 2008 г.
Ж. «Современный урок» - №2, 2008 г.
О.С. Габриелян « Настольная книга учителя химии» -М., «Дрофа» - 2007г.
А.И. Буш «Внеклассная работа. Химия. 10 кл.» -Волгоград, «Корифей» - 2007г.
С.И. Бочарова «Внеклассная работа.Химия. 8 -9 кл. .» -Волгоград, «Корифей» - 2007г.
С.М. Курганский «Интеллектуальные игры по химии» -М., «5 за знания» - 2006 г.
Н.Б. Ковалевская «Химия в таблицах и схемах» -М., «Школа 21 век» - 2005г.
Также были использованы Интернет – ресурсы.
Здесь представлен конспект к уроку на тему «методическая разработка урока по химии», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.






