Конспект урока «Химические свойства металлов. Ряд напряжения металлов» по химии
Дата_____________ Класс_______________
Тема: Химические свойства металлов. Ряд напряжения металлов.
Цели урока: расширить и углубить знания учащихся о характеристике химических элементов и образуемых ими простых веществ на примере металлов I-III групп главных подгрупп; уметь давать общую характеристику металлов I-III групп главных подгрупп в сравнении на основании положения в периодической системе и строения атомов.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала
Общие химические свойства металлов представлены в таблице:
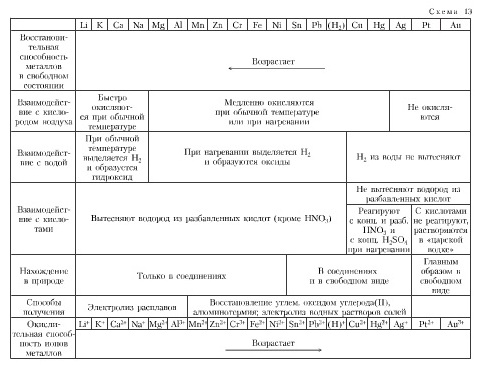
1). Металлы по - разному реагируют с водой:
Помните!!!
Алюминий реагирует с водой подобно активным металлам, образуя основание:
2Al + 6H2O = 2Al(OH)3 + 3H2↑
2). Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = соль + H2O + Х
| Щелочные и щелочноземельные | Fe, Cr, Al | Металлы до водорода Сd-Pb | Металлы после водорода (при t) |
Au, Pt | |
| X | H2S↑ могут S↓ или SO2↑ | 1)пассивируются на холоде; 2) при нагревании → SO2↑ | S↓ могут H2S илиSO2 | SO2↑ | - |
H2SO4 (разб) + Zn = ZnSO4 + H2↑
H2SO4 (разб) + Cu ≠
2H2SO4 (конц.) + Cu = CuSO4 + 2H2O + SO2↑
Внимание!
Pt, Au + H2SO4 (конц.) → реакции нет
Al, Fe, Cr + H2SO4 (конц.) холодная→ пассивация
Al, Fe, Cr + H2SO4 (конц.) t˚C→ SO2
4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
Внимание!
Pt, Au + HNO3 → реакции нет
Al, Fe, Cr + HNO3 (конц) холодная→ пассивация
Al, Fe, Cr + HNO3 (конц) t˚C→ NO2
Al, Fe, Cr + HNO3 (разб) → NO
3). С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Fe + CuCl2 = FeCl2 + Cu
FeCl2 + Cu ≠
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
3. Закрепление изученного материала
№1. Закончите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель):
K+ O2 =
Mg+ H2O =
Pb+ HNO3 (p) =
Fe+ CuCl2 =
Zn + H2SO4 (p) =
Zn + H2SO4 (k) =
№2. Решите тестовые задания
| Часть В. Ответом к заданиям этой части является набор букв, которые следует записать Установите соответствие. С увеличением порядкового номера элемента в главной подгруппе II группы Периодической системы свойства элементов и образуемых ими веществ изменяются следующим образом:
|
4. Домашнее задание
П. 37, упр.11-12, задача 4 на стр.112
Здесь представлен конспект к уроку на тему «Химические свойства металлов. Ряд напряжения металлов», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.


