Конспект урока «Химические свойства предельных карбоновых кислот. Разработка урока-исследования» по химии
МБОУ «Гимназия №44» г. Курска
«Химические свойства
карбоновых кислот»
(урок - исследование)
Учитель химии высшей категории:
Минакова А.П.

Курск-2012 г
Тема урока: Химические свойства карбоновых кислот.
Цели:
1. Образовательные: систематизировать сведения об общих химических свойствах кислот; на основе знаний о составе и строении карбоновых кислот научиться предсказывать их химические свойства, изучить некоторые специфические свойства отдельных кислот.
2. Развивающие: совершенствовать умение работать с учебным материалом; развивать умения наблюдать за происходящими изменениями с веществами, формулировать проблему, определять тему и цель, выдвигать и проверять гипотезу исследования.
3. Воспитательные: приучать к аккуратной работе в тетради, работе с реактивами с соблюдением ТБ, развивать коммуникативные способности,
воспитывать взаимовыручку, умение делать самооценку, критически
относится к оценке своих знаний. Приумножать знания о многообразии веществ в природе их материальном единстве, зависимости свойств веществ от состава и строения; воспитывать чувство ответственности, внимательности и аккуратности.
4. Цели исследовательской работы: сделать вывод о химических свойствах карбоновых кислот на основе проведенных исследований.
Тип урока: изучение нового материала.
Форма урока: урок-исследование с использованием элементов проблемной ситуации, компьютерной презентации.
Формы работы: парная, групповая и индивидуальная.
Оборудование: компьютер, компьютерная презентация, раздаточный материал
Реактивы:
а) для групповой работы: уксусная, муравьиная, масляная кислоты, этиловый, изоамиловый и изобутиловый спирты, соляная кислота, сульфат меди (II), гидроксид натрия, карбонат натрия (растворы), фенолфталеин, лакмус, пробирки; порошок Мg, гранулы Cu, порошк CuО, стаканчик с водой, спички, держатель, спиртовка.
б) для учителя: уксусная и муравьиная кислоты, аммиачный раствор оксида серебра, 2 спиртовки, 2 держателя, спички, 2 пробирки.
Ход урока:
I. Оргмомент.
II. Подготовка к восприятию нового материала.
- Какую большую тему мы изучали с вами на предыдущих уроках? (Карбоновые кислоты).
- Какие вопросы этой темы нами уже рассмотрены? (Состав, строение, номенклатура, виды изомерии и физические свойства карбоновых кислот).
Какие химические вещества называют карбоновыми кислотами? (Это органические кислородсодержащие вещества, соответствующие общей формуле CnH2n+1COOH)
Что же объединяет всех представителей этого класса в одну большую группу? (Наличие карбоксильной группы).
Давайте вспомним особенности её строения. Из каких двух самостоятельных групп состоит карбоксильная группа? (слайд 1)
(Карбонильной: - С = О
׀
Гидроксильной: - ОН)
Какова особенность электронного строения карбонильной группы?
(Связь С=О полярная, плотность смещена к атому кислорода. Электронная плотность в карбонильной группе (особенно σ-связи) смещена в сторону кислорода, как более электроотрицательного элемента. Вследствие этого карбонильный атом углерода приобретает частичный положительный заряд. Чтобы его компенсировать, он притягивает к себе электроны атома кислорода гидроксильной группы. Электронная плотность на атоме кислорода понижается и он смещает в свою сторону электронную плотность связи О – Н. Полярность связи в гидроксогруппе возрастает, водород становится подвижнее и легче отщепляется в виде протона).
У каких ещё классов органических соединений мы встречали гидроксильную группу? (Спирты, фенолы)
Какие свойства придает спиртам наличие гидроксила?
(За счет подвижности атома водорода спирты проявляют слабые кислотные свойства.)
И вот две эти функциональные группы соединены между собой. Как распределена электронная плотность в получившемся фрагменте? Как это отражается на свойствах карбоновых кислот? (слайд 2)
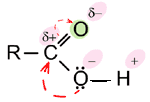
(1. По сравнению с альдегидами и кетонами углеродный атом – С = О несет меньший положительный заряд. Это происходит благодаря положительному мезомерному эффекту атома кислорода гидроксильного фрагмента, имеющего неподеленную электронную пару. Таким образом, карбонильная группа становится не способна к реакциям присоединения, характерным для альдегидов и кетонов.
2. Вместе с тем, возрастает полярность связи – О — Н гидроксильного фрагмента, ион водорода легче отщепляется, кислотные свойства карбоновых кислот должны значительно сильнее проявляться по сравнению со спиртами.)
Как вы думаете, чем мы с вами будем заниматься на сегодняшнем уроке? (Знакомиться с химическими свойствами карбоновых кислот)
Верно, только если быть более точными, то со свойствами предельных одноосновных карбоновых кислот. Запишите в рабочие листы тему нашего урока…(слайд 3)
Поскольку, класс веществ называется кислоты, то можно предположить, что ПКК будут иметь общие свойства с неорганическими кислотами. Но, так как это вещества органические, то для них будут характерны и специфические свойства.
Каковы цели сегодняшнего нашего урока? (Изучить химические свойства ПКК, сравнить их со свойствами неорганических кислот, сделать выводы) (слайд 4)
Итак, на основании знаний о кислотах из курса неорганической химии давайте предположим возможные химические свойства у ПКК
+действие на индикаторы,
+ Ме,
+ основания,
+ оксиды металлов,
+ соли.
Изучив класс предельных спиртов, какое ещё химическое свойство мы можем предположить у ПКК? (Образование сложных эфиров, реакцию этерификации)
Чтобы подтвердить или опровергнуть наши предположения о свойствах предельных карбоновых кислот, выполним лабораторную работу.
II. Изучение нового материала.
- Добывать знания можно самыми разными способами. Сегодня вы самостоятельно будете проводить исследование химических свойств карбоновых кислот. Свою работу на уроке вы будете оценивать сами по известным вам критериям. А девизом вашей работы будут слова древних мудрецов:
«Скажи мне, и я забуду.
Покажи мне, – я смогу запомнить.
Позволь мне это сделать самому, и это станет моим навсегда".
- Перед началом работы внимательно прочитайте правила техники безопасности.
1. Выполнение исследовательского эксперимента.
Обучающиеся разбиты на три группы, каждая группа работает со своими рабочими листами (см приложение).
Первая группа изучает химические свойства ПКК на примере уксусной кислоты.
Вторая – муравьиной кислоты.
Третья – масляной кислоты.
Образец записи в рабочих листах:
Опыт 1. Реакция на индикаторы
СН3СООНСН3СОО-+ H+
Опыт 2. Взаимодействие карбоновых кислот с Ме.
а) 2СН3СООН + Mg (СН3СОО)2Mg + H2
2H+ + Mg0 Mg2+ + H20
б) СН3СООН + Cu реакция не идет
Опыт 3. Взаимодействие карбоновых кислот с оксидами Ме.
а) 2СН3СООН + CuО (СН3СОО)2Cu + H2О
2H+ + CuО Сu2+ + H2O
Опыт 4. Взаимодействие карбоновых кислот с основаниями.
а) СН3СООН + NaОH СН3СООNa + H2О
H+ + ОH- H2O
Опыт 5. Взаимодействие карбоновых кислот с солями.
а) 2СН3СООН + Na2CО3 2СН3СООNa + CO2 + H2О
2H+ + CО32- H2O +CO2
Опыт 6. Взаимодействие карбоновых кислот с предельными одноатомными спиртами.
СН3СООН+ (СН3)2СНСН2СН2ОН↔СН3СОО СН2СН2СН(СН3)2+ H2O
Отчет групп о полученных результатах.
-Что вы можете сказать о свойствах ПКК? (Свойства ПКК имеют много общего со свойствами неорганических кислот) (слайд 5)
-Могут ли неорганические кислоты вступать в реакции со спиртами? Какие вещества при этом образуются? (Да. Например, реакция нитрования многоатомного предельного спирта глицирина. При этом так же образуется сложный эфир. Могут реагировать с кислотами и предельные одноатомные спирты, при этом образуются кислые или средние простые эфиры)
Вывод: карбоновым кислотам присущи общие свойства всех кислот (запись в рабочих листах).
2. Специфические свойства карбоновых кислот.
- Через урок вы будете выполнять практическую работу по этой теме. Одно из заданий будет таким: различить уксусную и муравьиную кислоты. Как вы это будете делать?
а) Проблемный эксперимент: учитель и один ученик проводят демонстрационно реакцию «серебряного зеркала» с муравьиной и уксусной кислотой
НСООН + Аg2О Н2О + СО2 + 2Аg
СН3СООН + Аg2О реакция не идет
б) СН3СООН + Сl2 СН2 Сl-СООН + НСl - эта реакция важна для промышленного производства аминокислот.
III. Закрепление:
Тест. Химические свойства карбоновых кислот
| Вопрос 1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия. | |
| Реагирующие вещества | продукты их взаимодействия |
|
|
| Вопрос 2. Уксусная кислота реагирует со следующими веществами:
| |
| 2 вариант | |
| Вопрос 1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия. | |
| реагирующие вещества | продукты их взаимодействия |
|
|
| Вопрос 2. Муравьиная кислота реагирует со следующими веществами:
| |
2.Взаимопроверка теста по «ключу»
3.Самооценка результатов работы.
IV. Рефлексия:
- Ребята, актуален ли девиз нашего урока? (слайд) Узнали ли вы на уроке что-то новое? Было ли вам интересно на уроке? Как вы оцениваете свое участие в уроке? Где полученные знания вы сможете применить?
Дайте ответы на эти и другие вопросы в своем рабочем листе с помощью таблицы №2
V. Д/З: стр.184-188 учебника
Задание для I группы «Что скрывает буква Е- на этикетках?...» (Е-260, Е-200, Е-210 и т.д.) Краткое сообщение
Задание для II группы. Приготовить презентацию (не более 10 слайдов) на тему: «Отдельные представители карбоновых кислот и их роль в жизни человека»
Задание для III группы. Составить кроссворд по теме «Карбоновые кислоты»
Индивидуальное задание.
Из предложенного списка практико-ориентированных задач по данной
теме выбрать одну, ответ представить в виде письменного обоснования.
Использованная литература:
-
О.С. Габриелян, И.Г. Остроумов, учебник Химия, профильный уровень, 10 класс. - М., ОЛМА, 2010 г.-448 с
-
Габриелян О.С., Остроумов И.Г. Химия: Методическое пособие. 10 кл. Профильный уровень. – М.: Дрофа
-
Габриелян О.С, Остроумов И. Г. Настольная книга учителя. Химия, 10 класс. – М.: Дрофа, 2004 – 278 с.
-
Габриелян О. С., Ватлина Л. П. Химический эксперимент в школе. 10 класс.- М: Дрофа, 2005г. – 208 с.
-
Гара Н.Н. Химия. Уроки в 10 классе: пособие для учителей. – М.: Просвещение, 2009 г.-112 с.
-
Репетитор по химии под ред. А.С. Егорова. – Ростов н/Д: Феникс, 2005г.-762 с.
-
М.М. Поташник Требования к современному уроку, Методическое пособие. – М., ЦПО, 2007г. – 272 с.
-
Справочные материалы «Химия в формулах» В.Г.Иванов, М., Дрофа, 2008г.-159 с.
-
Лобанова Н.Е. Кислородсодержащие органические соединения. //Первое сентября: химия. – 2006 - № 4. – с. 26-30
-
Фролова О.Г. Функциональные группы. //Первое сентября: химия. – 2006. - №9. – с. 15-18
Использованные материалы и Интернет-ресурсы
-
Подготовка к ЕГЭ по химии. Электронное учебное издание. – М.: ООО «Физикон», ООО «Дрофа», 2005г.
-
http://school-collection.edu.ru/collection/
Приложение 1
Рабочий лист урока (I группа) 
Ученика (цы) ___ класса ___________________________________________
(фамилия, имя)
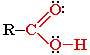
1. Покажи стрелками смещение электронной плотности в молекуле кислоты
Тема урока: Химические свойства одноосновных карбоновых кислот
2. Изучение химических свойств карбоновых кислот:
| Свойства | Неорганические кислоты | Органические кислоты | |
| 1. | Изменение окраски индикаторов | + | |
| 2. | Взаимодействие с металлами | + | |
| 3. | Взаимодействие с оксидами металлов | + | |
| 4. | Взаимодействие с основаниями | + | |
| 5. | Взаимодействие с растворами солей более слабых кислот | + | |
| 6. | Реакция этерификации | | |
Лабораторная работа
Инструкция по выполнению лабораторной работы
Цель: изучить свойства ПКК и сравнить их со свойствами неорганических кислот.
Правила работы с кислотами и щелочами: Соблюдай осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промой водой! При нагревании, прогрей сначала всю пробирку. Нюхать вещества нужно осторожно, направляя поток воздуха к носу рукой.
Инструктивная карта:
Опыт 1. В пробирку налейте 1 мл раствора уксусной кислоты. Исследуйте раствор универсальной индикаторной бумагой (или раствором лакмуса). Отметьте результат, укажите причину изменений, напишите уравнение реакции.
Опыт 2. В пробирку поместите 1-2 гр. магния и меди. Прилейте по 1 мл раствора уксусной кислоты. Отметьте изменения, запишите уравнение реакции.
Опыт 3. В пробирку с порошком оксида меди (II) прилейте 1 мл уксусной кислоты и слегка нагрейте её. Отметьте изменения, запишите уравнение реакции.
Опыт 4. В пробирку налейте 1 мл раствора гидроксида натрия, добавьте 1-2 капли раствора фенолфталеина. Прилейте 1 мл раствора уксусной кислоты. Отметьте изменения, запишите уравнение реакции. Проделайте такой же эксперимент с гидроксидом меди(II).
Опыт 5.В пробирку налейте 1 мл раствора карбоната натрия (Na2CO3). Прилейте 1 мл раствора уксусной кислоты. Отметьте изменения, запишите уравнение реакции.
Опыт 6. Получение изоамилового эфира уксусной кислоты
В пробирку налейте 1-1,5 мл ледяной уксусной кислоты, добавьте 0,5 мл изоамилового спирта и 1-2 капли концентрированной серной кислоты. Пробирку со смесью нагреть осторожно до кипения и кипятить около минуты (следить за тем, чтобы жидкость не потемнела!). Слегка охладить и добавить воды до исчезновения уксусного запаха. Отметьте изменения, запишите уравнение реакции.
Результат работы оформите в таблицу:
| Наблюдения | Уравнения реакций | |
| 1 | | |
| 2 | | |
| 3 | | |
| 4 | | |
| 5 | | |
| 6 | | |
Общий вывод:________________________________________________________________
| активно / не очень/пассивно | |
| 2.Своей работой на уроке я | доволен / не доволен |
| 3.Урок для меня показался | интересным / не интересным |
| 4.Материал урока мне был | понятен / не понятен |
| 5.Мое настроение | |
Какую бы оценку вы поставили себе за урок: «5», «4», «3», «2»?
 Рабочий лист урока (II группа)
Рабочий лист урока (II группа)
Ученика (цы) ___ класса ___________________________________________
(фамилия, имя)
Тема урока: Химические свойства одноосновных карбоновых кислот
1. Покажи стрелками смещение электронной плотности в молекуле кислоты

2. Изучение химических свойств карбоновых кислот:
| Свойства | Неорганические кислоты | Органические кислоты | |
| 1. | Изменение окраски индикаторов | + | |
| 2. | Взаимодействие с металлами | + | |
| 3. | Взаимодействие с оксидами металлов | + | |
| 4. | Взаимодействие с основаниями | + | |
| 5. | Взаимодействие с растворами солей более слабых кислот | + | |
| 6. | Реакция этерификации | | |
Лабораторная работа
Инструкция по выполнению лабораторной работы
Цель: изучить свойства ПКК и сравнить их со свойствами неорганических кислот.
Правила работы с кислотами и щелочами: Соблюдай осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промой водой! При нагревании, прогрей сначала всю пробирку. Нюхать вещества нужно осторожно, направляя поток воздуха к носу рукой.
Инструктивная карта:
Опыт 1. В пробирку налейте 1 мл раствора муравьиной кислоты. Исследуйте раствор универсальной индикаторной бумагой. Отметьте результат, укажите причину изменений, напишите уравнение реакции.
Опыт 2. В пробирку поместите 1-2 гр. магния и меди. Прилейте по 1 мл раствора муравьиной кислоты и слегка нагрейте. Отметьте изменения, запишите уравнение реакции.
Опыт 3. В пробирку с порошком оксида меди (II) прилейте 1 мл муравьиной кислоты и слегка нагрейте её. Отметьте изменения, запишите уравнение реакции.
Опыт 4. В пробирку налейте 1 мл раствора гидроксида натрия, добавьте 1-2 капли раствора фенолфталеина. Прилейте 1 мл раствора муравьиной кислоты. Отметьте изменения, запишите уравнение реакции. Проделайте такой же эксперимент с гидроксидом меди(II).
Опыт 5.В пробирку налейте 1 мл раствора карбоната натрия (Na2CO3). Прилейте 1 мл раствора муравьиной кислоты. Отметьте изменения, запишите уравнение реакции.
Опыт 6. Получение этилового эфира уксусной кислоты
В пробирку налейте 1-1,5 мл ледяной уксусной кислоты, добавьте 1 мл этилового спирта и 2-3 капли концентрированной серной кислоты. Пробирку со смесью нагреть до кипения и кипятить 2-3 минуты. Затем разбавить водой до исчезновения уксусного запаха. Отметьте изменения, запишите уравнение реакции.
Результат работы оформите в таблицу:
| Наблюдения | Уравнения реакций | |
| 1 | | |
| 2 | | |
| 3 | | |
| 4 | | |
| 5 | | |
| 6 | | |
Общий вывод:_______________________________________________________________
| активно / не очень/пассивно | |
| 2.Своей работой на уроке я | доволен / не доволен |
| 3.Урок для меня показался | интересным / не интересным |
| 4.Материал урока мне был | понятен / не понятен |
| 5.Мое настроение | |
Какую бы оценку вы поставили себе за урок: «5», «4», «3», «2»?
Рабочий лист урока (III группа) 
Ученика (цы) ___ класса ___________________________________________
(фамилия, имя)
Тема урока: Химические свойства одноосновных карбоновых кислот
1. Покажи стрелками смещение электронной плотности в молекуле кислоты

2. Изучение химических свойств карбоновых кислот:
| Свойства | Неорганические кислоты | Органические кислоты | |
| 1. | Изменение окраски индикаторов | + | |
| 2. | Взаимодействие с металлами | + | |
| 3. | Взаимодействие с оксидами металлов | + | |
| 4. | Взаимодействие с основаниями | + | |
| 5. | Взаимодействие с растворами солей более слабых кислот | + | |
| 6. | Реакция этерификации | | |
Лабораторная работа
Инструкция по выполнению лабораторной работы
Цель: изучить свойства ПКК и сравнить их со свойствами неорганических кислот.
Правила работы с кислотами и щелочами: Соблюдай осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промой водой! При нагревании, прогрей сначала всю пробирку. Нюхать вещества нужно осторожно, направляя поток воздуха к носу рукой.
Инструктивная карта:
Опыт 1. В пробирку налейте 1 мл раствора бутановой (масляной) кислоты. Исследуйте раствор универсальной индикаторной бумагой. Отметьте результат, укажите причину изменений, напишите уравнение реакции.
Опыт 2. В пробирку поместите 0,2 гр. магния и меди. Прилейте по 1 мл раствора бутановой кислоты. Отметьте изменения, запишите уравнение реакции.
Опыт 3. В пробирку с порошком оксида меди (II) прилейте 1 мл бутановой кислоты, слегка нагрейте. Отметьте изменения, запишите уравнение реакции.
Опыт 4. В пробирку налейте 1 мл раствора гидроксида натрия, добавьте 1-2 капли раствора фенолфталеина. Прилейте 1 мл раствора бутановой кислоты. Отметьте изменения, запишите уравнение реакции. Проделайте такой же эксперимент с гидроксидом меди(II).
Опыт 5.В пробирку налейте 1 мл раствора карбоната натрия (Na2CO3). Прилейте 1 мл раствора бутановой кислоты. Отметьте изменения, запишите уравнение реакции.
Опыт 6. Получение изобутилового эфира уксусной кислоты
В пробирку налейте 1-1,5 мл ледяной уксусной кислоты, добавьте 0,5 мл изобутилового спирта и 1-2 капли концентрированной серной кислоты. Пробирку со смесью нагреть осторожно до кипения и кипятить 1-2 минуты. Слегка охладить и добавить воды до исчезновения уксусного запаха. Отметьте изменения, запишите уравнение реакции.
Результат работы оформите в таблицу:
| Наблюдения | Уравнения реакций | |
| 1 | | |
| 2 | | |
| 3 | | |
| 4 | | |
| 5 | | |
| 6 | |
|
Общий вывод:____________________________________________________________
| активно / не очень/пассивно | |
| 2.Своей работой на уроке я | доволен / не доволен |
| 3.Урок для меня показался | интересным / не интересным |
| 4.Материал урока мне был | понятен / не понятен |
| 5.Мое настроение | |
Какую бы оценку вы поставили себе за урок: «5», «4», «3», «2»?
Приложение 2
Практико-ориентированные задачи к уроку:
«Химические свойства карбоновых кислот»
I группа – задачи 1-3
Задача 1
Египетская царица Клеопатра желая поразить римского полководца Марка Антония, растворила одну из своих знаменитых жемчужин (весом 40,2 г) в кубке с вином и выпила это вино за здоровье полководца. Однако жемчуг не растворяется ни в вине, ни в воде. Он переходит в раствор только под действием кислот, разве что в кубок с вином Клеопатры был добавлен уксус. Запишите уравнение возможной химической реакции и вычислите суммарный объем газа, выделившегося при этом.
Задача 2.
Муравьиный укус очень болезненный, однако, если место укуса смочить раствором нашатырного спирта, боль проходит. Объясните это явление, подтвердите его уравнением реакции.
Задача 3.
Хозяйка, готовясь к консервации овощей нового сезона, приобрела впрок несколько бутылочек уксуса. Через некоторое время она обнаружила, что уксус помутнел. Отчего это произошло? Можно ли мутный уксус опять сделать светлым?
II группа – задачи 4-6
Задача 4.
Юный химик поместил в пробирку гранулу цинка и прилил разбавленную серную кислоту. Затем добавил ацетат натрия. Выделение пузырьков газа резко уменьшилось. Как можно объяснить это явление?
Задача 5.
Ацетат кальция, полученный при взаимодействии уксусной кислоты с гашеной известью, один ученик решил высушить в пламени спиртовки. Правильно ли он поступил? Обоснуйте свой ответ, подтвердите его уравнением реакции.
Задача 6.
Юному химику для проведения эксперимента потребовалась муравьиная и уксусная кислоты. Однако вещества, стоящие на полке, оказались без этикеток. Из общего списка веществ было ясно, что среди склянок с прозрачной жидкостью, помимо указанных кислот, на полке находились: этиловый спирт, этиленгликоль, уксусный альдегид. Как юному химику распознать каждое из веществ? Ответ подтвердите уравнениями реакций
III группа – задачи 7-9
Задача 7.
Для каких целей уксусную кислоту и её соли применяются в медицине?
Задача 8.
Прогорклое сливочное масло с целью удаления неприятного запаха промывают раствором соды. В чем химическая сущность этого процесса?
Задача 9.
Знаете ли вы, что если потребуется отвинтить ржавую гайку, то рекомендуется вечером положить на нее тряпку, смоченную в уксусной кислоте? Утром отвинтить эту гайку будет значительно легче. В чем химическая сущность этого процесса?
Здесь представлен конспект к уроку на тему «Химические свойства предельных карбоновых кислот. Разработка урока-исследования», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.




