Конспект урока «Сера, её физические и химические свойства» по химии для 9 класса
Конспект урока химии на тему «Сера, её физические и химические свойства» 9 клас
Цели урока:
1. дать общую характеристику серы, рассмотреть аллотропные модификации серы, её свойства, нахождение в природе и применение серы, используя современные технологии обучения.
2. Привести учащихся к умению создавать проблемные ситуации и видеть пути их решения.
3. Обучать аргументировано защищать свою точку зрения.
4. Развитие коммуникативных способностей.
Оборудование: Различные модификации серы, металлы – Na, Zn,AI,посуда;
компьютер.
План урока
I. Организационный момент. Проверка домашнего задания.
Экспресс-опрос:
-
Назовите основные физические характеристики кислорода.
-
Как получают кислород в промышленности и лаборатории?
-
С чем связана аллотропия кислорода? Сравните свойства двух аллотропных модификаций кислорода.
-
Что вам известно об озоновом слое земли? Какова его роль для жизни на земле?
-
Назовите признаки реакций горения. Чем они отличаются от реакций медленного окисления?
-
Где применяется кислород?
-
Когда и кем был открыт кислород?
-
Изучение нового материала.
-
Немало сера знаменита,
И в древности ее Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
-
Стадия “Вызова”
В средние века считалось, что это обязательная составная часть всех веществ. Сера-“начало начал” древнейших филисофов, алхимиков, элемент, окруженный мистикой и тайнами. Сегодня я хочу познакомить вас с этим удивительным веществом, имеющим необыкновенные свойства.
Видеоопыт
II. Стадия “Осмысление”
Вам выданы листы с таблицей.
-
Знаю
Хочу знать
Узнал
1) В течение 5-ти минут каждый из вас заполнит 1-ую графу, отвечая на вопросы: см. задание №1.
2) Перескажите друг другу ваши записи.
3) Выделите ключевые понятия по теме «Сера»
4) Какая информация у вас осталась неполной?
5) Заполните графу 2.
6) Маркировка текста
См. опорный конспект.
Идёт работа с текстом и его маркировка.
V - уже известно
+ абсолютно новое, неожиданное;
- противоречит твоим представлениям;
? хочется узнать что-то больше.
На данной стадии идёт соотношение уже известного с тем, “что узнал”. Происходит структурная организация информации в памяти. Можно спросить, у кого были значки, и какие?
III. Стадия “размышления” (рефлексия)
Учащиеся должны попробовать выразить информацию, которую получили своими словами. (Работа с графой №3 - "Что узнал?").
-
Выяснили, какие новые понятия они увидели в тексте. (Эти пояснения записываем в 3-ю колонку).
Синквейн: составьте синквейн по теме «Сера»
1 слово
Существительное
2 слова
Прилагательное Прилагательное
3 слова
Глагол Глагол Глагол
4 слова
Слова, выражающие основную мысль
1 слово
Метафора или синоним
Заполните лист самооценки:
Заполняется лист самооценки.
1. Я активно участвовал (а) на уроке
2. Мои ответы были аргументированы
3. Мне было интересно
4. Был невнимателен
5.Отвлекался
6.Самооценка
7.Оценка учителя
Лист самооценки ученика (цы)
Критерии самооценки (Поставьте знаки "+" -да, "- " - нет)
Раздел изучаемой темы. При изучении испытываю затруднения
1. Характеристика серы
2.Физические свойства серы
3. Химические свойства
4.Нахождение серы в природе
5. Получение серы
6.Применение серы
Таблица
-
Знаю
Хочу знать
Узнал
Задание № 1
-
Строение и свойства атомов.
-
Сера – простое вещество
-
Химические свойства серы.
-
Сера в природе
-
Применение серы
Опорный конспект
-
Положение в ПС Д.И. Менделеева
S –Сера
III –период, VI(А)группа
Порядковый номер – 16
Заряд ядра атома – 32
Протонов -16, нейтронов -16, электронов – 16
Число энергетических уровней -3
1-ый уровень – 2электрона
2-ой уровень – 8 электронов
3-ий уровень – 6 электронов: из которых 2 электрона неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют более выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6. По отношению к менее электроотрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.
Атомы серы, как и атомы кислорода и всех остальных элементов главной подгруппы VI группы Периодической системы Д. И. Менделеева, содержат на внешнем энергетическом уровне 6 электронов, из которых 2 электрона неспаренные. Однако по сравнению с атомами кислорода атомы серы имеют больший радиус, меньшее значение электроотрицательности, поэтому проявляют более выраженные восстановительные свойства, образуя соединения со степенями окисления +2, +4, +6. По отношению к менее электроотрицательным элементам (водород, металлы) сера проявляет окислительные свойства и приобретает степень окисления -2.
-
Сера – простое вещество
для серы, как и для кислорода, характерна аллотропия. Известно много модификаций серы с циклическим или линейным строением молекул различного состава.
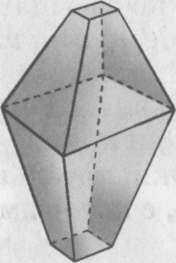
Наиболее устойчива модификация - ромбическая сера, состоит из молекул S8 .Ее кристаллы имеют вид октаэдров со срезанными углами. Они окрашены в лимонно-желтый цвет и полупрозрачны, температура плавления 112,8 °С.
В эту модификацию при комнатной температуре превращаются все другие модификации. Известно, например, что при кристаллизации из расплава сначала получается моноклинная сера (игольчатые кристаллы, температура плавления 119,3 °С), которая затем переходит в ромбическую.
При нагревании кусочков серы в пробирке она плавится, превращаясь в жидкость желтого цвета. При температуре около 160 °С жидкая сера начинает темнеть и становится настолько густой и вязкой, что даже не выливается из пробирки, однако при дальнейшем нагревании превращается в легкоподвижную жидкость, но сохраняет прежний темно-коричневый цвет. Если ее вылить в холодную воду, она застывает в виде прозрачной резинообразной массы. Это пластическая сера. Ее можно получить и в виде нитей. Однако через несколько дней она также превращается в ромбическую серу.

Ребята, сера не растворяется в воде, она тяжелее воды, плотность ромбической серы равна 2,07г/мл, плотность моноклинической серы – 1,96г/мл, поэтому кристаллы серы в воде тонут, а вот порошок плавает на поверхности воды, так как мелкие кристаллики серы водой не смачиваются и поддерживаются на плаву мелкими пузырьками воздуха. Это процесс флотации. Сера малорастворима в этиловом спирте и диэтиловом эфире, хорошо растворяется в сероуглероде.
-
Химические свойства серы.
А)Взаимодействие серы с металлами
при обычных условиях сера реагирует со всеми щелочными и щелочноземельными металлами, медью, ртутью, серебром:
Hq 0+S0=Hq+2S-2
эта реакция лежит в основе удаления и обезвреживания разлитой ртути, например из разбитого термометра. Видимые капли ртути можно собрать на лист бумаги или на медную пластинку. Ту ртуть, которая попала в щели нужно засыпать порошком серы. Такой процесс называют демеркуризацией.
При нагревании сера реагирует и с другими металлами (Zn, Al, Fe), и только золото не взаимодействует с ней ни при каких условиях.
Демонстрация опытов: взаимодействие серы с AI, Na,Zn.
составьте уравнения этих реакций и электронный баланс.
Вопрос к классу: Как называются вещества, полученные в результате этих реакций и к какому классу они относятся?
Б) Взаимодействие серы с неметаллами.
Из неметаллов с серой не реагируют только азот, иод и благородные газы.
1) Сера – окислитель :
1) H2 +S =H2S (сероводород)
S0+2ē =S2- │окислитель
H2 - 2ē =2H+ │восстановитель
2) Сера – восстановитель (слайд №9)
Cера горит синеватым пламенем, образуя оксид серы (IV), сернистый газ
S +O2 = SO2
-
Сера в природе
Сера входит в состав:
Белков
Витаминов
Гормонов
Участвует в ОВ процессах организма
Недостаток серы приводит к хрупкости и ломкости костей
Серой богаты бобовые растения, яйца, овсяные хлопья.
-
Применение серы.
Сера – основное сырьё для производства серной кислоты
Для приготовления красок
Для беления тканей
Для дезинфекции
Используют в производстве спичек и бумаги, резины, красок, взрывчатых веществ, лекарств, пластмассы, косметических препаратов
В сельском хозяйстве для борьбы с вредителями растений
Для изготовления пороха.
| Сера | |
| 16S |
Внешний вид простого вещества

Светло-жёлтое хрупкое твёрдое вещество, в чистом виде без запаха
Свойства атома
Сера / Sulfur (S), 16
[Ne] 3s2 3p4
127 пм
Химические свойства
102 пм
30 (+6e) 184 (-2e) пм
2,58 (шкала Полинга)
0
+6, +4, +2, 0, -1, −2
Энергия ионизации
(первый электрон)
Термодинамические свойства простого вещества
2,070 г/см³
386 K
717,824 K
1,23 кДж/моль
10,5 кДж/моль
22,61[1] Дж/(K·моль)
Кристаллическая решётка простого вещества
орторомбическая
a=10,437 b=12,845 c=24,369 Å
Прочие характеристики
(300 K) 0,27 Вт/(м·К)
-
Здесь представлен конспект к уроку на тему «Сера, её физические и химические свойства», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.