Конспект урока «Окислительно-восстановительные реакции» по химии для 10 класса
Урок по химии на тему «Окислительно-восстановительные реакции»
в 11 классе.
Материал подготовила
Дудник Светлана Евгеньевна,
учитель химии первой категории
МАОУ СОШ № 211 г.Новосибирска
Цель: углубление знаний обучающихся и подготовка к олимпиадам и ЕГЭ.
Задачи:
Образовательные задачи:
-
Закрепить знания учащихся об окислительно – восстановительных реакциях; закрепить умения учащихся в составлении уравнений окислительно – восстановительных реакций
-
выработать умения по составлению уравнений окислительно-восстановительных реакций
-
выработать умения по определению окислителя и восстановителя
-
формирование химически грамотной личности, готовой к жизнедеятельности в постоянно меняющейся среде, дальнейшему образованию и самообразованию.
Развивающие задачи:
-
способствовать формированию и развитию познавательного интереса учащихся к предмету
-
формирование умений анализировать, сопоставлять и обобщать знания по теме.
Воспитательные задачи:
-
воспитание осознанной потребности в знаниях;
-
воспитание активности и самостоятельности при изучении данной темы, умения работать в группе, умения слушать своих одноклассников.
Вид урока: урок – упражнение.
Форма организации учебной деятельности: индивидуальная и групповая.
Оборудование: компьютер, мультимедийный проектор, экран, документ-камера.
Методы обучения:
-
Общий метод (частично – поисковый).
-
Частный метод (словесно – наглядно – практический).
-
Конкретный метод (объяснение с элементами беседы).
Ход урока
-
Организационный момент
-
Сообщение темы, постановка темы и задач урока
-
Актуализация знаний. Воспроизведение ранее полученных знаний.
-
Учитель.
-
Что такое окислительно-восстановительные реакции?
Любая ОВР представляет собой совокупность процессов отдачи и присоединения электронов.
-
Как называется процесс отдачи электронов?
Процесс отдачи электронов называют окислением.
-
Как называются частицы, отдающие электроны?
Частицы (атомы, молекулы или ионы), отдающие электроны, называют восстановителями.
Учитель.
В результате окисления степень окисления восстановителя увеличивается. Восстановителями могут быть частицы в низшей или промежуточной степенях окисления. Важнейшими восстановителями являются: все металлы в виде простых веществ, особенно активные; C, CO, NH3, PH3, CH4, SiH4, H2S и сульфиды, галогеноводороды и галогениды металлов, гидриды металлов, нитриды и фосфиды металлов.
-
Как называется процесс присоединения электронов и частицы, принимающие электроны?
Процесс присоединения электронов называют восстановлением. Частицы, принимающие электроны, называют окислителями.
Учитель.
В результате восстановления степень окисления окислителя уменьшается. Окислителями могут быть частицы в высшей или промежуточной степенях окисления. Важнейшие окислители: простые вещества-неметаллы, обладающие высокой электроотрицательностью (F2, Cl2, O2), перманганат калия, хроматы и дихроматы, азотная кислота и нитраты, концентрированная серная кислота, хлорная кислота и перхлораты.
Вещества, содержащие частицы в промежуточной степени окисления, могут выступать как в роли окислителей, так и в роли восстановителей, т.е. проявляют окислительно-восстановительную двойственность. Это сернистая кислота и сульфиты, хлорноватистая кислота и гипохлориты, пероксиды и др.
-
Оперирование знаниями, овладение способами деятельности в новых условиях
Учащиеся выполняют ТЕСТ «Степени окисления» (Приложение 4.)
-
Обобщение и систематизация знаний и способов действий.
Учитель.
Различают три типа окислительно-восстановительных реакций.
Межмолекулярные ОВР – окислитель и восстановитель входят в состав различных веществ, например:
![]()
Внутримолекулярные ОВР – окислитель и восстановитель входят в состав одного вещества. Это могут быть разные элементы, например:
![]()
или один химический элемент в разных степенях окисления, например:
![]()
Диспропорционирование (самоокисление-самовосстановление) – окислителем и восстановителем является один и тот же элемент, находящийся в промежуточной степени окисления, например:
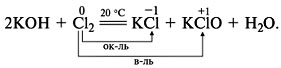
Для составления уравнений ОВР можно использовать метод электронного баланса (электронных схем) или метод электронно-ионного баланса. Рассмотрим один из методов.
Метод электронного баланса:
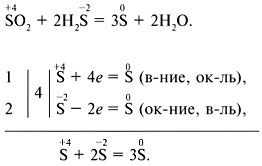
Задание 1. Составить уравнения ОВР с помощью метода электронного баланса, определить тип ОВР.
1. Цинк + дихромат калия + серная кислота = сульфат цинка + сульфат хрома(III) + сульфат калия + вода.
Решение
Электронный баланс:
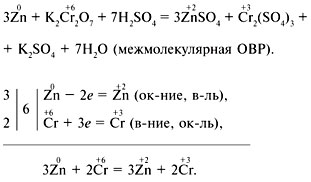
2. Сульфат олова(II) + перманганат калия + серная кислота = сульфат олова(IV) + сульфат марганца + сульфат калия + вода.
3. Йодид натрия + перманганат калия + гидроксид калия = йод + манганат калия + гидроксид натрия.
4. Сера + хлорат калия + вода = хлор + сульфат калия + серная кислота.
5. Йодид калия + перманганат калия + серная кислота = сульфат марганца(II) + йод + сульфат калия + вода.
6. Сульфат железа(II) + дихромат калия + серная кислота = сульфат железа(III) + сульфат хрома(III) + сульфат калия + вода.
7. Нитрат аммония = оксид азота(I) + вода.
Ответы на упражнения задания 1

Задание 3. Составить уравнения ОВР.
2. Оксид марганца(IV) + кислород + гидроксид калия = манганат калия +...................... .
3. Сульфат железа(II) + бром + серная кислота = ...................... .
4. Йодид калия + сульфат железа(III) = ....................... .
5. Бромоводород + перманганат калия = ............................. .
6. Хлороводород + оксид хрома(VI) = хлорид хрома(III) + ...................... .
7. Аммиак + бром = ...................... .
8. Оксид меди(I) + азотная кислота = оксид азота(II) + ...................... .
9. Сульфид калия + манганат калия + вода = сера + ...................... .
10. Оксид азота(IV) + перманганат калия + вода = ...................... .
11. Йодид калия + дихромат калия + серная кислота = ............................. .
Ответы на упражнения задания 3

-
Определение и разъяснение домашнего задания.
Приложение 1.
Восстановители:
-
Металлы
-
водород
-
уголь
-
Окись углерода (II) (CO)
-
Сероводород (H2S)
-
оксид серы (IV) (SO2)
-
сернистая кислота H2SO3 и ее соли
-
Галогеноводородные кислоты и их соли
-
Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3
-
Азотистая кислота HNO2
-
аммиак NH3
-
гидразин NH2NH2
-
оксид азота(II) (NO)
-
Катод при электролизе
Окислители:
-
Галогены
-
Перманганат калия(KMnO4)
-
манганат калия (K2MnO4)
-
оксид марганца (IV) (MnO2)
-
Дихромат калия (K2Cr2O7)
-
хромат калия (K2CrO4)
-
Азотная кислота (HNO3)
-
Серная кислота (H2SO4) конц.
-
Оксид меди(II) (CuO)
-
оксид свинца(IV) (PbO2)
-
оксид серебра (Ag2O)
-
пероксид водорода (H2O2)
-
Хлорид железа(III) (FeCl3)
-
Бертоллетова соль (KClO3)
-
Анод при электролизе.
Приложение 2.
П р а в и л а д л я о п р е д е л е н и я с т е п е н е й о к и с л е н и я
Степень окисления атомов простых веществ равна нулю.
Сумма степеней окисления атомов в сложном веществе (в молекуле) равна нулю.
Степень окисления атомов щелочных металлов +1.
Степень окисления атомов щелочно-земельных металлов +2.
Степень окисления атомов бора, алюминия +3.
Степень окисления атомов водорода +1 (в гидридах щелочных и щелочно-земельных металлов –1).
Степень окисления атомов кислорода –2 (в пероксидах –1).
Приложение 3.
Памятка
возможные степени окисления элементов
Марганец: +2, +3, +4, +6, +7.
Хром : +2, +3, +6.
Железо: +2, +3, +6.
Азот: -3, 0, +1, +2, +4, +5.
Сера: -2, 0, +4, +6.
Фосфор: -3, 0, +3, +5.
Хлор: -1, 0, +1, + 3, +5, +7.
Металлы, имеющие высшие степени окисления, образуют кислотные оксиды.
Перманганат калия: КМпО4.
Это сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа(2) в соли железа(3), сернистую кислоту в серную, из соляной кислоты выделяет хлор.
Вступая в химические реакции ион МnО4- может восстанавливаться в различной степени:
В кислой среде (рН2+
В нейтральной среде (рН=7) до МnО2.
В щелочной среде (рН>7) до МnО42-
Перекись водорода.
Степень окисления элемента кислород в перекиси водорода равна
-1, т.е. имеет промежуточное значение между степенью окисления элемента кислорода в воде(-2), и в молекулярном кислороде(0). Поэтому перекись водорода проявляет окислительно-восстановительную двойственность.
Если перекись служит окислителем, то она восстанавливается до воды Н2О.
Если перекись служит восстановителем, то она окисляется до молекулярного кислорода-О2.
Соли хроматы и дихроматы.
Хроматы (окрашенные в ярко-жёлтый цвет) в кислой среде переходят в дихроматы (оранжевого цвета), дихроматы в щелочной среде переходят в хроматы.
Хроматы и дихроматы-сильные окислители и в уравнениях окислительно-восстановительных реакций они меняют степень окисления с +6 до +3.
Соединения хлора.
НСlО-хлорноватистая кислота( соли-гипохлориты)
НСlО2-хлористая (соли-хлориты)
НСlО3-хлоноватая (соли-хлораты)
НСlО4-хлорная (соли-перхлораты)
При взаимодействии галогенов со щелочами в холодном растворе образуются гипохлориты, а в горячем-хлораты ( например хлорат калия или бертолетова соль-КСlО3).
Концентрированная азотная кислота
Если в качестве исходного вещества для проведения ОВР с другими веществами берут концентрированную азотную кислоту, в результате реакции она восстанавливается до оксида азота NO2
Приложение 4.
ТЕСТ «Степени окисления»
Вариант 1.
1 . Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
1) +4 2) -2 3) +2 4) -4
2. Восьмиэлектронную внешнюю оболочку имеет ион
1) Р3+ 2) S2- 3) С15+ 4) Fe2+
3. Одинаковую электронную конфигурацию внешнего уровня имеют Са2+ и
1) К+ 2) Ne0 3) Ва2+ 4) F-
4. Электронная конфигурация Is22s22p6 соответствует иону
1) А13+ 2) Fe3+ 3) Zn2+ 4) Cr3+
Вариант 2.
1. Двухэлектронную внешнюю оболочку имеет ион
1) S6+ 2) S2- 3) Вг5+ 4) Sn4+
2. Электронная конфигурация Is22s22p63s23p6 соответствует иону
1) Сl- 2) N3- 3) Br - 4) О2-
3. Одинаковое электронное строение имеют частицы
1) Na0 и Na+ 2) Na0 и K0 3) Na+ и F- 4) Cr2+ иСr3+
4. Иону Al3+ отвечает электронная конфигурация:
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p1 4) Is22s22p63s23p64s1
Ответы:
Вариант 1.
Вариант2.
Приложение 5.
Домашнее задание
Задача. Сплавы на основе меди называет бронзами. Кольца из бериллиевой бронзы – точная копия золотых. Они не отличаются от золотых ни по цвету, ни по весу и, подвешенные на нитку, при ударе о стекло издают мелодичный звук. Короче говоря, подделку не обнаружить ни на глаз, ни на слух, ни на зуб. Предложите способы определения подделки: на собственной кухне, в химической лаборатории (2 способа). Запишите уравнения реакций, назовите их признаки.
Ответ.
-
На кухне. Нагреть «золотое» кольцо на газовой плите, медь окисляется на воздухе до черного оксида меди (II) CuO (то есть кольцо из бронзы при нагревании темнеет).
-
В лаборатории. Растворить кольцо в азотной кислоте. Золото высокой пробы в азотной кислоте не растворяется, а вот медь, входящая в состав бронзы, взаимодействует с HNO3. Признаки: раствор голубого цвета, выделение бурого газа «лисий хвост».
Cu + 4HNO3 конц. = Cu(NO3)2 + 2NO2 + 2H2O
Золото не растворяется и в конц. H2SO4, а вот медь при нагревании растворяется:
Сu + 2H2SO4 конц. = CuSO4 + SO2 + 2H2O
Признаки: раствор голубого цвета, выделение газа.
Анализ проведенного занятия
Урок проведен в 11 классе. Поставленной цели - углубление знаний обучающихся и подготовка к олимпиадам и ЕГЭ, достичь удалось. Учащимся выданы памятки, необходимые для более полного усвоения темы и используемые при выполнении домашнего задания.
Основные проблемы, возникшие у учащихся в усвоении содержания учебного материала по теме «Окислительно-восстановительные реакции», связаны с составлением ОВР методом электронного баланса.
Используя алгоритм, составленный учителем совместно с учащимися, удалось откорректировать основные действия по написанию ОВР и избежать основных ошибок.
Здесь представлен конспект к уроку на тему «Окислительно-восстановительные реакции», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (10 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

