Конспект урока «Степень окисления. Окислительно-восстановительные реакции» по химии для 9 класса
Казахстан, Северо-Казахстанская область, район имени Габита Мусрепова, село Сокологоровка
КГУ «Сокологоровская средняя школа»
Урок в 9 классе
Тема: «Степень окисления. Окислительно-восстановительные реакции»
План урока
Тема: Степень окисления. Окислительно-восстановительные реакции
Цель: систематизировать знания учащихся о классификации химических реакций в свете электронной теории; научить объяснять основные понятия окислительно-восстановительных реакций; научить составлять уравнения окислительно-восстановительных реакций.
Задачи:
Образовательная: сформировать знания, умения и навыки при изучении степени окисления элементов, окислительно-восстановительные реакции
Развивающая: развить мышление учащихся, умение анализировать, сравнивать, обобщать, наблюдать, запоминать, осуществлять самоконтроль
Воспитательная: воспитывать личностные качества, обеспечивающие успешность исполнения задания, дисциплинированность, ответственность, а также активность, увлеченность и наблюдательность
Структура урока
1) Организационный момент
2) Проверка домашнего задания
3) Изучение нового материала
4) Закрепление нового материала
5) Домашнее задание, выставление оценок
Ход урока
1) Организационный момент (3-5 мин.)
2) Проверка домашнего задания (10 мин.)
а) Напишите уравнение реакции восстановления оксида железа (II) водородом. Реакцию проводят при +500°С.
б) Расскажите об областях применения водорода.
в) Вычислите, сколько граммов водорода выделится при взаимодействии 4г кальция с водой.
3) Изучение нового материала (15-20 мин.)
Если в соединениях с полярной ковалентной связью общие электронные пары смещены в сторону более электроотрицательного атома, то в ионных соединениях валентные электроны полностью переходят от атомов металла к атомам неметалла. Однако резкой границы между соединениями с полярной ковалентной и ионной связями не существует.
Процессы, в результате которых происходит переход или смещение валентных электронов от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью, называются окислительно-восстановительными реакциями.
Рассмотрим реакцию образования оксида натрия Na2O:



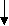 4ē
4ē
0 +1 -2
4Na + O2 → 2Na2O
восстановитель окислитель
(окисляется) (восстанавливается)
Процесс передачи атомом электронов называется окислением, а процесс присоединения электронов - восстановлением.
Те атомы или ионы, которые присоединяют электроны, называются окислителями, а те, которые отдают, - восстановителями.
В рассмотренном примере атом натрия в реакции с кислородом, окисляясь, отдает электрон. Следовательно, он является восстановителем. Атом же кислорода является окислителем. Он присоединяет к себе электрон, т.е. восстанавливается.
Заряд иона в ионных соединениях и условный заряд атомов в полярных ковалентных соединениях принято называть степенью окисления.
Значения степени окисления определяются числом электронов, смещенных от атома данного элемента к атому другого элемента.
Степень окисления обозначается арабскими цифрами со знаком «+» или «-». Каждому атому в любом сложном соединении соответствует определенная степень окисления. Например, для фтора во фтороводороде HF степень окисления равна -1, для водорода +1.
В химических формулах биэлементных соединений, как правило, на первое место ставится символ химического элемента, обладающего меньшей электроотрицательностью (например, металла) и соответственно положительной степенью окисления.
Степень окисления многих химических элементов – величина переменная. Например, для серы известны следующие степени окисления: +2 в H2S , +4 в SO2 , +6 в SO3. В простом веществе степень окисления серы равна 0. Нулевую степень окисления имеют атомы химических элементов, входящих
0 0
в состав простых веществ: водорода H2, хлора Cl2 и других. Это объясняется тем, что в таких молекулах смещение электронов не происходит.
Атомы металлов проявляют только положительную степень окисления. Атомы неметаллов (кроме фтора) могут проявлять как положительную, так и отрицательную степень окисления.
В соединениях неметаллов одного и того же периода отрицательную степень окисления будет иметь элемент с большим порядковым номером (например,
+5 -1
в хлориде фосфора (V) PCl5: PCl5).
В химических соединениях сумма абсолютных значений степеней окисления равна нулю. Исходя из этого, легко определить степень окисления одного элемента, если известны степени окисления других элементов в данном соединении. Например, для определения
+1 х -2
степени окисления марганца в соединении перманганата калия KMnO4 составляют следующее уравнение:
(+1) + х+ (-2)· 4 = 0,
1 + х – 8 = 0,
х = 8 – 1 = 7,
х = +7.
Степень окисления марганца в перманганате калия равна +7.
Чаще всего высшая положительная степень окисления элемента в его соединении равна номеру группы периодической системы, в которой находится этот элемент. В периодической системе это показано на примере формул оксидов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7.
Окислительно-восстановительные реакции
Окислиительно-восстановиительные реакции, также редокс (англ. redox, от reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление — процесс отдачи электронов, с увеличением степени окисления.
При окислеении вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановлеением называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Составление уравнений окислительно-восстановительных реакций.
При составлении уравнений окислительно-восстановительных реакций следует учесть, что число электронов, отданных восстановителем, должно быть равно числу электронов, присоединенных окислителем.
В качестве примера рассмотрим реакцию соляной кислоты с перманганатом калия.
1.Пишут формулы реагирующих веществ, ставят стрелку, а за ней пишут формулы веществ, которые образуются при данной реакции:
HCl+KMnO4→KCl+MnCl2+Cl2↑+H2O
2.Проставляют степень окисления над знаками элементов, у которых она меняется:
-1 +7 +2 0
HCl+KMnO4→KCl+MnCl2+Cl2↑+H2O
3.Выписывают химические знаки элементов, атомы или ионы которых меняют степень окисления:
0
2Cl¯→Cl2
+7 +2
Mn→Mn
4.Находят, сколько электронов отдают или присоединяют соответствующие атомы или ионы:
0
2Cl – 2e−→Cl2
+7 +2
Mn + 5e−→Mn
5.Находят наименьшее общее кратное число отданных и присоединенных электронов (их число должно быть одинаково):
0 0
2
 Cl¯– 2e−→Cl2 5 10Cl¯ –10e−→5Cl2
Cl¯– 2e−→Cl2 5 10Cl¯ –10e−→5Cl2
+7 +2 +7 +2
6.Найденные коэффициенты ставят перед соответствующими формулами в правой части уравнения:
HCl+KMnO4→KCl+2MnCl2+5Cl2+H2O
7.Соответсвенно найденным коэффициентам в правой части уравнения находят коэффициенты для формул всех остальных веществ:
16HCl+2KMnO4→2KCl+2MnCl2+5Cl2+8H2O
8.Проверяют, соответствует ли число атомов всех элементов в левой части уравнения числу атомов в правой части уравнения.
4) Закрепление нового материала (5-7 мин.)
а) Составьте уравнения окислительно– восстановительных реакций:
1.Алюминия с хлором;
2.Железа с хлором;
3. Лития с серой.
б) Определите степень окисления хрома в соединении K2Cr2O7.
г) Даны уравнения реакций:
1. Zn+ Cl2→ZnCl2
2. Zn+HCl→ZnCl2+H2↑
Проставьте над знаками соответствующих химических элементов степени окисления и покажите переход электронов.
5) Домашнее задание, выставление оценок(3мин.)
§66 пересказ стр.169-172; упражнения № 3, 4,5 стр.172
Здесь представлен конспект к уроку на тему «Степень окисления. Окислительно-восстановительные реакции», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

