Конспект урока «Степень окисления» по химии
Урок по теме «Степень окисления» с мультимедийным приложением
Цель: сформировать понятие о степени окисления на основании знаний учащихся о видах химической связи. Научить находить степень окисления по формуле и составлять формулы по степени окисления.
Оборудование: мультимедийный проектор, ноутбук
Тип урока – открытия новых знаний.
Ход урока.
-
Оргмомент (Самоопределение к деятельности)
Приветствие, сообщение темы и целей урока.
Добрый день, ребята. На нашем уроке сегодня присутствуют гости. Я думаю не стоит на это обращать особое внимание, а наоборот надо показать себя с лучшей стороны. Я думаю у нас все получиться. Пожелаем друг другу удачи. Эпиграфом к нашему уроку будут слова А. Дистервега "Не в количестве знаний заключается образование, а в полном понимании и искусном применении всего того, что знаешь".
2. Актуализация знаний
Слайд 2
На какие две группы веществ можно разделить следующие вещества H2, NaCl, Ca, HCl, Al, Cl2, H2O, NH3. (Простые и сложные). Я хочу вам напомнить. При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют бинарными (от лат. би — «два») или двухэлементными. Есть ли среди перечисленных веществ бинарные соединения?
Перечислите простые вещества металлы и неметаллы.
Какая связь характерна для металлов?
Какая связь характерна для неметаллов? (ковалентная полярная и неполярная)
А какая связь возникает в соединения металлов с неметаллами? (Ионная). Есть ли среди выше перечисленных соединений соединение с ионной связью? (NaCl ) Как образуется такая связь? Кто желает нарисовать образование ионной связи.(Слайд3)
Атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом +1. а атом хлора принял электрон и превратился в ион с зарядом -1.
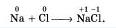
Поваренная соль – бинарное соединение, т.к. состоит из двух элементов.
Какой элемент пишется на первом месте?
На первом месте всегда пишут «обделённый» элемент, у которого отобрали электроны, т.е. «+», на втором « - »
Давайте вспомним, как образуется молекула хлороводорода HCl? (Слайд 4 )
В молекуле же НСl связь образуется за счет спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода, как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:
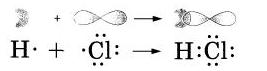
За счет чего дополняется внешний уровень у ковалентных соединений? (За счет общей электронной пары.)
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:

А теперь вспомним образование молекулы хлора.(Слайд5)
Какой в ней вид связи?
За счет чего образуется?
Образуются ли заряды у атомов хлора? Почему? (Общая пара одинаково принадлежит как одному атому хлора , так и другому)
(Слайд 6)
Сравним соединения NaCl, HCl, Cl2. Если же представить, что и в молекуле HCl, как и в хлориде натрия NaCl, электрон полностью перешел от атома водорода к атому хлора. Какие заряды приобрели бы атомы водорода и хлора? Они бы получили заряды+1, -1:
Такие условные заряды называются степенью окисления.
И так мы подошли к теме сегодняшнего урока . Назовите нашу тему.
Тема урока: «Степень окисления» (Слайд 7 )
Попробуйте сформулировать цель нашего урока
3. Постановка учебной задачи
Цель для учащихся: Урок для вас будет результативным, если вы сможете разобраться что такое степень окисления и научиться её находить по формуле вещества и составлять формулы бинарных соединений по степени окисления. (Слайд 8)
4. Открытие детьми нового знания.
Слайд 9
И так мы с вами пришли к понятию степень окисления. И сказали, что это условный заряд.
- А на основе чего вычисляется С.О.?
При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
- Хочу , чтобы вы сформулировали определение степени окисления.
Степень окисления – это условный заряд атомов химических элементов в соединении, вычисленный на основе предположения, что все соединения состоят из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например: (на доске):
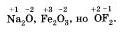
Проблема А теперь я жду от вас вопроса. (А как расставляются С.О.?)
Есть для этого правила расстановки С.О.
Рассмотрим правила определения С.О.
Вы мне поможете их составить. Для начала нужно прочитать текст на стр.87-88 Вам необходимо вместо пропусков вставить значения ст.ок., и некоторые слова и формулы. (Слайд 10) (Напечатать каждому !)
Правила определения С.О.
-
С.о. атомов в простых веществах =…..
-
С.о. фтора = ….
-
С.о. кислорода = …. (кроме Н2О2-1, …..)
-
С.о. водорода = …. (кроме ……)
-
С.о.Ме I, II, III групп = номеру ……
-
С.о Ме …… = номеру ……
-
С.о. неМе «-» = 8 – номер …….
Проверка (Слайд 11)
Правила определения С.О.
-
С.о. атомов в простых веществах = 0
-
С.о. фтора = -1
-
С.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
-
С.о. водорода = +1 (кроме МеН-1)
-
С.о.Ме I, II, III групп = номеру группы
-
С.о Ме «+» = номеру группы
-
С.о. неМе «-» = 8 – номер группы
Слайд 12 (Продолжение правил)
Некоторые элементы имеют постоянную степень окисления, а некоторые переменную
У элементов с переменной с.о. различают максимальную, минимальную и промежуточную с.о.
-
Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру группы
-
Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы
-
Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
-
В соединениях суммарная степень окисления всегда равна нулю.
Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О7. Обозначим степень окисления -2 кислорода: Сl2О7. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) • 7 =-14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:
(+14):2 = +7.
Слайд13
Рассмотрим возможные С.О. серы
Максимальная +6 = № группы S+6O3-2
Минимальная -2 (8- № группы) H2+1S-2
Сера может проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Слайд14
5. Первичное закрепление
Теперь применим те правила, с которыми познакомились сегодня для определения с.о. в соединении
N2O3
На первом месте стоит элемент с «+» с.о., на втором с «-»
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
Стр.88 прочитайте как найти x
Посмотрите внимательно на формулу как можно найти х другим способом?
6. Закрепление изученного. Самостоятельная работа
Слайд 15
Задание 2
Определите С.О. по формулам
NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
Слайд 16 или на доске Проверка
Na+ H-, Na2 +S-2, Mg +2O -2 , H3 +N-3, N2 0, Al2 +3S3 -2, Cu2 +1O-2
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия и углерода рядом АlС, причем сначала знак алюминия, так как это металл (электроположительный элемент), а затем электроотрицательный. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до "заветной восьмерки" 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
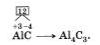
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Как правильно записывается бинарное соединение?
В начале пишутся элементы с «+» значением С.О., а затем с «-» значением С.О. Названия даются в обратном порядке: вначале произносится латинское название элемента с «- » значением С.О. добавляя суффикс ид, а после этого название элемента с «+» значением С.О.в родительном падеже. Если элемент имеет переменную С.О., то она указывается в названии римскими цифрами в скобках.
NaCl – хлорид натрия
Al2S3 – сульфид алюминия
MgO – оксид магния
CO2 – оксид углерода (IV), угл. Газ, диоксид углерода
CO - оксид углерода (II), угарный газ, монооксид углерода

Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклатуре веществ и терминологии, используемой к химии.
7. Рефлексия деятельности.
Вернемся к нашей цели.
Прочитайте цели урока.
-
Достигли ли Вы целей урока, в какой степени?
-
Что мешало и что помогало работе на уроке?
-
Как бы Вы оценили свою работу на уроке: отлично, хорошо, плохо
Я хочу чтобы вы оценили свою деятельность на листочках.
8. Дом. задание Слайд 17
-
§17 № 2 (а,б,в), 3,6 стр.90-91
Подготовить сообщения о бинарных соединениях: воде, углекислом газе, оксиде кремния
Здесь представлен конспект к уроку на тему «Степень окисления», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

