Конспект урока «Теория электролитической диссоциации» по химии для 11 класса
Урок по химии в 11 классе по теме «Теория электролитической диссоциации»
Цель: Систематизация знаний учащихся по теме «Теория электролитической диссоциации» (ТЭД).
Задачи:
Образовательная: Отработать основные понятия и положения по теме «ТЭД».
Развивающая: Развитие умений объяснять свойства веществ на основе их строения, составлять схемы диссоциации электролитов на ионы, работать с компьютером и интерактивной доской, систематизировать, обобщать.
Воспитательная: Воспитание самостоятельности, ответственности, уверенности в себе.
Оборудование: компьютер, интерактивная доска, ЦОРы сайта «Виртуальная школа Тверской области», портреты ученых.
План
1. Оргмомент:
1.1. Проверка готовности к уроку.
1.2. Сообщение темы урока и его задач .
1.3. Заготовка таблицы-кластера:
| Основные положения ТЭД |
2. Стадия вызова: прием «мозговой штурм» - 2-3 мин.
Мы с вами знакомились с некоторыми понятиями и положениями ТЭД в 8 классе. Работая в парах, вспомните, какие понятия теории вам известны? Занесите их в таблицу
(заслушиваются ответы ребят, вспоминаются понятия «электролиты», «неэлектролиты», «электролитическая диссоциация»).
3. Стадия осмысления:
3.1. Краткая информация об авторах ТЭД:
-С.А. Аррениус- шведский химик, в 1887 году сформулировал основные положения ТЭД;
- И.А. Каблуков – русский химик, ввел представление о гидратации ионов;
- В.А. Кистяковский – русский химик, объединил ТЭД с теорией растворов Д.И. Менделеева.
3.2. Самостоятельная работа с текстом, расположенном на рабочем столе компьютера (приложение 1)
Задание: Изучить текст в течение 5-7 минут. Занести новые понятия в графу 1 таблицы.
Ответить на вопросы к тексту.
3.3. Задание: Озвучить флеш-фрагмент «Механизм ЭД», используя материал текста (на подготовку дается 1-2 минуты, назначаются рецензенты).
http://sc.tverobr.ru/dlrstore/617fdbc1-8cff-11db-b606-0800200c9a66/ch08_35_03.swf
Фронтальная проверка заполнения графы 1 кластера – беседа.
Ответы на вопросы к тексту – беседа.
3.4. Задание: составить на интерактивной доске схемы диссоциации кислот, солей, оснований, дать определение им как электролитам:
а) K2SO4→ б) AlCl3→ в) NaOH→ г) Ca(OH)2→ д) HCl → е) HNO3→
3.5. Ступенчатая диссоциация многоосновных кислот (работа с флешфрагментом
http://sc.tverobr.ru/dlrstore/617fdbc4-8cff-11db-b606-0800200c9a66/ch08_36_01.swf
3.6. Первичная проверка: выполнение заданий:
1) Диссоциация по трем ступеням возможна в растворе:
а) Хлорида алюминия
б) Нитрата алюминия
в) Ортофосфата калия
г) Ортофосфорной кислоты
2) Восстановите левую часть для схем ступенчатой диссоциации
ортофосфорной кислоты H3PO4 , поставьте соответствующий знак между
левой и правой частями схемы, определите номер стадии:
… H+ + HPO4 2-
… H+ + H2 PO4 –
… H+ + PО43-
3) Показать на схеме, куда будут двигаться ионы в электрическом поле.
4) Что общего у изображенных веществ? Определите силу каждого из веществ как электролита. Какую величину мы используем для определения силы электролита?
-
HCl 2. CH3COOH 3. HNO3 4. H2 CO3
4. Стадия рефлексии:
4.1. Работа с кластером.
Попытаемся, используя материал урока сформулировать некоторые положения ТЭД (ответы заносятся в таблицу, приложение 2).
4.2. Фронтальная работа по выполнению заданий части А КИМов ЕГЭ по химии:
1. Ионы I- образуются при диссоциации
а)KIO3 б) KI в) C2H5I г) NaIO4
2. Вещество, при диссоциации которого образуются катионы Na+ , H+ и SO4 2- , является:
а) кислотой б) щелочью в) средней солью г) кислой солью
3. Электрический ток проводит
а) спиртовой раствор иода
б) расплав парафина
в) расплав ацетата натрия
г) водный раствор глюкозы
4. Электролитом является каждое вещество в ряду:
а) C2H6 , Ca(OH)2 , H2S , ZnSO4
б) BaCl2 , CH3OCH3 , NaNO3 , H2SO4
в) KOH , H3PO4 , MgF2 , CH3COONa
г) PbCO3 , AlBr3 , C12 H22 O11 , H2SO3
5. Домашнее задание: стр. 148-150 учебника О.С. Габриеляна «Химия-11»,
Всем: №2,3,4 стр.156 - письменно.
*Задача: Определить количество вещества и число ионов натрия, образующихся при диссоциации 2 молей ортофосфата натрия. Считать, что степень диссоциации соли 100%.
6. Поставим себе оценку за работу на уроке (выполнение заданий «Найди ошибку»):
1. электролиты проводят электрический ток
2. источником тока в растворе электролита являются электроны
3. катионы заряжены положительно, анионы - отрицательно
4. Растворы электролитов проводят ток из-за наличия в них положительных и отрицательных ионов
5. процесс взаимодействия воды с частицами вещества называется гидратацией
6. дистиллированная вода проводит ток
7. одной из причин диссоциации веществ в воде является особое строение молекулы воды.
8. все растворимые кислоты - сильные электролиты
9. все растворимые основания и соли - сильные электролиты
Приложение 1
Диссоциация электролитов на ионы
В процессе электролитической диссоциации (распаде электролитов на ионы) большую роль играют молекулы воды. Между атомами водорода и кислорода имеются расположенные под углом около 1050 ковалентные сильнополярные связи. Поэтому молекулы воды полярны и представляют собой диполи: ![]() При растворении в воде веществ с ионной связью, например хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
При растворении в воде веществ с ионной связью, например хлорида натрия, молекулы воды притягиваются своими отрицательными полюсами к положительно заряженным ионам натрия, а положительными полюсами – к отрицательно заряженным хлорид-ионам. В результате связь между ионами ослабляется, и кристаллическая решетка разрушается (рис.1). Таким образом, все ионы в растворе связаны с молекулами воды. Такие ионы называются гидратированными, а процесс их образования гидратацией. Положительно заряженные ионы называются катионами, а отрицательно заряженные – анионами.
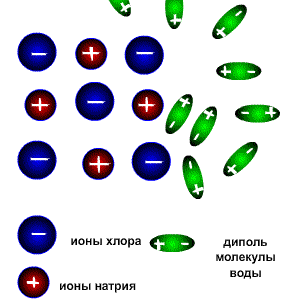
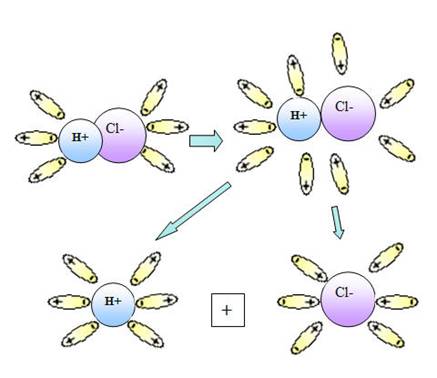
Рис.1. Диссоциация NaCl Рис.2. Диссоциация HCl
При растворении в воде веществ с ковалентной сильнополярной связью, например хлороводорода, происходит изменение характера химической связи. Под влиянием полярных молекул воды ковалентная полярная связь превращается в ионную. Затем ионная связь разрывается и в раствор переходят гидратированные ионы водорода (Н3О+-ион гидроксония) и хлорид-ионы (рис.2).
При расплавлении электролитов усиливаются колебательные движения частиц за счет увеличения их энергии, что приводит к ослаблению связи между ними. В результате чего разрушается кристаллическая решетка.
Для количественной характеристики ЭД используют понятие степень ЭД (α), которая равна отношению числа молекул, распавшихся на ионы к общему числу растворенных молекул. Она измеряется в долях от единицы или в %.
В зависимости от значения степени ЭД электролиты бывают:
- сильные (α →100%): HCl, HNO3, H2SO4, HВr, HI, щелочи, почти все соли;
- слабые (α →0%): H2S, H2CO3, H2SO3, H2SiO3, органические кислоты, нерастворимые основания , гидроксид аммония.
Вопросы:
1. Как вы думаете, будут ли электролиты диссоциировать на ионы при растворении их в керосине?
2. Назовите основные причины диссоциации электролитов на ионы при растворении их в воде и расплавлении.
3. В чем отличие диссоциации веществ с ковалентной полярной связью от диссоциации веществ с ионной связью?
| Основные положения ТЭД | |
| Электролиты и неэлектролиты Электролитическая диссоциация Диполь, Гидратированный ион Гидратация Катионы и анионы Степень ЭД Слабые и сильные электролиты | 1.Электролиты при растворении в воде или расплавлении диссоциируют на ионы. 2. В водных растворах ионы связаны с молекулами воды, т.е. гидратированы. 3. Диссоциация – обратимый процесс. 4. Ионы в электрическом поле движутся направленно: (+)-заряженные – к катоду (катионы, (-)-заряженные – к аноду (анионы). |
Приложение 2
Используемые ресурсы:
Здесь представлен конспект к уроку на тему «Теория электролитической диссоциации», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (11 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

