Конспект урока «Аммиак» по химии для 9 класса
МБОУ Нижнеангарская средняя общеобразовательная школа №1.
Открытый урок по теме «Аммиак»
9 «Б» класс.
Учитель Живоглядова Валентина Михайловна.

08.12.2011г. п. Нижнеангарск. Северобайкальския район. Р. Бурятия.
08.12.2011г.
Цели урока: Повторить тему «Азот», изученную на прошлом уроке. Рассмотреть строение молекулы аммиака. Познакомиться с водородной связью. Получить аммиак (практическая работа №3). Изучить свойства аммиака. Рассмотреть механизм образования донорно – акцепторной связи.
Оборудование: учебник 9 класса, рабочее место ученика, раздаточный материал, фарфоровая ступка, пестик, пробирки, стакан с водой, газоотводная трубка, фенолфталеин, индикаторная бумага, NH4Cl, Ca(OH)2, HCl, спиртовка, спички.
План урока.
-
Орг. часть.
-
Повторение.
-
Изучение темы «Аммиак».
-
Практическая работа №3.
-
Закрепление изученного материала.
-
Подведение итогов урока.
2. Повторение.
a). Устно.
-
В каком виде азот встречается в природе?
-
Какова роль азота в природе?
-
Физические свойства азота?
-
Положение азота в периодической системе.
-
Степени окисления азота.
в). Письменно (карточки).
№ 1. Дать оценку реакции по всем изученным нами признакам
2NO + O2 ↔2 NO2 +Q
№ 2. N2→NO→NO2→HNO3
№ 3. Укажите степени окисления азота в соединениях: N2, NO, NO2, HNO3.
3.Тема урока: Аммиак.
Изучение нового материала. (Работа по дополнению и заполнению таблицы, начатой на прошлом уроке).
1.Что мы знаем о веществе « аммиак»?
2.Строение молекулы аммиака NH3. Электронная, структурная формулы.
3.Пространственное строение молекулы.

4. Водородная связь.
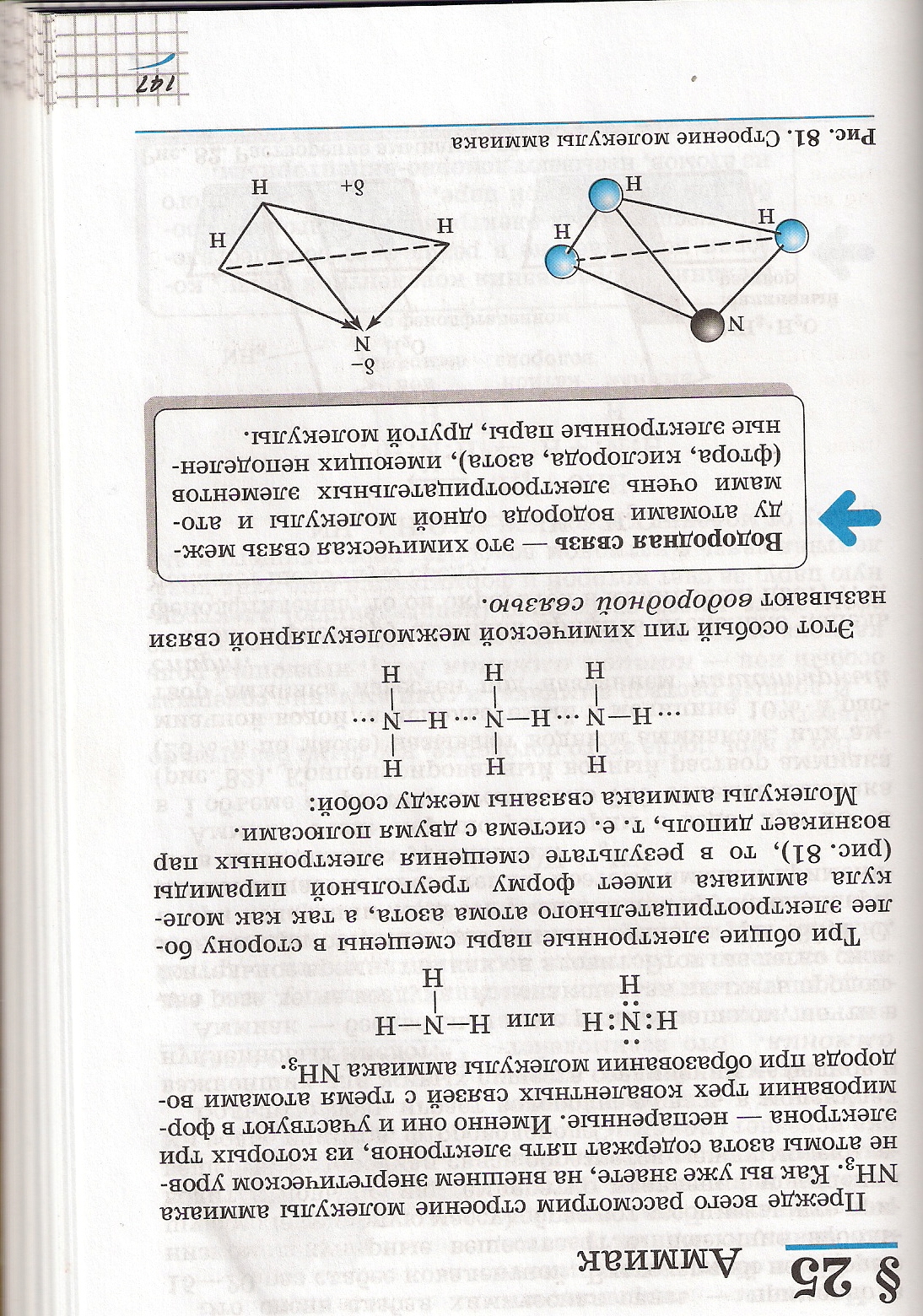
5. Физические свойства аммиака. (Продолжение заполнения таблицы)
6. Химические свойства аммиака. (Продолжение заполнения таблицы)
-
Взаимодействие с водой: NH3 + H2O = NH4OH
NH3 + H2O = NH4 + + OH-
-
Взаимодействие с кислотами: NH3 + HCl = NH4CL
NH3 + HCl = NH4 + + CL-
2NH3 + H2SO4 = (NH4)2SO4
Ион аммония - NH4 +
-
Образование донорно – акцепторной связи. Учебник, стр. 49.
-
Горение аммиака. 4 NH3 +3O2 = 2N2 + 6H2O
-
Каталистическое окисление аммиака. 4 NH3 +5O2 = 4NO+ 6H2O
Катализатор платина -Pt, родий -Rh.
-
Какова роль катализатора в данном процессе?
7.Получение аммиака.
-
N2 + 3H2 = 2NH3 + Q
-
Соль аммония + гашеная известь или щелочь
-
Разложение соли аммония при нагревании.
Практическая работа №3.
Пояснение учителя.
а. Заполнение бланков. (Работа в паре.)
в. Отвечаем на вопросы и выполняем задания, указанные в бланке.
с. Сдаем учителю на проверку.
Практическая работа №3. «Получение аммиака и опыты с ним».
Оборудование: фарфоровая ступка, пестик, пробирки, стакан с водой, газоотводная трубка, фенолфталеин, индикаторная бумага, Ca(OH)2, NH4Cl, HCl, спиртовка, спички.
Цель работы: получить газ аммиак, подтвердить его растворимость в воде, провести эксперимент с полученной аммиачной водой, выполнить задания.
Вариант №3.
1.Пользуясь описанием опыта и инструкцией учителя соберите прибор.

а. Закрепите его в штативе, подготовьте спиртовку.
в. Приготовьте реагирующюю смесь: Ca(OH)2 + NH4Cl, поместите ее в пробирку.
с. Подготовьте прибор к работе.
д. Получите газ аммиак, подтвердите его наличие.
2.Наблюдения:
а. Аммиак ___________________________запах.
в. Аммиак______________________________в воде.
с. В результате реакции образовался (Напишите молекулярное уравнение)
Ca(OH)2 + NH4Cl = __________________________________________________________________
3. Подтвердите получение аммиака.___________________________________________________
4. Проведите реакцию взаимодействия: NH4OH + HCl =___________________________________
5.? Можно ли собрать аммиак методом вытеснения воды? (ДА, НЕТ) Подчеркнуть.
Практическая работа №3. «Получение аммиака и опыты с ним».
Оборудование: фарфоровая ступка, пестик, пробирки, стакан с водой, газоотводная трубка, фенолфталеин, индикаторная бумага, Ca(OH)2, NH4Cl, HCl, спиртовка, спички.
Цель работы: получить газ аммиак, подтвердить его растворимость в воде, провести эксперимент с полученной аммиачной водой, выполнить задания.
Вариант №2.
1.Пользуясь описанием опыта и инструкцией учителя соберите прибор.

а. Закрепите его в штативе, подготовьте спиртовку.
в. Приготовьте реагирующюю смесь: Ca(OH)2 + NH4Cl, поместите ее в пробирку.
с. Подготовьте прибор к работе.
д. Получите газ аммиак, подтвердите его наличие.
2.Наблюдения:
а. Аммиак ___________________________запах.
в. Аммиак______________________________в воде.
с. В результате реакции образовался (Напишите молекулярное уравнение)________________________________________________________________________
д. Напишите уравнение реакции в электронном виде.______________________________________________________________________________
3. Подтвердите получение аммиака.___________________________________________________
4. Проведите реакцию взаимодействия: NH4OH + HCl =___________________________________
5.? Можно ли собрать аммиак методом вытеснения воды? Поясните. _____________________
Практическая работа №3. «Получение аммиака и опыты с ним».
Оборудование: фарфоровая ступка, пестик, пробирки, стакан с водой, газоотводная трубка, фенолфталеин, индикаторная бумага, Ca(OH)2, NH4Cl, HCl, спиртовка, спички.
Цель работы: получить газ аммиак, подтвердить его растворимость в воде, провести эксперимент с полученной аммиачной водой, выполнить задания.
Вариант №1.
1.Пользуясь описанием опыта и инструкцией учителя соберите прибор.

а. Закрепите его в штативе, подготовьте спиртовку.
в. Приготовьте реагирующюю смесь: Ca(OH)2 + NH4Cl, поместите ее в пробирку.
с. Подготовьте прибор к работе.
д. Получите газ аммиак, подтвердите его наличие.
2.Наблюдения:
а. Аммиак ___________________________запах.
в. Аммиак______________________________в воде.
с. В результате реакции образовался (Напишите молекулярное уравнение)___________________________________________________________________________
д. Напишите уравнение реакции в электронном виде.________________________________________________________________________________
е. Укажите типы химической связи в молекулах:
NH4OH_______________________________________________________________________________
NH4Cl________________________________________________________________________________
3. Подтвердите получение аммиака.______________________________________________________
4. Проведите реакцию взаимодействия: NH4OH + HCl =_____________________________________,
поясните тип проведенной реакции______________________________________________________
5.? Можно ли собрать аммиак методом вытеснения воздуха, если пробирка расположена дном вниз? ДА. НЕТ. (Подчеркнуть)
8, 9. Демонстрация электронной презентации по азоту и аммиаку. Проверка лабораторной работы.
10.Отвечаем на вопросы - 3 варианта.
Вопросы для повторения.
| 2 вариант. | 1 вариант | |
| 1.В 3-х колбах содержатся газы: азот, кислород и аммиак. Можно ли их распознать при помощи воды? 2.К физическим свойствам аммиака относятся:
3.Азот входит в состав белков. Каким образом его усваивает живой организм?
| 1.Почему при собирании аммиака методом вытеснения воздуха пробирку держат вверх дном? 2.Степень окисления азота в молекуле аммиака равна:
3.Число электронов у азота:
| 1.В весенний период необходимо внести в почву известь и сульфат аммония. Можно ли их вносить в почву совместно? 2.Сумма коэффициентов в уравнении получения аммиака равна:
3.Донорно – акцепторная связь в ионе аммония образуется за счет:
|
11. Проверяем свои ответы.
| 2 вариант. | 1 вариант | |
| 1.В 3-х колбах содержатся газы: азот, кислород и аммиак. Можно ли их распознать при помощи воды? (Да, аммиак растворим в воде) 2.К физическим свойствам аммиака относятся: a.Наличие запаха. b.Растворимость в воде. c.Наличие ковалентных связей. d.Отсутствие цвета. 3.Азот входит в состав белков. Каким образом его усваивает живой организм? a.Вдыхает. b.Потребляет нашатырный спирт. c.Получает с пищей. d.Содержит клубеньковые бактерии. | 1.Почему при собирании аммиака методом вытеснения воздуха пробирку держат вверх дном? (Он легче воздуха) 2.Степень окисления азота в молекуле аммиака равна: a. +3. b. -1. c. -3. d. +5. 3.Число электронов у азота: a.5. b.7. c.3. d.8. | 1.В весенний период необходимо внести в почву известь и сульфат аммония. Можно ли их вносить в почву совместно? (NO). 2.Сумма коэффициентов в уравнении получения аммиака равна: a.8. b.5. c.9. d.3. 3.Донорно – акцепторная связь в ионе аммония образуется за счет: a. Ковалентной свази. b. Неподеленной пары электронов. c. В присутствии катализатора. d. Свободной пара электронов у атома азота. |
12. Что нового изучили на уроке?
13. Подведение итогов урока.
14. Домашнее задание:§ 17.
Здесь представлен конспект к уроку на тему «Аммиак», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

