Конспект урока «Понятие о валентности и степени окисления» по химии для 8 класса
Муниципальное общеобразовательное учреждение
«Средняя общеобразовательная школа №13»
КОНСПЕКТ УРОКА
«Понятие о валентности и степени окисления»
8 класс
Выполнила: учитель химии
МОУ «СОШ № 13»
н.п. Высокий
Гнездилова Юлия Владимировна
н.п. Высокий
2013 г.
Пояснительная записка
Автор конспекта урока по теме «Понятие о валентности и степени окисления» учитель химии Гнездилова Юлия Владимировна. Данный урок составлена на основе Примерной программы основного общего образования по химии, соответствующей федеральному компоненту государственного стандарта основного общего образования 2004г. Урок предназначен для учащихся 8 класса. Данный урок по примерной программе изучается в блоке «Вещество». Для изучения данного материала используется учебник О.С. Габриелян «Химия 8 класс».
Цель урока:
создать условия для осознанного усвоения учащимися знаний о степени окисления и валентности.
Задачи урока:
Образовательные:
- Дать первоначальное понятие о степени окисления.
- Уметь определить степени окисления элементов.
- Научить составлять формулы бинарных соединений по степени окисления.
- Познакомить с началами номенклатуры химических соединений;
-развитие устойчивого интереса у учащихся к изучению химии
Развивающая:
Развитие аналитического мышления, способность делать выводы.
Воспитательные:
Воспитание положительного отношения к знаниям
План урока:
-
Организационно-мотивационная часть.
-
Актуализация знаний.
-
Изучение нового материала.
-
Закрепление изученного материала.
-
Рефлексия.
-
Домашнее задание.
Тип урока: изучение нового материала
Оборудование: компьютер, проектор, Периодическая система химических элементов Д.И. Менделеева.
Методы и методические приемы: словесные, наглядные, самостоятельная работа.
Ход урока:
-
Организационно-мотивационная часть
- организационный момент
- цель урока
2. Актуализация
Повторение и обобщение пройденного материала (карточки)
А) Индивидуальный опрос по дом. зад.( у доски)
1-й ученик. Указать вид химической связи Н2 Н2S NH3 LiF NaCl
2-й ученик Чем отличается аморфные вещества от кристаллических
Б) Фронтальный опрос класса
1.Какие виды химической связи вы знаете?
2.Дайте определение ковалентной связи. Как она образуется? Ее виды.
3.Что называется ионной связью? Как она образуется?
4. Где образуется металлическая связь?
В) Тест
1.Химическая связь в молекуле Br2
1) ионная
2) металлическая
3) ковалентная неполярная
4) ковалентная полярная
2.Наиболее ярко выражены металлические свойства у
1) Li
2) K
3) Na
4) Rb
3. Формула вещества с ковалентной неполярной связью
1) Н2О 2)Br2 3)SO3 4) NaCl
4. Кристаллическая решетка твердого оксида углерода (IV) CO2
1) ионная 2) атомная 3)молекулярная 4) металлическая
5. Ионную кристаллическую имеет
1) фторид натрия 2) вода 3) серебро 4) бром
3. Изучение нового материала.
1. Объяснение учителя. Постановка проблемы. Понятие о валентности.
– До сих пор мы пользовались готовыми формулами, приведёнными в учебнике. Химические формулы можно вывести на основании данных о составе веществ. Но чаще всего при составлении химических формул учитываются закономерности, которым подчиняются элементы, соединяясь между собой.
(слайд 2)Задание: сравните качественный и количественный состав в молекулах: HCl , H2O, NH3, CH4. Беседа с учащимися:
– Что общего в составе молекул? Предполагаемый ответ: Наличие атомов водорода. – Чем они отличаются друг от друга? Предполагаемый ответ:
HCl – один атом хлора удерживает один атом водорода,
H2O – один атом кислорода удерживает два атома водорода,
NH3 – один атом азота удерживает три атома водорода,
CH4 – один атом углерода удерживает четыре атома водорода. Демонстрация шаростержневых моделей. Проблема: Почему различные атомы удерживают различное количество атомов водорода? (Выслушиваем варианты ответов учащихся).
Вывод: У атомов разная способность удерживать определённое количество других атомов в соединениях. Это и называется валентностью. Слово “валентность” происходит от лат. valentia – сила. Запись в тетради:
(слайд 3)Валентность – это свойство атомов удерживать определённое число других атомов в соединении.
Валентность обозначается римскими цифрами. Записи на доске и в тетрадях:
(слайд 4)HCl I I
H2O I II
H3N I III
H4C I IV
Валентность атома водорода принята за единицу, а у кислорода – II.
Определение валентности атомов элементов в соединениях.
Правило определения валентности: число единиц валентностей всех атомов одного элемента равно числу единиц валентности всех атомов другого элемента. (слайд 5)
Правила определения валентности
элементов в соединениях
1. Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - Nгруппы.
5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
-
Валентность может быть постоянной или переменной. (слайд 6)

Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
Запомните!
(слайд 7)Особенности составления химических формул соединений.
1) Низшую валентность проявляет тот элемент, который находится в таблице Д.И.Менделеева правее и выше, а высшую валентность – элемент, расположенный левее и ниже.
Например, в соединении с кислородом сера проявляет высшую валентность VI, а кислород – низшую II. Таким образом, формула оксида серы будет SO3.
В соединении кремния с углеродом первый проявляет высшую валентность IV, а второй – низшую IV. Значит, формула – SiC. Это карбид кремния, основа огнеупорных и абразивных материалов.
2) Атом металла стоит в формуле на первое место.
2) В формулах соединений атом неметалла, проявляющий низшую валентность, всегда стоит на втором месте, а название такого соединения оканчивается на «ид».
Например, СаО – оксид кальция, NaCl – хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых соединений металлов с неметаллами.
2. (слайд 8)Степень окисления – это условный заряд, который получает атом в результате полной отдачи (принятия) электронов, исходя из условия, что все связи в соединении ионные.
Рассмотрим строение атомов фтора и натрия:
F +9 )2)7
Na +11 )2)8)1
- Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
- Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?
- Оба атома имеют незавершённый внешний уровень?
- Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
F0 + 1ē → F-1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион)
Na0 – 1ē → Na+1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион) (слайд 9)

- Процесс отдачи электронов атомом, называется окислением.
- Атом, отдающий электроны и повышающий свою степень окисления, окисляется и называется восстановителем.
- Процесс принятия электронов атомом, называетсявосстановлением.
- Атом, принимающий электроны и понижающий свою степень окисления, восстанавливается и называется окислителем.
(слайд 10)
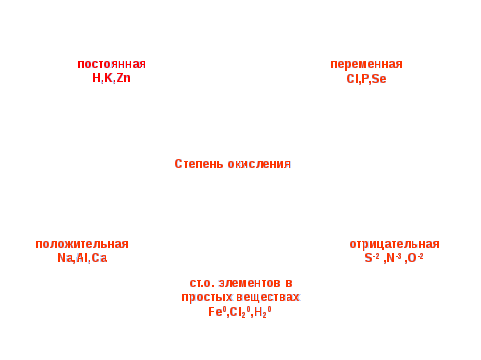
(слайд 11)Правила определения с.о.
-
С.о. атомов в простых веществах = 0
-
С.о. фтора = -1
-
С.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
-
С.о. водорода = +1 (кроме МеН-1)
-
С.о.Ме I, II, III групп = номеру группы
-
С.о неМе «+» = номеру группы
-
С.о. неМе «-» = 8 – номер группы
(слайд 12) Возможные с.о.
-
Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру группы
-
Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы
-
Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
(сайд 13) Промежуточные с.о.
-
Рассмотрим возможные с.о. серы – S
-
Максимальная +6 SO3
-
Минимальная -2 H2S
-
Сера может проявлять с.о. 0,+2,+4 – это промежуточные с.о.
(слайд 14) Какие степени окисления у серы?

(слайд 15) Определение с.о.
N2O3
На первом месте стоит элемент с «+» с.о., на втором с «-»
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
4. Закрепление изученного материала.
(слайд 16) 1. Определите С.О. по формулам
Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
(слайд 17) 2. Упражнение: определить валентность элементов в веществах (тренажёр: ученики цепочкой выходят к доске).SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl, HBr, Cl2O5, Cl2O7, РН3, K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
(слайд 18) 3. Определите степени окисления атомов в формулах веществ:Br2, CaO , SiO 2, H 2 CO 3 , CuO , Cu 2O , H 2 , KNO 3 , FeO , Fe , Fe 2 O 3, Fe(OH)2, Fe2(SO4)3, N2, HClO4
5. Рефлексия
Подведение итогов урока. Беседа с учащимися: Какую проблему мы поставили в начале урока? К какому выводу мы пришли? Дать определение “валентности”, «степени окисления». Чему равна валентность и степень окисления атома водорода? Кислорода? Как определить валентность и степень окисления атома в соединении? Оценка работы учащихся в целом и отдельных учащихся.
6. Домашнее задание
(слайд 19) §17, упр. 1,2
Список используемых источников:
-
Габриелян О.С. Химия-8: учебник для общеобразовательного учреждения – М.: «Дрофа», 2010- стр. 267.
-
Габриелян, О.С. Химия-8: настольная книга учителя [Текст] / О.С.Габриелян. – М.: Дрофа, 2006.
-
Методическое пособие для учителя (Габриелян О.С.. Программа курса химии для 8-11 классов общеобразовательных учреждений – М.: Дрофа, 2008. – 78 с.)
-
Образовательная коллекция. Химия- базовый курс, 8-9 класс. Лаборатория систем мультимедиа МарГТУ, 2001, 2003.
Здесь представлен конспект к уроку на тему «Понятие о валентности и степени окисления», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

