Конспект урока «Понятие о скорости химической реакции. Катализаторы. Химическое равновесие» по химии
Дата_____________ Класс_______________
Тема: Понятие о скорости химической реакции. Катализаторы. Химическое равновесие
Цели урока: повторить и закрепить знания об обратимых реакциях, химическом равновесии; сформировать представления о катализаторах и катализе.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала
Вы знакомы с понятием "скорость" из курса физики. В общем виде скорость - это величина, показывающая как изменяется какая либо характеристика за единицу времени.
Скорость химической реакции - это величина, показывающая как изменяются концентрации исходных веществ или продуктов реакции за единицу времени.
Для оценки скорости необходимо изменение концентрации одного из веществ.
1. Наибольший интерес представляют реакции, протекающие в однородной (гомогенной) среде.
Гомогенные системы (однородные) – газ/газ, жидкость/жидкость – реакции идут во всём объёме.
Математически скорость химической гомогенной реакции можно представить с помощью формулы:
2. Для гетерогенной реакции, скорость реакции определяется числом молей веществ, вступивших в или образующихся в результате реакции в единицу времени на единице поверхности:

Гетерогенные (неоднородные) системы – твёрдое/жидкость, газ/твёрдое, жидкость/газ – реакции идут на поверхности раздела фаз.
Таким образом, скорость химической реакции показывает изменение количества вещества в единицу времени, в единице объёма или на единице поверхности раздела фаз.
Зависимость скорости реакций от различных факторов
| Примеры | |
| концентрация | Закон действующих масс Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением. aA +bB = cC + dD, где A,B,C,D – газы, жидкости Для данной реакции кинетическое уравнение принимает вид:
Причиной повышения скорости является увеличение числа столкновений реагирующих частиц за счёт увеличения частиц в единице объёма. |
| температура | Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа : при повышении температуры на каждые 10°С скорость реакции увеличивается в 2-4 раза.
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. |
| катализатор | Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождаются в конце реакции. Ингибитор - вещество, замедляющее скорость реакции |
| площадь соприкосновения реагирующих веществ | Для увеличения площади соприкосновения реагирующих веществ, их измельчают. Наибольшей степени измельчения достигают путем растворения веществ. Быстрее всего вещества реагируют в растворах. |
| природа реагирующих веществ | Например, металлы магний и железо реагируют с соляной кислотой одинаковой концентрации с различной скоростью. Это связано с разной химической активностью металлов. |
1. Среди всех известных реакций различают реакции обратимые и необратимые. При изучении реакций ионного обмена были перечислены условия, при которых они протекают до конца. (вспомните их).
Известны и такие реакции, которые при данных условиях до конца не идут. Так, например, при растворении в воде сернистого газа происходит реакция: SO2 + H2O → H2SO3. Но оказывается, что в водном растворе может образоваться только определенное количество сернистой кислоты. Это объясняется тем, что сернистая кислота непрочная, и происходит обратная реакция, т.е. разложение на оксид серы и воду. Следовательно, данная реакция не идет до конца потому, что одновременно происходит две реакции – прямая (между оксидом серы и водой) и обратная(разложение сернистой кислоты). SO2 + H2O ↔ H2SO3.
Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях, называются обратимыми.
2. Поскольку скорость химических реакций зависит от концентрации реагирующих веществ, то вначале скорость прямой реакции (υпр ) должна быть максимальной, а скорость обратной реакции (υобр) равняется нулю. Концентрация реагирующих веществ с течением времени уменьшается, а концентрация продуктов реакции увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. В определенный момент времени скорость прямой и обратной реакций становятся равными:
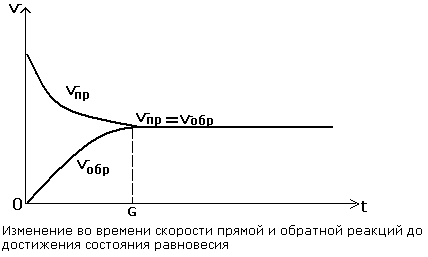
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия:
υпр = υобр
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
В состоянии химического равновесия количественное соотношение между реагирующими веществами и продуктами реакции остается постоянным: сколько молекул продукта реакции в единицу времени образуется, столько их и разлагается. Однако состояние химического равновесия сохраняется до тех пор, пока остаются неизменными условия реакции: концентрация, температура и давление.
Количественно состояние химического равновесия описывается законом действующих масс.
При равновесии отношение произведения концентраций продуктов реакции (в степенях их коэффициентов) к произведению концентраций реагентов (тоже в степенях их коэффициентов) есть величина постоянная, не зависящая от исходных концентраций веществ в реакционной смеси.
Эта постоянная величина называется константой равновесия - k
Так для реакции: N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж константа равновесия выражается так:
υ1 = υ2
υ1 (прямой реакции) = k1[N2][H2]3 , где [] – равновесные молярные концентрации, [] = моль/л
υ2 (обратной реакции) = k2 [NH3]2
k1[N2][H2]3 = k2 [NH3]2
Kp = k1/k2 = [NH3]2/ [N2][H2]3 – константа равновесия.
Химическое равновесие зависит – от концентрации, давления, температуры.
Принцип Ле-Шателье определяет направление смешения равновесия:
Если на систему, находящуюся в равновесии оказали внешнее воздействие, то равновесие в системе сместится в сторону обратную этому воздействию.
1) Влияние концентрации – если увеличить концентрацию исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
Например, Kp = k1/k2 = [NH3]2/ [N2][H2]3
При добавлении в реакционную смесь, например азота, т.е. возрастает концентрация реагента, знаменатель в выражении для К увеличивается, но так как К – константа, то для выполнения этого условия должен увеличиться и числитель. Таким образом, в реакционной смеси возрастает количество продукта реакции. В таком случае говорят о смещении химического равновесия вправо, в сторону продукта.
Таким образом, увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции. Увеличение концентрации продуктов (жидких или газообразных) смещает равновесие в сторону реагентов, т.е. в сторону обратной реакции.
Изменение массы твердого вещества не изменяет положение равновесия.
2) Влияние температуры – увеличение температуры смещает равновесие в сторону эндотермической реакции.
а) N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г) + 92,4 кДж (экзотермическая – выделение тепла)
При повышении температуры равновесие сместится в сторону реакции разложения аммиака (←)
б) N2 (Г) + O2 (Г) ↔ 2NO (Г) – 180,8 кДж (эндотермическая - поглощение тепла)
При повышении температуры равновесие сместится в сторону реакции образования NO (→)
3) Влияние давления (только для газообразных веществ) – при увеличении давления, равновесие смещается в сторону образования веществ, занимающих меньший объём.
N2 (Г) + 3H2 (Г) ↔ 2NH3 (Г)
1V - N2
3V - H2
2V – NH3
При повышении давления (P): до реакции 4V газообразных веществ → после реакции 2V газообразных веществ, следовательно, равновесие смещается вправо (→)
При увеличении давления, например, в 2 раза, объём газов уменьшается в такое же количество раз, а следовательно, концентрации всех газообразных веществ возрастут в 2 раза. Kp = k1/k2 = [NH3]2/ [N2][H2]3
В этом случае числитель выражения для К увеличится в 4 раза, а знаменатель в 16раз, т.е. равенство нарушится. Для его восстановления должны возрасти концентрация аммиака и уменьшиться концентрации азота и водорода. Равновесие сместится вправо.
Итак, при повышении давления равновесие смещается в сторону уменьшения объема, при понижении давления – в сторону увеличения объёма.
Изменение давления практически не сказывается на объёме твердых и жидких веществ, т.е. не изменяет их концентрацию. Следовательно, равновесие реакций, в которых газы не участвуют, практически не зависит от давления.
! На течение химической реакции влияют вещества – катализаторы. Но при использовании катализатора понижается энергия активации как прямой, так и обратной реакции на одну и ту же величину и поэтому равновесие не смещается.
3. Закрепление изученного материала
Задача
Укажите, как повлияет:
а) повышение давления;
б) повышение температуры;
в) увеличение концентрации кислорода на равновесие системы:
2CO (г) + O2 (г) ↔ 2CO2 (г) + Q
Решение:
а) Изменение давления смещает равновесие реакций с участием газообразных веществ (г). Определим объёмы газообразных веществ до и после реакции по стехиометрическим коэффициентам:
По принципу Ле Шателье, при увеличении давления, равновесие смещается в сторону образования веществ, занимающих меньший объём, следовательно равновесие сместится вправо, т.е. в сторону образования СО2, в сторону прямой реакции (→).
б) По принципу Ле Шателье, при повышении температуры, равновесие смещается в сторону эндотермической реакции (-Q), т.е. в сторону обратной реакции – реакции разложения СО2 (←), т.к. по закону сохранения энергии:
Q - 2CO (г) + O2 (г) ↔ 2CO2 (г) + Q
в) При увеличении концентрации кислорода равновесие системы смещается в сторону получения СО2 (→) т.к. увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции.
4. Домашнее задание.
П.14,
Выполнить задание по парам
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе:
2SO2(г) + O2(г) = 2SO3(г)
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]= a, [О2] = b,[SO3] = с. Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема:
vпр = Ка2b
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b;[SO3] = 3с. При новых концентрациях скорости v’ прямой и обратной реакции:
v’пр = К(3а)2(3b) = 27Ка2b
v’обр = К1(3с)2 = 9К1с2
Отсюда:
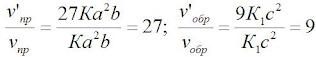
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образованияSO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70оС, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
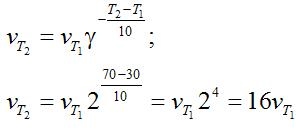
Следовательно, скорость реакции νТ2 при температуре 70оС больше скорости реакции νТ1 при температуре 30оС в 16 раз.
Пример 3. Константа равновесия гомогенной системы:
СО(г) + Н2О(г) = СО2(г) + Н2(г)
при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх =3 моль/л, [Н2О]исх = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
vпр = К1 [СО][Н2О]
vобр = К2[СО2][Н2]
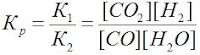
В условии задачи даны исходные концентрации, тогда как в выражение Крвходят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ:
[СО2]р = [Н2]р = х моль/л;
[СО]р = (3 – х) моль/л;
[Н2О]р = (2 – х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
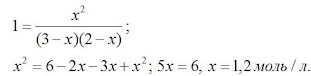
Таким образом, искомые равновесные концентрации:
[СО2]р = 1,2 моль/л;
[Н2]р= 1,2 моль/л;
[СО]р = 3 – 1,2 = 1,8 моль/л;
[Н2О]р = 2 – 1,2 = 0,8 моль/л.
Здесь представлен конспект к уроку на тему «Понятие о скорости химической реакции. Катализаторы. Химическое равновесие», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.



