Конспект урока «ВАЛЕНТНОСТЬ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ» по химии для 8 класса
Методическая разработка
-
Ф.И.О. автор
Шурыгина Валентина Сергеевна
-
Место работы
МБСКОУ СКОШ № 34 VII вида
г. Озерск, Челябинской области
-
Должность
Учитель химии
УРОК ХИМИИ В 8 КЛАССЕ
«ВАЛЕНТНОСТЬ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ»
Цель урока:
-
изучить, что такое валентность;
-
научиться определять валентность в бинарных соединениях по водороду и кислороду.
Формируемые химические знания, умения и навыки учащихся:
валентность, определение валентности химического элемента по химической формуле бинарных соединений.
Оборудование: таблицы:
«Периодическая система химических элементов Д.И.Менделеева», «Валентность химических элементов», «Номенклатура бинарных соединений», набор шариков и стержней.
ХОД УРОКА
I. Организационный момент. Подготовка учащихся к работе на уроке.
II. Повторение пройденного материала.
-
Проверка домашнего задания упр.2 к §2.5.
-
Вопросы и задания
1). Запишите, используя символы химических элементов:
а) атом кислорода; б) одну молекулу кислорода, состоящую из двух атомов кислорода; в) одну молекулу воды, состоящую из двух атомов водорода и одного атома кислорода.
2). (Для устных ответов) Что означают следующие записи:
а) 2О; б) О2 ; в) 4О2 ; г) Н2О; д) 3Н2О ?![]()
3). Составьте химическую формулу вещества метана. Отношение атомов углерода и водорода в его молекуле равно 1:4.
III. Изучение нового материала.
Можно ли составить формулу вещества, не зная соотношения атомов в молекуле? Можно, если усвоить такое важное понятие, как валентность. Что же это такое?
Учитель на доске записывает тему урока.
-
Валентность атомов химических элементов.
Атомы химических элементов имеют особое природное свойство — они могут удерживать только определенное число атомов других элементов.
Валентность (от латинского слова valentia-сила) характеризует это свойство атомов присоединять определенное число атомов других химических элементов. (Запись в тетради). «Валентность — способность атомов химических элементов присоединять определенное число атомов других элементов».
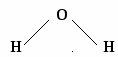 Любая молекула состоит из атомов, которые связаны между собой какими-либо силами. Например, в молекуле воды (Н2О) атомы связаны следующим образом
Любая молекула состоит из атомов, которые связаны между собой какими-либо силами. Например, в молекуле воды (Н2О) атомы связаны следующим образом
Мы видим, атом кислорода связан с двумя атомами водорода, а каждый атом водорода может образовывать только одну связь с кислородом.
Таким образом, валентность элемента можно представить как число (значение валентности обозначают римскими цифрами), которое показывает, со сколькими атомами одновалентного элемента может соединиться атом этого элемента.
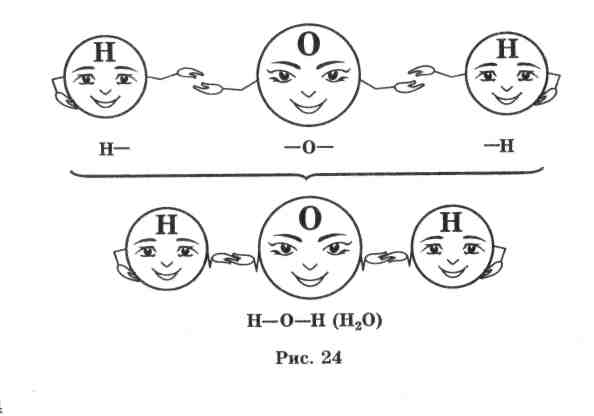
Валентность водорода 1, а кислорода 2. Это значит, что атом кислорода
может удерживать два атома водорода. Вот почему формула воды Н2О.
В сложных веществах атомы разных химических элементов находятся в определенных количественных соотношениях согласно их природному свойству-валентности.
Валентность атомов выражают числом от 1до 8.
Валентность водорода равна I, кислород всегда 2-х валентен.
Принято обозначать валентность римскими цифрами и записывать над химическим знаком в формулах так: I II
Н2О
2. Определение валентности химических элементов в бинарных соединениях, содержащих атомы водорода или кислорода.
Как определить валентность какого-либо химического элемента в сложных веществах по известной валентности другого химического
элемента водорода или кислорода.
Следует помнить два основных правила, с помощью которых легко определить валентность в их соединениях.
-
Валентность водорода принимают за единицу I. В соответствии с формулой воды Н2О валентность кислорода равна II.
Например,
1) НС1, Н2S, Н3Р, СН4; 2) СО2, А12О3, СаО, К2О
Пример 1. В составе этих веществ есть водород, который одновалентен. Валентность элементов, которые с ним соединены, будет равна числу атомов водорода. Валентность хлора, следовательно, равна I, серы - II, фосфора - III, углерода - IV. Запишем ответы римскими цифрами.
I I I II I III IV I
НС1 Н2S Н3Р СН4
1=1 (1∙2)=2 (1∙3)=3 4=(1∙4)
Кислород всегда проявляет в своих соединениях валентность II. Этим правилом необходимо руководствоваться при определении валентности элементов в соединениях с кислородом.
Задание. Определите валентность алюминия в А12О3.
Общее число валентностей атомов одного химического элемента равно общему числу валентностей атомов второго химического элемента.
Вычисляем произведение индекса и известной валентности кислорода, равное 6 (2х3), общее число валентностей атомов алюминия тоже равно 6. Отсюда 2х=6, х=3.
? II
А12О3
2∙х =2∙3 2х=6 х=3
IV. Закрепление.
1. Определите валентность элементов в соединениях с кислородом.
СО2 СаО К2О.
-
Какими правилами необходимо руководствоваться при определении химических элементов в бинарных соединениях, содержащих атомы водорода и кислорода.
-
Дайте определение «Что такое валентность»?
Вставьте пропущенные слова в предложение:
а) Валентность элемента – это способность его атомов присоединять … число атомов других химических элементов.
б) Валентность элемента – это способность его атомов присоединять определенное число атомов ... химических элементов.
б) За единицу валентности принята валентность … .
г) Кислород в своих соединениях всегда проявляет валентность … .
V. Итоги урока.
VI. Домашнее задание $ 11, $ 12, упр. 4, стр. 37 (учебник Г.Е. Рудзитис, Ф.Г. Фельдман. Химия. 8 класс.- М.:»Просвещение», 2009)
Здесь представлен конспект к уроку на тему «ВАЛЕНТНОСТЬ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

