Конспект урока «Скорость химической реакции . Факторы, влияющие на скорость химической реакции» по химии
Тема урока: «Скорость химической реакции . Факторы, влияющие на скорость химической реакции.»
Цели урока:
-актуализировать и углубить знания учащихся о скорости химической реакции в процессе экспериментального изучения;
-используя работу в группах выявить зависимость скорости химических реакций от различных факторов;
-стимулировать познавательную активность учащихся путем создания проблемной ситуации и проведения ими химического эксперимента;
-развивать умение анализировать, делать предположения и выводы.
Задачи:
-рассмотреть влияние различных факторов на скорость гомогенных и гетерогенных химических реакций;
-ввести новые химические понятия: ингибиторы, катализаторы, катализ;
-развивать экспериментальные умения и научное мышление учащихся в процессе установления причинно-следственных связей, сравнения и наблюдения объектов и процессов, сопоставления вариантов эксперимента, применения знаний и умений в новых ситуациях.
Методы обучения:
-объяснительно – иллюстративный.
-частично проблемно- поисковый.
-репродуктивный.
-демонстрационные и лабораторные опыты как метод экспериментальному обучению химии.
Приемы обучения:
-постановка проблемных вопросов;
- групповая работа;
- организация акцентированных наблюдений, выполнение комплексных заданий, составление классификационных схем, обращение к жизненному опыту учащихся.
Средства обучения: химический эксперимент.
Оборудование и реактивы: на столе учителя : штатив с пробирками, растворы сульфата меди(II), хлорида меди(II) и гидроксида калия, железный гвоздь, водные растворы Na2CO3 и CaCl2, раствор гидроксида натрия, фенолфталеин.
На столах учеников – учебники и тетради, штатив с пробирками, спиртовки, пробиркодержатели, пипетки, спички, стеклянные палочки, цинк в гранулах, магниевая лента, железные опилки и гвозди, оксид меди (II), растворы хлорида меди(II), соляной и серной кислот.
Все записи по ходу урока учащиеся выполняют в своих тетрадях.
Ход урока.
1. Изучение нового материала.
Учитель: Химические реакции протекают с различными скоростями. Одни идут медленно, месяцами, как, например, коррозия железа или ферментация (брожение) виноградного сока, в результате которой получается вино. Другие завершаются за несколько недель, как спиртовое брожение глюкозы. Третьи заканчиваются очень быстро, например осаждение нерастворимых солей, а некоторые протекают мгновенно, например взрывы.
Практически мгновенно, очень быстро идут многие реакции в водных растворах:
• смешаем водные растворы Na2CO3 и CaCl2, продукт реакции CaCO3 – нерастворим в воде, образуется немедленно;(демонстрация опыта) (запись уравнения реакции учащимся на доске)
• к щелочному раствору фенолфталеина добавим избыток кислоты, раствор обесцвечивается мгновенно. Это означает, что реакция нейтрализации, реакция превращения окрашенной формы индикатора в бесцветную идут очень быстро.(демонстрация опыта)Запись реакции учеником на доске.
Медленно образуется ржавчина на железных предметах. На медных и бронзовых предметах медленно образуются продукты коррозии черно-коричневого или зеленоватого цвета (патина). Скорость всех этих процессов разная.
Учащиеся сами приводят примеры химических реакций из жизни.
Вопросы для актуализации знаний
1. Какой раздел химии изучает скорости и механизмы химических реакций?
2. Зачем нужны знания о скорости химических реакций?
3. Как определяют скорость механического движения? Какова единица измерения этой скорости?
4. Как определяют скорость химической реакции? Что такое мгновенная и средняя скорости химических реакций?
5. Почему скорость многих химических реакций с течением времени уменьшается?
6. Какие реакции называются: а) гомогенными; б) гетерогенными?
Учитель :Химические реакции — одно из важнейших понятий химии. Химическая термодинамика дает возможность предсказать, в каком направлении может самопроизвольно протекать та или иная химическая реакция, но одна химическая термодинамика не дает ответа на вопрос о том, как и с какой скоростью будет протекать реакция.
Основным понятием в химической кинетике является понятие о скорости реакции.
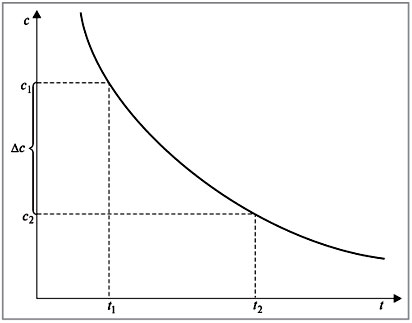
Под скоростью химической реакции понимается изменение концентрации одного из реагирующих веществ или продуктов реакции в единицу времени.
Если концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за промежуток времени от t1 до t2, то в соответствии с определением скорость реакции ![]() равна (рис. 1):
равна (рис. 1):
![]()
Знак «–» в правой части уравнения означает следующее. По мере протекания реакции (t2 – t1) > 0 концентрация реагентов убывает, следовательно, (c2 – c1)
Рис. 1. |
В г о м о г е н н ы х р е а к ц и я х реагирующие вещества находятся в одной газовой фазе или в растворе, равномерно перемешаны между собой, реакция идет по всему объему смеси. Концентрация реагента равна частному от деления количества вещества на объем смеси: с = ![]() /V.
/V.
Средняя скорость реакции:
![]()
Чем меньше промежуток времени, тем более точным будет значение скорости реакции.
Г е т е р о г е н н ы е р е а к ц и и идут на границе раздела фаз: газ – твердое вещество, газ – жидкость, жидкость – твердое вещество, твердое вещество – твердое вещество. Скорость реакции
![]()
измеряется на единице площади соприкосновения реагирующих веществ S.
Учитель: Почему, химические реакции идут с разной скоростью? Вот основной вопрос на который нам предстоит сегодня ответить. Как вы думаете, от чего же зависит скорость химической реакции? (учащиеся предполагают и выдвигают гипотезы)
(Учитель предлагает учащимся разбиться на группы.. После этого начинается работа в группах по выяснению факторов, влияющих на скорость реакции. Каждая группа получает инструкцию, в течение 5 минут проводит эксперимент, описывает полученные результаты, делает выводы (класс разбит на 4 творческие группы по 5-6 человек).
Лабораторный опыт № 1. Зависимость скорости химической реакции от природы реагирующих веществ.
Цель. Закрепить понятие «скорость химической реакции» и выявить ее зависимость от природы реагирующих веществ.
Оборудование и реактивы. Штатив с пробирками; цинк в гранулах, магниевая лента, раствор соляной кислоты.
| Наблюдения | Условия химических реакций | Выводы | |
| Поместите в одну пробирку гранулы цинка, а в другую — кусочек магниевой ленты. Добавьте в пробирки по 1 мл соляной кислоты | В какой пробирке быстрее произошли изменения? | | Какое условие влияет на скорость данной химической реакции? |
Лабораторный опыт №2. Влияние температуры на скорость.
Цель. Закрепить понятие «скорость химической реакции» и исследовать влияние температуры на скорость химической реакции.
Оборудование и реактивы. Штатив с пробирками, пипетка, спиртовка, пробиркодержатель; оксид меди(II), раствор серной кислоты (1:3).
| Наблюдения | Условия химических реакций | Выводы | |
| В две пробирки поместите по одной грануле оксида меди(II) и добавьте по 5—6 капель серной кислоты. Одну пробирку нагрейте | В какой пробирке реакция протекает более интенсивно? По каким признакам вы это определили? | | Какое условие влияет на скорость данной химической реакции? |
Лабораторный опыт № 3. Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ( для гетерогенныхреакций).
Цель. Закрепить понятие «скорость химической реакции» и выявить ее зависимость от величины поверхности соприкосновения реагирующих веществ.
Оборудование и реактивы. Штатив с пробирками, стеклянная палочка; железные опилки, железный гвоздь, раствор хлорида меди(II).
| Наблюдения | Условия химических реакций | Выводы | |
| Поместите в одну пробирку железную проволоку длиной10 мм или гвоздь, а в другую —2—3 стеклянные лопатки железных опилок. Добавьте по 1 мл раствора хлорида меди (П) | В какой пробирке быстрее произошло изменение цвета? | | Какое условие влияет на скорость данной химической реакции? |
Представление результатов групповой работы, их обсуждение.
По истечении отведенного времени представители групп рассказывают о проделанной работе. Учащиеся выступают у доски, используя таблицы, заполненные по результатам проделанных лабораторных опытов. Организуется краткое обсуждение результатов работы групп, формулируются выводы о значении факторов зависимости химических реакций, применении их для управления химических процессов. Учитель добавляет сведения о каждом факторе, учащиеся записывают их в тетрадь. При этом происходит углубление знаний о скорости химической реакции , вводится правило Вант-Гоффа, закон действующих масс, а также понятие о катализаторах и ингибиторах.
Kатализаторы – это вещества, ускоряющие химическую реакцию, ингибиторы – это вещества, замедляющие химическую реакцию. Сами катализаторы и ингибиторы в реакции не расходуются и не входят в состав продуктов реакции.
Kатализ – это процесс изменения скорости реакции под действием катализатора. Действие катализатора избирательно. Реакции, протекающие при участии катализатора, называют каталитическими реакциями.
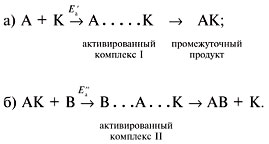
М е х а н и з м г о м о г е н н о г о к а т а л и з а
Часто реакции идут медленно, поэтому необходимо применять катализатор :
А + В ![]() А•••В
А•••В ![]() АВ.
АВ.
Kатализатор (K) ускоряет реакцию:
Правило Я.Г. Вант-Гоффа(1884 г). При повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза.
Чем она выше, тем больше в веществе активных частиц, выше скорости их движения и сильнее соударения, тем большее число соударений приводит к реакции, т. е. возрастает скорость реакции. Так, реакция между водородом и кислородом при t=20о С за 54 млрд. лет протекает на 15%, при 500о С-за 50 минут, при 700о С -мгновенно.
То число, которое показывает во сколько раз увеличивается скорость реакции при повышении температуры на 10 С, называется температурным коэффициентом, обозначается (гамма), измеряется экспериментально для каждой реакции, может быть любым числом от 2 до 4.
Правило Вант-Гоффа математически выражается следующей формулой:
V2=V1γ(t2-t1)/10
4. Закрепление полученных знаний.
Решение задач.
Задача 1. При t = 30 °С реакция протекает за 25 мин, а при t — 50 °С — за 4 мин. Рассчитайте температурный коэффициент реакции.
Задача 2. Взаимодействие алюминия с хлором протекает по уравнению:
2А1 (тв.) + ЗС12(г.) = 2А1С13(тв.).
Начальная концентрация хлора 0,05 моль/л. Константа скорости реакции 0,2 л/(моль • с).
Напишите математическое выражение скорости реакции. Как изменяется скорость реакции по сравнению с начальной, если давление в системе увеличить в 2 раза?
Задача 3. Предложите способы увеличения скорости реакции в 8 раз путем изменения концентраций исходных веществ:
а) 2Са (та.) + 02 (г.) = 2СuО (тв.); б)2Н2(г.) + 02(г.) = 2Н20(г.).
4. Итоги урока .
Учитель подводит итоги урока. Учащиеся оценивают свою работу на уроке.
Учащиеся отвечают на вопросы: 1.В чем польза этого урока для вас? 2. Чем интересен урок для каждого ученика и каждой группы? 3. С какими трудностями вы столкнулись на уроке?
5. Домашнее задание.
Наряду с параграфом учебника № 15 каждая группа получает индивидуальную задачу по изучению влияния того или иного фактора на скорость химической реакции.
Вариант 1
1. Перечислите факторы, влияющие на скорость гомогенных реакций. Охарактеризуйте на конкретных примерах зависимость скорости таких химических реакций от концентрации реагирующих веществ?
2. Как изменится скорость реакции 2А + В = А2B, если а) давление на реагирующую смесь увеличили в 2 раза, предполагая, что реагируют между собой в смеси газы?
3. Вычислите температурный коэффициент реакции, скорость которой возрастает в 40 раз при повышении температуры от 40 до 80 °С.
Вариант 2
1. Перечислите факторы, влияющие на скорость гетерогенных реакций. Охарактеризуйте на конкретных примерах зависимость скорости таких химических реакций от катализаторов?
2. Как изменится скорость реакции А + 2В = АB2, если а) объем реагирующей смеси уменьшили в 2 раза?
3. Во сколько раз возрастет скорость химической реакции, если увеличить температуру с 60 °С до 100 °С? Температурный коэффициент реакции равен 3.
Вариант 3
1. Перечислите факторы, влияющие на скорость гомогенных реакций. Охарактеризуйте на конкретных примерах зависимость скорости таких химических реакций от температуры?
2. Как изменится скорость реакции А2 + 2В2 = 2АB2, если а) концентрации обоих веществ уменьшили в 2 раза?
3. Температурный коэффициент реакции равен 2. Как следует изменить температуру реакционной смеси, чтобы увеличить скорость реакции в 128 раз?
Вариант 4
1.Перечислите факторы, влияющие на скорость гетерогенных реакций. Охарактеризуйте на конкретных примерах зависимость скорости таких химических реакций от природы реагирующих веществ?
2. Как изменится скорость реакции 2А2 + В2 = 2А2B, если а) концентрации обоих веществ увеличили в 2 раза?
3. Срок хранения автомобильных покрышек при температуре 20 °С - 5 лет, а при температуре 10 °С - 13 лет. Сколько лет можно хранить покрышки при 5 °С?
Здесь представлен конспект к уроку на тему «Скорость химической реакции . Факторы, влияющие на скорость химической реакции», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.