Конспект урока «Окислительно-восстановительные реакции» по химии для 8 класса
Санкт-Петербургское государственное автономное
профессиональное образовательное учереждение
« морской технический колледж»
Методические указания
к практической работе по теме:
«Окислительно-восстановительные реакции»
(для студентов дневного отделения)
Дисциплина ХИМИЯ
Автор Бачило Т.П.
Санкт Петербург
2014
Пояснительная записка
Данные методические указания предназначены для студентов 1 курса дневного отделения.
Методические указания содержат краткий теоретический материал по теме:«Окислительно-восстановительные реакции»
При необходимости студенты могут обратиться к следующим источникам информации:
1. Габриелян О.С. Химия: учебник для студ.сред.проф.учеб. заведений
/4 изд./, стер. – М: Издательский центр «Академия», 2008.-336с.
2. Берман Н.И. «Решение типовых задач», ФО «Слово», 1996г., 574с.
Окислительно-восстановительные реакции.
Окислительно-восстановительные процессы идут с изменением степеней окисления элементов, участвующих в них.
Степень окисления – это условный заряд атома, который вычисляется исходя из допущения, что молекула состоит из атомов.
Окислитель – это атом, ион или вещество их содержащее, который принимает электрон.
Восстановитель – это атом, ион или вещество их содержащее, который отдает электрон.
Окисление – это процесс отдачи электронов.
Восстановление – это процесс приема электронов.
Сокращения:
окислитель – о-ль,
восстановитель – в-ль,
окисление – о-ние,
восстановление – в-ние,
окислительно-восстановительные реакции – ОВР,
степень окисления – с.о.
Правила определения степени окисления:
1) С.о. элемента в простом веществе = 0;
2) Максимальная положительная с.о. элемента = номеру группы в которой стоит элемент (исключения- О2+, F0, элементы побочной подгруппы 8 группы);
3) Минимальная степень окисления = 8 – номер группы в которой стоит элемент
( только для элементов главных подгрупп 4-7 групп);
4) Сумма степеней окисления всех элементов в сложном веществе равна 0.
Алгоритм составления уравнений электронного баланса.
![]()
1) Расставить с.о. элементов.
![]()
2) Выписать те элементы, у которых изменились с.о.
 P0P+5
P0P+5
 O02 2O-2
O02 2O-2
3) Электронами сбалансировать разницу в с.о.
![]()
4) Найдите наименьшее общее кратное для количества электронов участвующих в процессе.

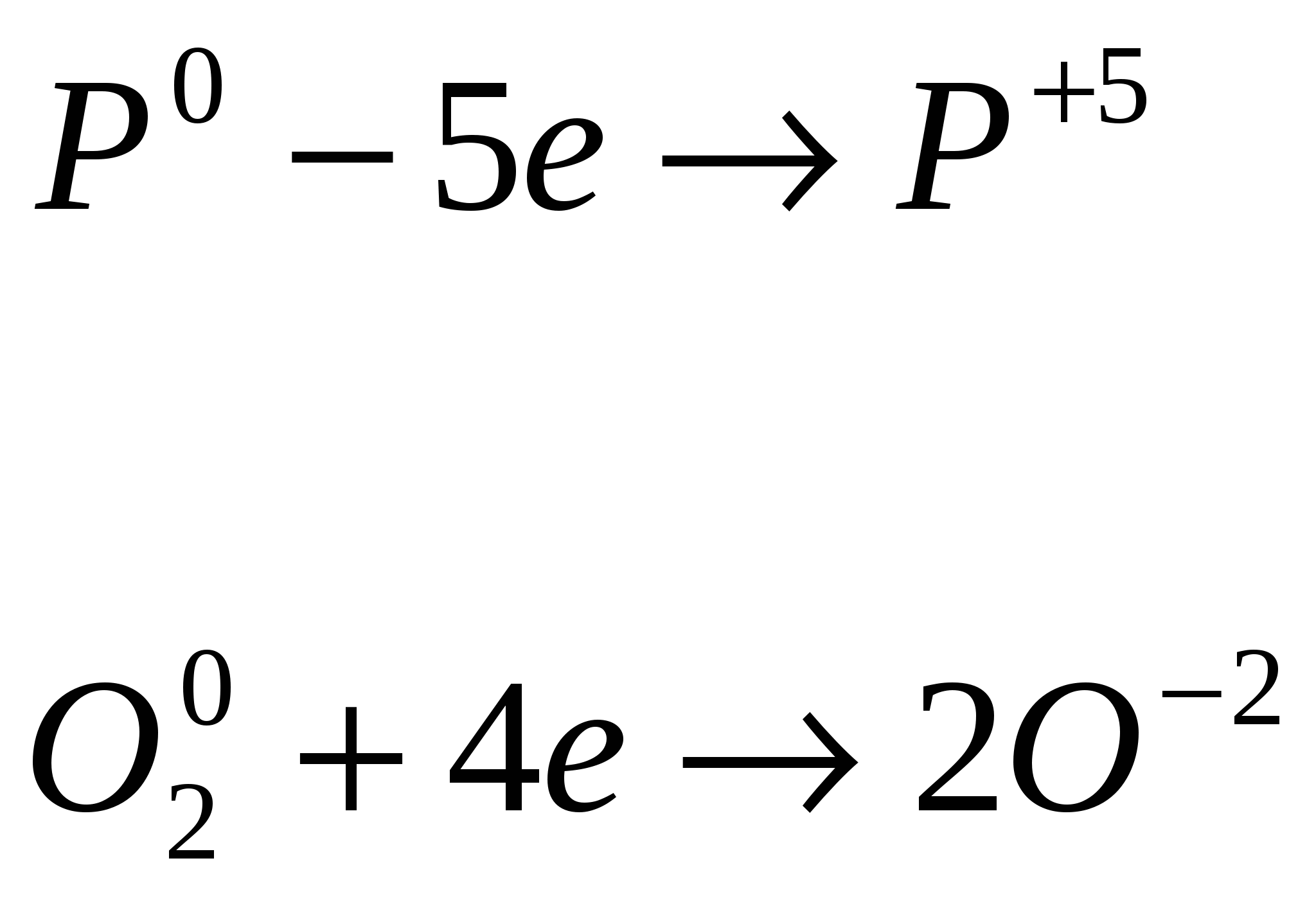 20
20
5) Определить коэффициенты.


![]() 4
4
20
![]() 5
5
6) Уравнять уравнение ОВР.
 4P+5O2 2P2O5
4P+5O2 2P2O5
7) Определить о-ль, в-ль, процессы о-ния, в-ния.


в-ль ![]() 4
4
20
о-ль ![]() 5
5
Практическая работа по теме:
«Уравнения окислительно – восстановительных реакций»
Цель работы:
-
знать определение химического уравнения;
-
понятия: окислитель, восстановитель, окисление, восстановление;
-
уметь: определять значение степени окисления элементов; составлять схему смещения электронов; определять процессы окисления и восстановления; определять функции веществ в окислительно-восстановительных реакциях; расставлять коэффициенты методом электронного баланса;
Задание: из таблицы №1 выбрать по своему варианту номера заданий.
Таблица №1
| № задания | |
| 1 | 1,17,32,77,101,126 |
| 2 | 2,7,18,78,102,127 |
| 3 | 3,9,15,79,103,128 |
| 4 | 4,14,21,80,104,129 |
| 5 | 10,16,30,81,105,130 |
| 6 | 13,24,28,82,106,131 |
| 7 | 19,25,33,83,107,132 |
| 8 | 22,29,40,84,108,133 |
| 9 | 26,38,43,85,109,134 |
| 10 | 23,39,45,86,110,135 |
| 11 | 34,42,46,87,111,136 |
| 12 | 27,37,50,88,112,137 |
| 13 | 35,41,48,89,113,138 |
| 14 | 36,44,51,90,114,139 |
| 15 | 52,49,73,91,115,140 |
| 16 | 53,47,57,92,116,34 |
| 17 | 19,56,72,93,117,54 |
| 18 | 55,64,69,94,118,25 |
| 19 | 58,61,66,95,119,89 |
| 20 | 59,62,67,96,120,90 |
| 21 | 60,63,68,97,121,56 |
| 22 | 65,70,74,98,122,58 |
| 23 | 5,71,75,99,123,66 |
| 24 | 8,31,39,100,124,34 |
| 25 | 11,12,76,90,125,65 |
Расставьте степени окисления атомов, подберите коэффициенты методом электронного баланса.

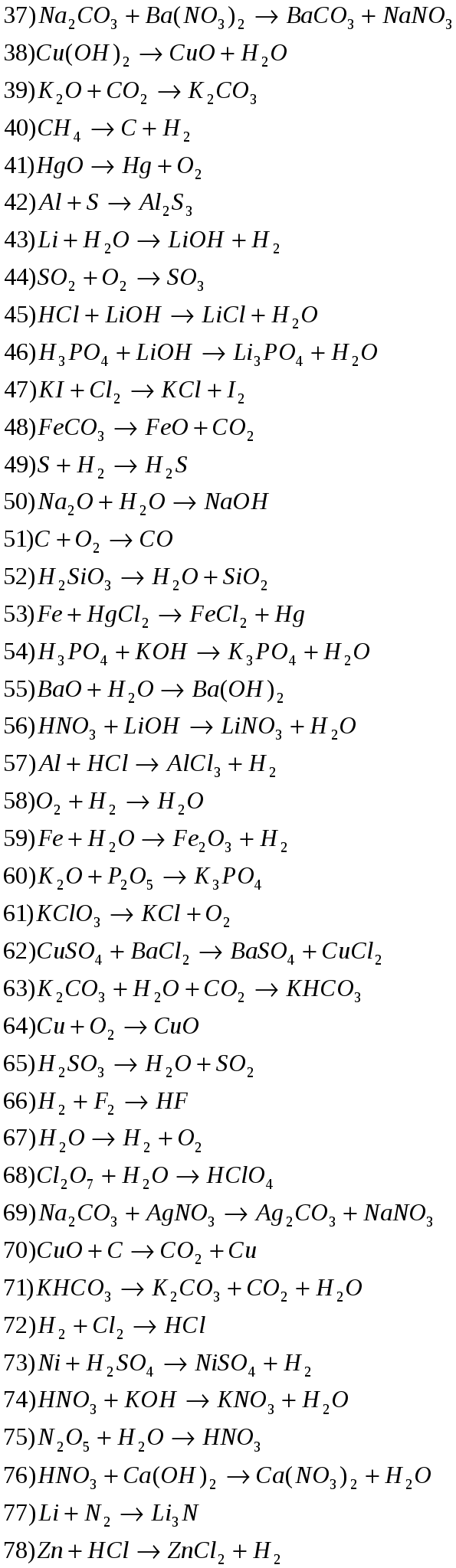
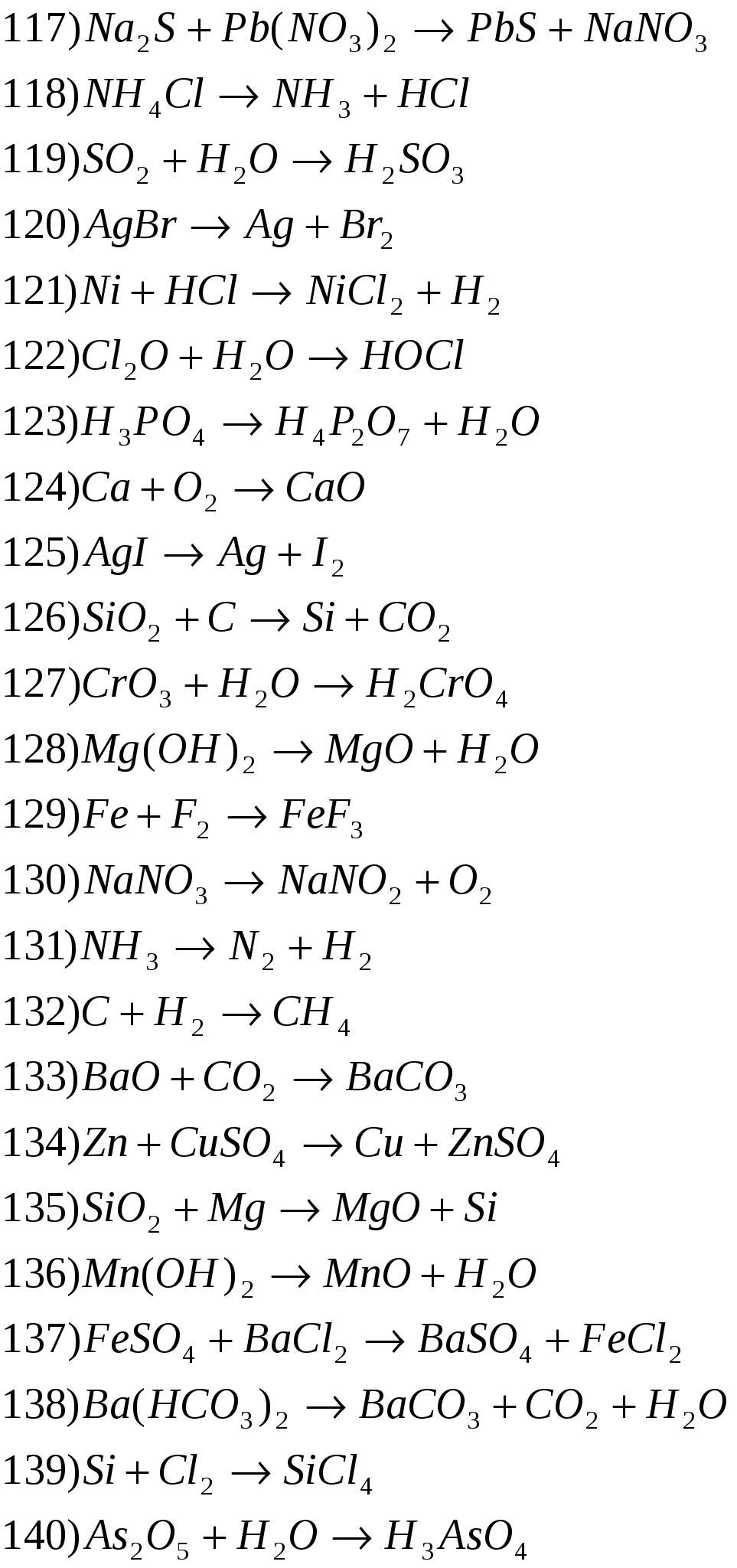
Здесь представлен конспект к уроку на тему «Окислительно-восстановительные реакции», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

