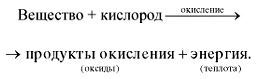Конспект урока «урок Горение простых и сложных веществ. Тепловой эффект реакции» по химии для 8 класса
Горение простых и сложных веществ.
Тепловой эффект химической реакции.(8 класс)
Учитель химии
Вохмякова Татьяна Ивановна
ГУ « Аулиекольская школа-гимназия имени Султана Баймагамбетова
отдела образования акимата Аулиекольского района»
Тезисы
Здравствуйте. Я учитель химии Аулиекольской школы-гимназии
Вохмякова Т.И.. Моё педагогическое кредо: «Учитель - всегда ученик».
Тема моего урока: «Горение простых и сложных веществ. Тепловой эффект химической реакции»(8 класс)
Цели урока:
сформировать знания о реакциях горения, условиях их протекания и прекращения, знания о тепловом эффекте химической реакции, экзо- и эндотермических реакциях,
развивать внимание, логическое мышление, продолжить формирование умений сравнивать, делать выводы; воспитывать интерес к предмету химии.
Ожидаемый результат:
Знать: понятия «реакция горения», «тепловой эффект химической реакции», « экзо и эндотермической реакции»
Уметь: определять тип реакции по тепловому эффекту.
Владеть терминологией, изученной во время урока;
С целью активизации познавательного интереса учащихся я использую на уроке различные инструменты Асtivstudio Activinspire: ссылка на музыку, ссылки на видео, тел.лента. ресурсы библиотеки студий, а также ресурсы Интернета.
Премечание: на уроке используется флипчарт, который переведён в программу Power Point, при этом, к сожалению, некоторые свойства флипчарта потеряны.
Тема урока
Горение простых и сложных веществ. Тепловой эффект химической реакции(8класс)
Цель урока
Образовательные: сформировать знания о реакциях горения, условиях их протекания и прекращения, знания о тепловом эффекте химической реакции, экзо- и эндотермических реакциях, термохимических уравнениях, закрепить навыки составления химических уравнений реакций горения;
Развивающие: развивать внимание, память, логическое мышление, продолжить формирование умений сравнивать, делать выводы;
Воспитательные: воспитывать интерес к предмету химии, коллективизм, стремление самому добывать знания. Содействовать развитию внимательности, инициативности, трудолюбия, творческих способностей.
Тип урока: Изучение нового материала.
Оборудование: таблица ПСХЭ ДИ Менделеева, интерактивная доска, Xplorer GLX, датчик температуры, flt «Горение эфф»
Реактивы: лабораторные стаканы, раствор лимонной кислоты, сода, натрий, вода
Ожидаемый результат:
Знать: понятия «реакция горения», «тепловой эффект химической реакции2, « экзо и эндотермической реакции
Уметь: составлять термохимические уравнения, определять тип реакции по тепловому эффекту.
Владеть терминологией, изученной во время урока;
Ход урока
-
Организационно-мотивационный этап (слайд 2,3 flt «Горение эфф», стихи о горении и звучит музыка –ссылка на стр.2 )
Учитель: Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем. Пламя, огонь, как одно из проявлений реакции горения, имеет и свое монументальное отражение. Яркий пример – мемориал славы в с.Аулиеколь(стр. флипчарта 4)
Об огне сложены сказки, легенды. В старину люди думали, что в огне живут маленькие ящерицы – духи огня. А были и такие, которые считали огонь божеством и строили в его честь храмы. Сотни лет горели в этих храмах, не угасая, светильники, посвященные богу огня. Поклонение огню было следствием незнания людьми процесса горения.
Олимпийский огонь. Раз в четыре года в мире происходит событие, сопровождающееся переносом «живого» огня. В знак уважения к основателям олимпиад огонь доставляют из Греции. По традиции один из выдающихся спортсменов доставляет этот факел на главную арену олимпиады. М.В.Ломоносов говорил: «Изучение природы огня и без химии предпринимать отнюдь невозможно».
Сегодня на уроке мы поговорим о реакциях горения веществ, роли реакций горения и о энергии химических реакций
2. Организационно-мотивационный этап (Повторение пройденного материала)
Разминка
Вопросы
1 Что называется реакцией горения?
2. Какие продукты образуются при горении?
3. Что такое оксиды?
Задание 1. Составьте уравнения реакций горения. Назовите продукты реакций (2 ученика у интерактивной доски- слайд 5)
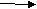 S+O2
S+O2
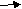 СН4+О2
СН4+О2
Задание3 Горение простых и сложных веществ . Выберите из вазы со свечой продукты этих реакций(слайд6)
M
 g+O2K+O2
g+O2K+O2
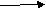 P+O2
P+O2
Вопрос А какие продукты образуются при горении сложных веществ? (оксиды) Составьте уравнения реакции горения метана СН4, если образуются оксиды. СН4+О2(слайд 6)
Изучение нового материала
Учитель Горение - реакция окисления, протекающая с достаточно большой скоростью, сопровождающаяся выделением тепла и света.
Схематически этот процесс окисления можно выразить следующим образом:
Горение – это первая химическая реакция,
с которой познакомился человек.
Ребята, помогите оппонентам в следующем споре о роли огня
Спор 2 учеников о роли огня
1 ученик ( показ слайдов «сварка металлов, горение топлива в печи и горении реактивного топлива при полёте самолёта»-стр.11-15)
Без огня человек не сварит пищу, сталь,
без него невозможно движение транспорта.
Огонь стал нашим другом и союзником, символом славных дел,
добрых свершений, памятью о минувшем.
2 ученик (показ слайда «пожар», стр15)
Позвольте возразить!При горении идет интенсивное окисление, в процессе горения появляется огонь, следовательно, такое окисление протекает очень быстро. Если скорость реакции окажется достаточно большой? Может произойти взрыв. Так взрываются смеси горючих веществ с воздухом или кислородом. К сожалению, известны случаи взрывов смесей воздуха с метаном, водородом, парами бензина, эфира, мучной и сахарной пылью и т.п., приводящие к разрушениям и даже человеческим жертвам.
Учитель: Сделайте вывод о роли огня
Вывод: Чтобы не допустить взрывов и пожаров, нужно знать условия возникновения и прекращения горения
Для возникновения горения необходимы:
-
горючее вещество
-
окислитель (кислород)
-
нагревание горючего вещества до температуры воспламенения (демонстрация слайдов -стр. 9)
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь – около 350 °С, а белый фосфор – около 40 °С.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного моль реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q). Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
2 H2(г) + O2(г) = 2 H2О(ж) + Q
Это уравнение реакции называется термохимическим уравнением. Здесь символ "+Q" означает, что при сжигании водорода выделяется теплота. Эта теплота называется тепловым эффектом реакции. В термохимических уравнениях часто указывают агрегатные состояния веществ.Реакции протекающие с выделением энергии называются ЭКЗОТЕРМИЧЕСКИМИ (от латинского "экзо" – наружу). Например, горение метана:
CH4 + 2O2 = CO2 + 2H2O + Q
Реакции протекающие с поглощением энергии называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании.
C + H2O = CO + H2 – Q
Тепловые эффекты химических реакций нужны для многих технических расчетов.( демонстрация слайдов с уравнениями реакций и определениями понятий стр7, глоссарий на стр.8)
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы.
Учитель: Теплота есть в любой химической реакции. Как экспериментально определить тип реакции по тепловому эффекту?
Эксперимент
Опыт 1
Взаимодействие 1.5 М раствора лимонной кислоты с содой
Ход работы
1. Определение начальной температуры 30 мл 1.5 М раствора лимонной кислоты с помощью датчика температуры PS -2153
2. Добавили 10г гидрокарбоната натрия
3. Через 20 сек реакции измерили температуру
4. отобразили на экране график зависимости температуры от времени
5. по графику определили тип реакции(разность температур меньше нуля)
Вывод: реакция эндотермическая
Опыт 2 Реакция оксида кальция с водой
Ход работы
1. Провести реакцию оксида кальция с водой
2. измерить начальную температуру с помощью датчика температуры PS -2153
3. измерить температуру через 20 сек
4. отобразили на экране график зависимости температуры от времени
5. по графику определили тип реакции (разность температур больше нуля)
Вывод: реакция экзотермическая
(учащиеся заполняют таблицу на стр16)
Учитель: От чего зависит тепловой эффект реакции?(природа реагирующих веществ, агрегатное состояние веществ, степени измельчения веществ )
3. Диагностика ( учащиеся выполняют тест по теме урока, flt эффект)
4 Рефлексия.
Запишите ваши ассоциации к слову «горение»(стр19)
5 Домашнее задание ( телеграфная лента-стр20)
Здесь представлен конспект к уроку на тему «урок Горение простых и сложных веществ. Тепловой эффект реакции», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.