Конспект урока «Химические свойства металлов и их соединений» по химии для 11 класса
Муниципальное общеобразовательное автономное учреждение
«Средняя общеобразовательная школа № 5 города Соль – Илецка»
Оренбургской области
Конспект урока - исследования по химии в 11 классе
«Химические свойства металлов и их соединений»
Учитель химии
Корикова Елена Александровна
Соль – Илецк
2014 год
Аннотация
Урок – исследование проводится в 11 классе после изучения металлов по теме «Вещества и их свойства». Урок является результатом усвоенных знаний по теме «Металлы», имеет связь с ранее изученными темами («Свойства основных классов веществ», «Гидролиз солей», «Окислительно – восстановительные реакции», «Металлы главных подгрупп», «Переходные металлы») и построен на основе теории проблемного обучения. Данный урок может быть проведен в классе, где учащиеся обладают высоким уровнем развития и сформированности учебных умений и навыков. Это позволяет провести урок в режиме самостоятельного поиска знаний. Форма организации работы в классе на основной части урока – групповая, группы созданы с учетом индивидуальных психологических особенностей и уровня умственного развития каждого учащегося.
Тема урока: «Химические свойства металлов и их соединений»
Цель урока: Научить учащихся самостоятельно добывать знания в ходе исследования и раскрывать особенности протекания химических реакций, определять проблемную ситуацию, находить пути ее решения, систематизировать и обобщать изученный материал; развивать умения прогнозировать, сравнивать, выделять главное, анализировать.
Задачи:
Образовательные:
1.Повторить свойства металлов и их соединений;
2.Сформировать понятия о химических свойствах металлов;
Развивающие:
1.На основе межпредметных связей продолжить формирование умений устанавливать взаимосвязь между составом, строением и свойствами вещества;
2.Способствовать развитию исследовательских навыков;
3.Продолжить формирование умений работать в темпе, экономя время урока
Форма проведения урока: урок – исследование
Оборудование и реактивы:
Растворы: хлорид магния, хлорид железа(2), хлорид меди(2), хлорид алюминия, карбонат натрия, нитрат меди (2), сульфат меди(2), хлорид железа (3), нитрат железа (3)
Твердые вещества: литий, магний, алюминий, железо, медная проволока, серебро.
Штативы с пробирками.
Литература:
-
Махмутов М. И. Проблемное обучение: основные вопросы теории. М.: Педагогика, 1975;
-
Махмутов. М.И Организация проблемного обучения в школе. Книга для учителей. М.: Просвещение, 1977; Психологический словарь. Под ред. В.В. Давыдова. М.: Педагогика, 1983;
Фридман Л.М., Маху В.И Проблемная организация учебного процесса. Методическая разработка. М.: АПМ СССР, 1990;
Кудрявцев В.Т. Проблемное обучение: истоки, сущность, перспективы . М.: Знание, 1991;
Сиденко А.С. Технологизация опыта, возможна ли она? Народное образование, 1999, № 1,2;
Хуторской А.В. Технология эвристического обучения. Школьные технологии, 1998, № 4.
Ход урока:
1 Орг. Момент
Ориентировочно-мотивационный этап
Ставлю перед учащимися познавательные задачи для уточнения содержания основных понятий. Вопросы предполагают межпредметную связь с физикой, биологией внутрипредметную связь между основными темами. Фронтальная работа учащихся класса репродуктивного и частично- поискового характера готовит учащихся к активной учебно-познавательной деятельности.
Вопрос 1. Почему в земной коре не могут встречаться в свободном состоянии щелочные металлы, их оксиды и гидроксиды?
На этот вопрос ожидается получение однозначного ответа о высокой реакционной способности щелочных металлов, взаимодействие с водой и химических свойствах их соединений. Учащиеся на основании положения щелочных металлов в периодической системе химических элементов делают вывод об их активности и высокой скорости протекания реакции с водой, а также о взаимодействия оксида и гидроксида щелочного металла с кислотными оксидами и кислотами. Учащиеся делают вывод о нахождении щелочных металлов в земной коре только в виде солей.
Вопрос 2. Смесь двух металлов второй группы главной подгруппы растворили в воде. Один из металлов в воде не растворился. Элементы, образующие эти металлы, называют «элементами жизни». Какие это металлы?
Ответ на данный вопрос предполагает сравнение активности металлов (магния и кальция), а также их соединений. Если учащиеся не отвечают на поставленный вопрос, то ещё раз уточняется условие взаимодействия металла с водой (металл реагирует с водой, образуя растворимое основание и водород).
Учитывая, что кальций при обычных условиях взаимодействует с водой с образованием малорастворимого гидроксида, а магний с холодной водой не реагирует, учащиеся приходят к выводу, что в воде не растворился магний.
Вопрос 3. новый цинковый бак, в котором приготовили раствор медного купороса для опрыскивания растений, вскоре прохудился. Объясните причину разрушения стенок бака.
Вопрос 4. Для тепловозов, имеющих двигатели с чугунным и стальными блоками, в системе охлаждения используется вода с рН=11/12,а для дизельных поездов, имеющих двигатели с алюминиевыми баками, вода с рН=7/8. Чем это вызвано?
Вопрос 5. Почему алюминиевую посуду нельзя мыть содой?
При поиске на последние три вопроса учащимся необходимо найти решение путём выявления противоречия в содержании. Для наглядности и лучшего понимания вопросы иллюстрированы схемами-рисунками. При ответе на 3-й вопрос учащиеся сравнивают активность металлов в электрохимическом ряду напряжений и делают вывод о протекании реакции замещения более активным металлом (Zn) менее активного (Cu) в растворимой соли, вследствие чего происходит разрушение стенок бака.
При ответе на 4-ый вопрос необходимо учесть наличие разной среды растворов, а также проявление отдельными металлами свойств амфотерности. При затруднении на этот вопрос учитель обращает внимание учащихся на стенд, на котором изображена шкала значений pH и ее соответствие среде раствора. Анализируя значения pH, учащиеся делают вывод о невозможности нахождения алюминия в щелочной среде раствора, т.к. в этом случае будет протекать его взаимодействие со щелочью.
Ответ на 5-ый вопрос вытекает из предыдущего ответа. Учитывая, что алюминий и его соединения (оксидная пленка на поверхности металла) проявляют амфотерные свойства, а среда щелочная (устанавливают при рассмотрении реакции гидролиза), учащиеся делают вывод, что алюминиевую посуду мыть содой нельзя.
Вопрос 6. Какие из предложенных солей подвергаются гидролизу: хлорид натрия, хлорид магния, карбонат калия? Определите среду раствора соли.
Данный вопрос направлен на идентификацию среды раствора, образованной в результате гидролиза соли. Учащиеся демонстрируют знание процесса гидролиза и объясняют образование среды раствора солей.
Проблемно-поисковый этап
УЧИТЕЛЬ.
Должны мы на уроке истину установить,
При этом формулы, законы не забыть
Эксперимент с начало проведем,
Подумаем, помыслим и теорию учтём.
Дерзая, споря, новое откроем
И постепенно нужное усвоим.
Сообщаю, что необходимо провести исследование, предоставляется возможность самостоятельного приобретения знаний. Ученики класса разбиты на творческие группы, каждая из которых получает задание и необходимые реактивы для проведения эксперимента. Учащиеся, получив задание, осмысливают содержание и последовательность его выполнения. В исследовании каждой из групп учителем созданы проблемные ситуации: противоречия теоретического материала и практически полученного в эксперименте результата. Ученики в процессе работы заполняют протокол исследования (табл.)
Протокол исследования
| Наблюдения | Гипотеза | Проверка гипотезы. Уравнения реакции | Алгоритм протекания реакции | |
Работа 1-ой группы
Цель исследования: Изучение протекания химических реакций при взаимодействии щелочных металлов с растворами солей.
Опыт 1. В растворах хлоридов магния и железа осторожно помещают кусочек лития. Наблюдения заносят в протокол (бурно выделяется газ, выпадают осадки белого и бурого цвета).
Опыт 2. В раствор хлорида меди (2) помещают кусочек лития. Заносят наблюдения в протокол (выпадает осадок черного цвета).
Учащиеся предполагают (ошибочно) вытеснение активным металлом более слабого металла из его соли. Но практически проведенный эксперимент свидетельствуют о выделении газа и выпадении осадка. Учащиеся формулируют проблемный вопрос, выдвигают гипотезы для его решения и доказывают их. Если выдвижение гипотезы о протекании реакции вызвало затруднение, то учитель обращает внимание учащихся на цвет осадков, их соответствие определенным соединениям и способам получения. При дальнейшем затруднении учащимся напоминают, что щелочной металл попадает в раствор, поэтому и происходит выделение газа. Согласно доказанному в 1-ом опыте алгоритму взаимодействия щелочного металла с раствором соли, во 2–м опыте должен образоваться осадок гидроксида меди (2) синего цвета. Вновь создана ситуация противоречия, в которой учащиеся находят решение. Обобщают полученные результаты, формулируют выводы, конструируют алгоритм протекания химической реакции.
При взаимодействии щелочных металлов с растворами солей протекают реакции:
-
взаимодействие щелочного металла и воды с образованием щелочи и водорода.
-
Взаимодействие щелочи и раствора соли с образованием другой соли и другого основания.
К предложенному алгоритму во 2-ом опыте добавится реакция разложения нерастворимого основания.
Работа 2-ой группы:
Цель исследования: Изучить взаимодействие щелочноземельных металлов с растворами солей.
Опыт 1. В раствор хлорида алюминия поместите небольшое количество магния. В результате проведенного эксперимента происходит растворение магния, которое сопровождается бурным выделением бесцветного газа. Наблюдения учащиеся записывают в протокол.
Опыт 2. В раствор хлорида магния поместите небольшое количество магния. Учащиеся записывают наблюдения в протокол исследования(растворение магния в растворе своей соли и выделение газа).
На первом этапе урока при поиске ответа на 2 вопрос учащиеся теоретически доказали нерастворимость магния в воде. Создана ситуация противоречия теории и практики. Согласно теории протекает вытеснение активным металлом более слабого из раствора его соли с образованием металлического осадка. Проведенный эксперимент свидетельствует о растворении магния и бурном выделении газа. Если выдвижение гипотезы учащимися вызывает затруднение, то я обращаю внимание на способность солей подвергаться гидролизу. Активные действия с объектом изучения приводят учащихся к выявлению характера противоречия теории и практики, они формулируют проблему и выдвигают гипотезы для ее решения. Обобщают полученные результаты и формулируют выводы.
Металл + раствор соли?
1.М + Н2О= реакция не протекает
2.растворимая соль + Н2О = гидролиз
3. М + кислот(среда раствора соли) = соль + Н2
Взаимодействие магния с растворами солей подчиняется алгоритму:
-
растворимые соли, образованные слабым основанием и сильной кислотой, подвергаются гидролизу по катиону с образованием кислой среды;
-
кислота, полученная в результате гидролиза соли, действует на металл, образуя соль и водород.
Работа 3-ой группы:
Цель исследования: изучить протекание химических реакций при действии алюминия на растворы солей.
Опыт 1. В раствор карбоната натрия опустите гранулу алюминия. Выпадает белый осадок и выделяется газ. (наблюдения учащиеся заносят в протокол).
Опыт 2. В раствор хлорида меди (2) поместите гранулу алюминия. В результате эксперимента выделяется бесцветный газ и большой объем порошкообразной меди на поверхности алюминия.
Опыт 3. В раствор нитрата меди (2) поместите гранулу алюминия. Учащиеся фиксируют отсутствие видимых признаков реакции.
Данное исследование предполагает выяснение учащимися противоречия в образовании различных продуктов реакций в результате взаимодействия алюминия с солями и способности растворения оксидной пленки в различной среде раствора. При затруднении выдвижения гипотезы, я обращаю их внимание на природу соли и возможность протекания гидролиза. Учащиеся совершенствуют исследовательские навыки, обобщают полученные результаты проведенного эксперимента, выдвигают гипотезы растворения оксидной пленки алюминия в различных средах растворов солей и взаимодействия металла в данных условиях.
Учащиеся формулируют выводы и конструируют алгоритм взаимодействия алюминия с растворами солей:
-
гидролиз солей, образованных слабым основанием или слабой кислотой, с образованием кислой или щелочной среды;
-
оксидная пленка на поверхности алюминия растворяется (щелочью или соляной кислотой) в среде, образованной в результате гидролиза соли (азотной кислотой пленка на поверхности алюминия не разрушается);
-
взаимодействие алюминия с водой и средой раствора соли.
Работа 4-ой группы:
Цель исследования: Изучить протекание химических реакций при действии металлов побочных подгрупп на растворы солей.
Опыт 1. В раствор сульфата меди(2) опустите железные стружки. Учащиеся фиксируют выделение меди на поверхности железа.
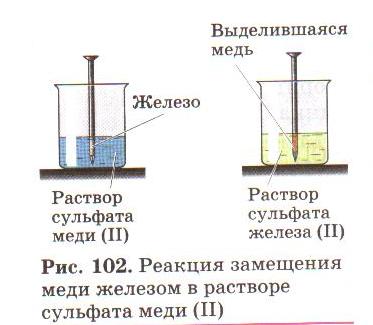
Опыт 2. В раствор хлорида железа (2) поместите небольшое количество меди. В результате эксперимента происходит растворение меди.
Опыт 3.В раствор нитрата серебра поместите небольшое количество меди. В результате эксперимента происходит осаждение серебра на медной проволоке.

Результаты первого опыта подтверждают вытеснение активным металлом более слабого из раствора его соли. Результаты второго и третьего опытов свидетельствует о протекании реакции между слабым металлом и раствором соли. Учащиеся группы должны выявить противоречие проведенных опытов и найти решение в создавшейся ситуации. При затруднении учащихся в выдвижении гипотез обращаю внимание на способность железа иметь различные степени окисления. Проведя качественный анализ продуктов реакции, учащиеся выдвигают гипотезу, проверяют ее истину.
1. М (сильнее) + растворимая соль = другая соль + другой М
2. М (слабее) + растворимая соль = другая соль + другая соль (реакция возможна, если
+3 +2 +2 +1
Fе = Fе или Сu = Сu)
Учащиеся формулируют выводы:
-
более активный металл вытесняет менее активный из раствора его соли с образованием другого металла и другой соли;
-
взаимодействие менее активного металла с раствором соли, возможно, если металл в соли восстанавливается до промежуточной степени окисления.
Этап рефлексии (презентация полученных результатов)
Учащиеся докладывают о достижении поставленных целей, обмениваются с другими учащимися результатами выполненного исследования, развивая тем самым умения публичного выступления.
Отчет групп учащихся поддерживается мультимедийной презентацией проведенного исследования.
Подведение итогов:
Результатом данного урока является наличие положительного мотива к исследовательской деятельности. Учащиеся пробовали свои силы в решении проблемных вопросов и убедились, что могут их решить. Успешное достижений целей учащимися открывает перспективу для их исследовательской деятельности во внеурочное время.
Домашнее задание:
Повторить как реагируют металлы с растворами солей
Здесь представлен конспект к уроку на тему «Химические свойства металлов и их соединений», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (11 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

