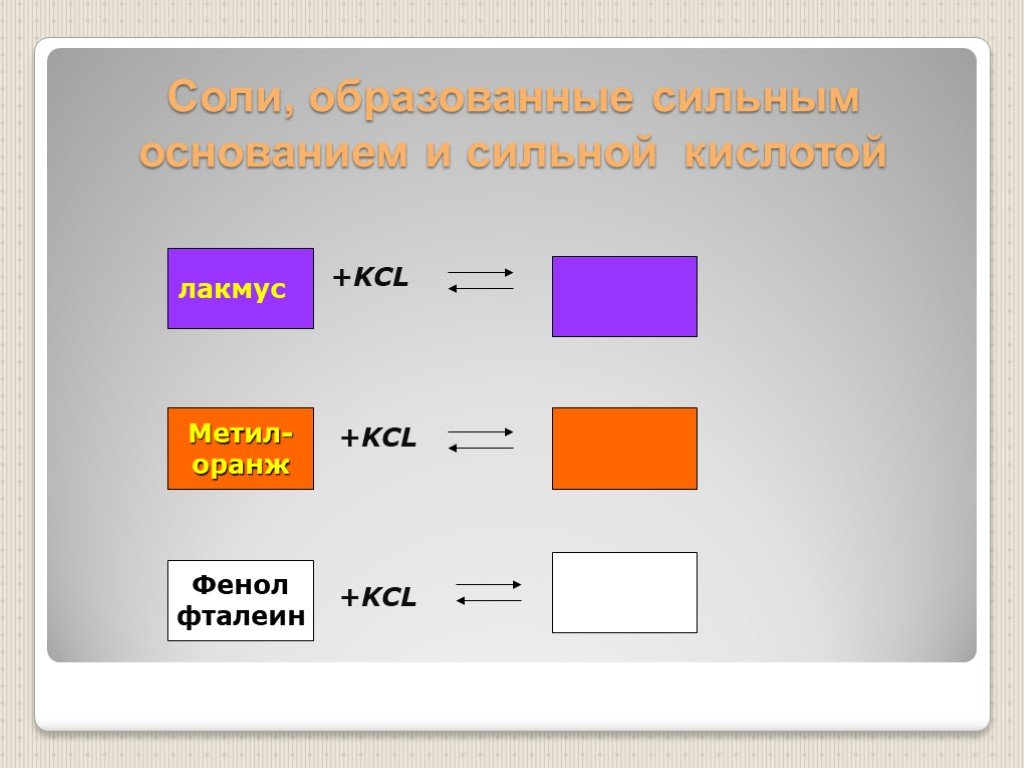
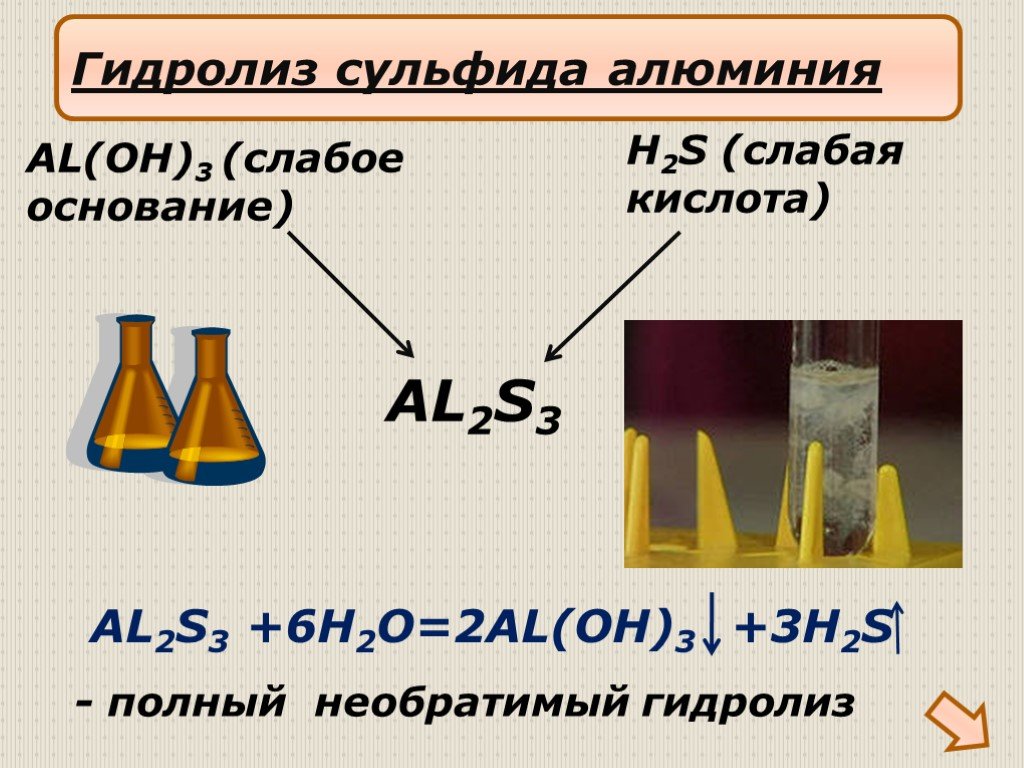
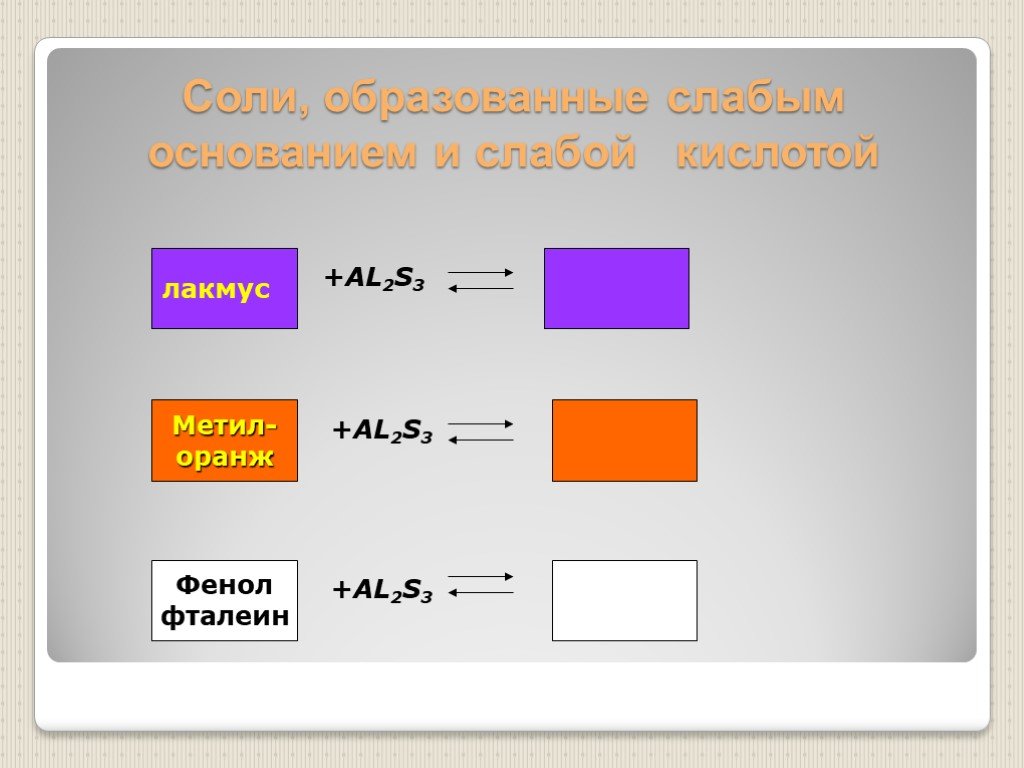
Презентация "Гидролиз солей" по химии – проект, доклад
Презентацию на тему "Гидролиз солей" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 35 слайд(ов).
Слайды презентации
Список похожих презентаций
Гидролиз солей
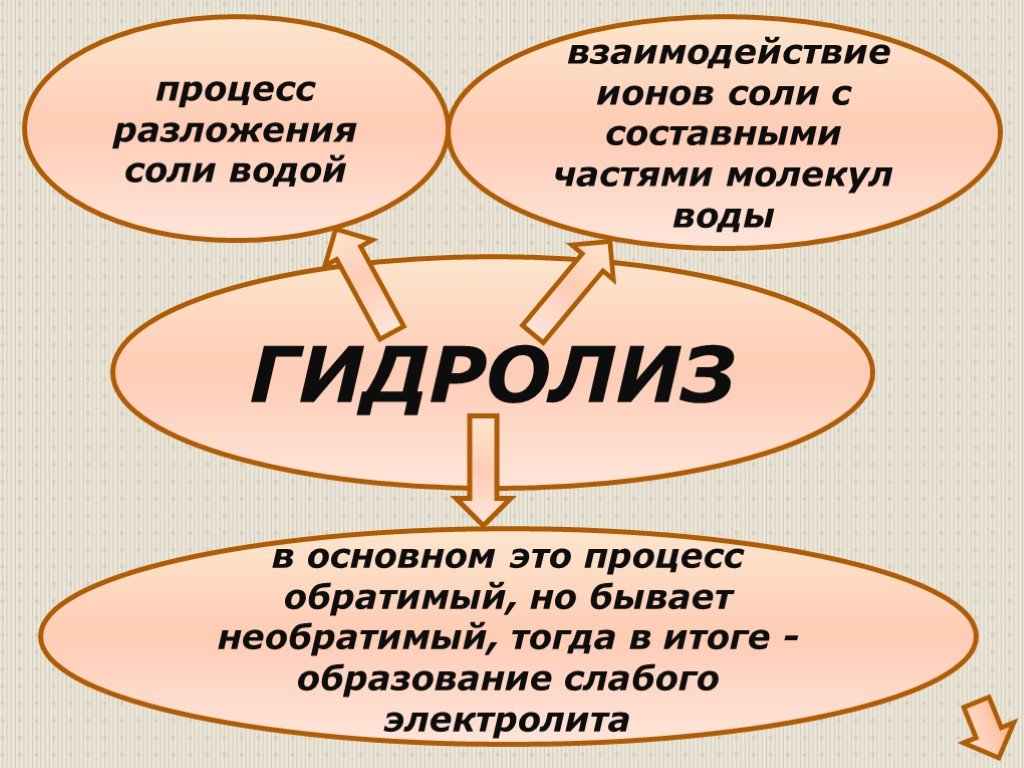
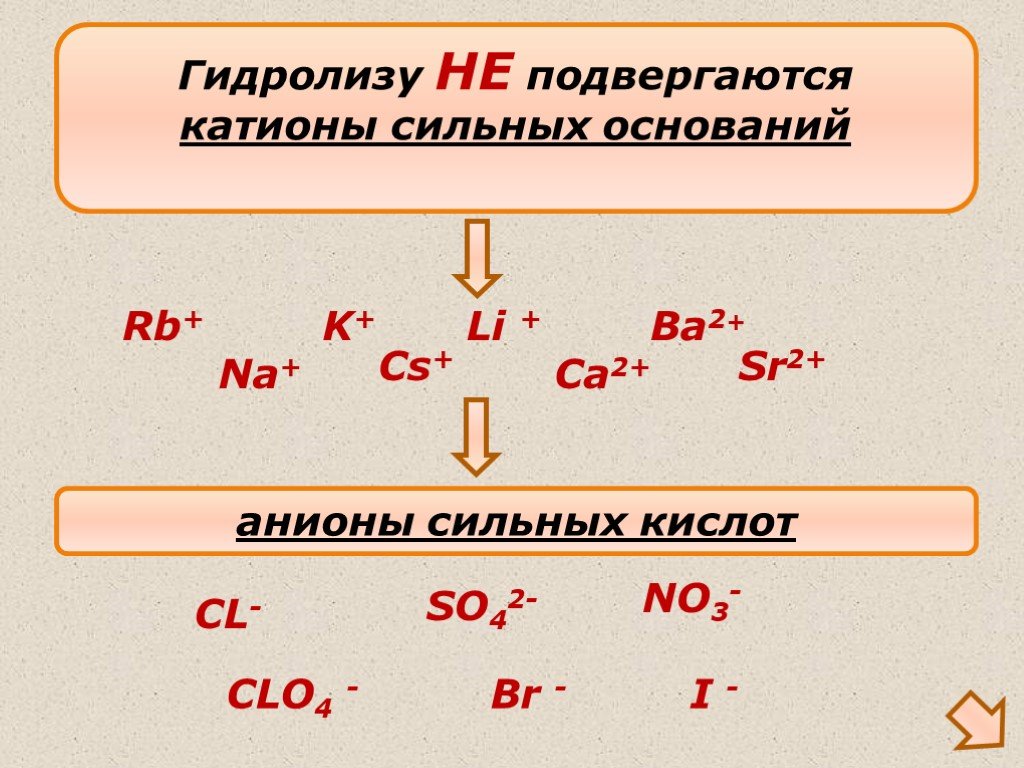
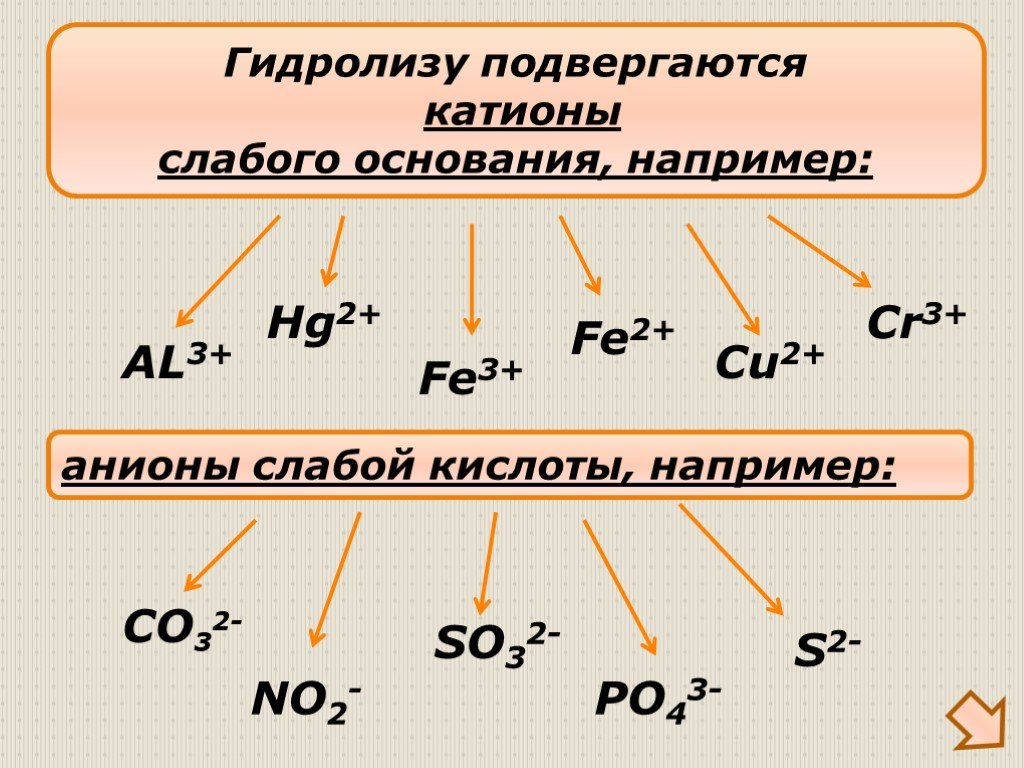
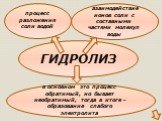
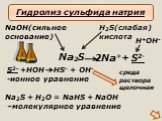
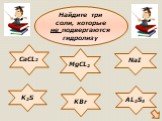
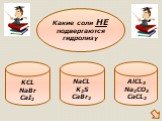
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды. В процессе гидролиза соли в водном растворе ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ...Гидролиз солей
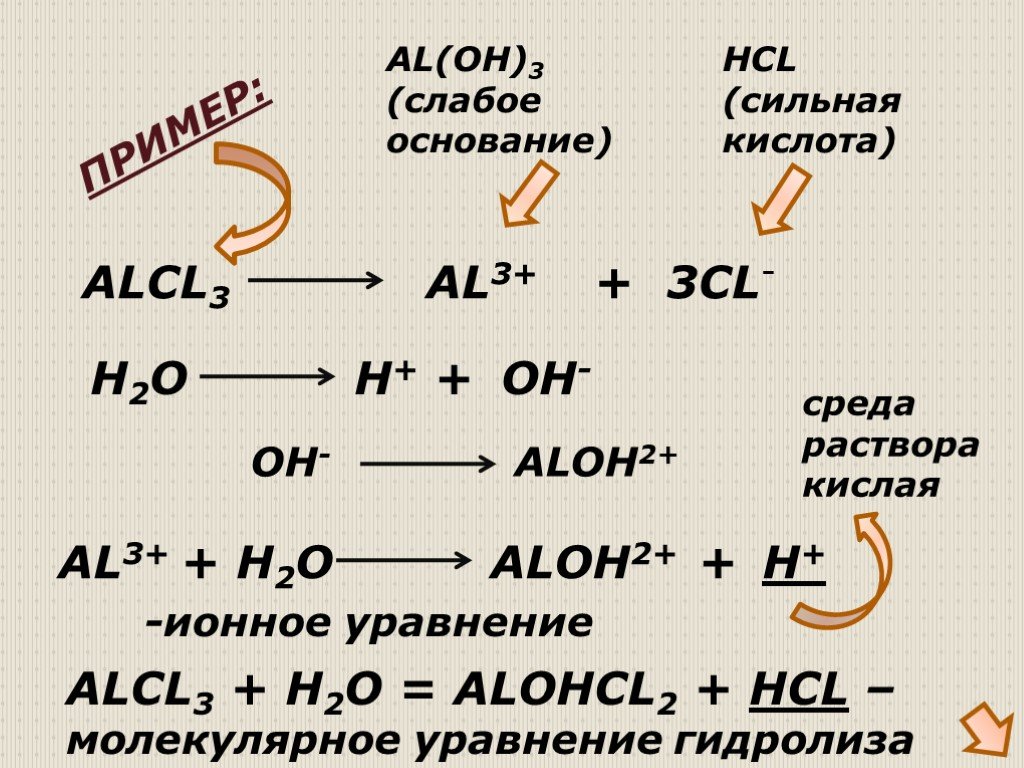
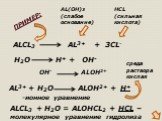
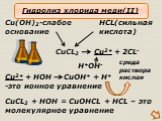
Гидролиз – это реакция обменного разложения веществ водой. Гидролиз органических веществ. 1. Гидролиз галогеналканов. С2Н5Сl + Н2О →С2Н5ОН + НСl 2. ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
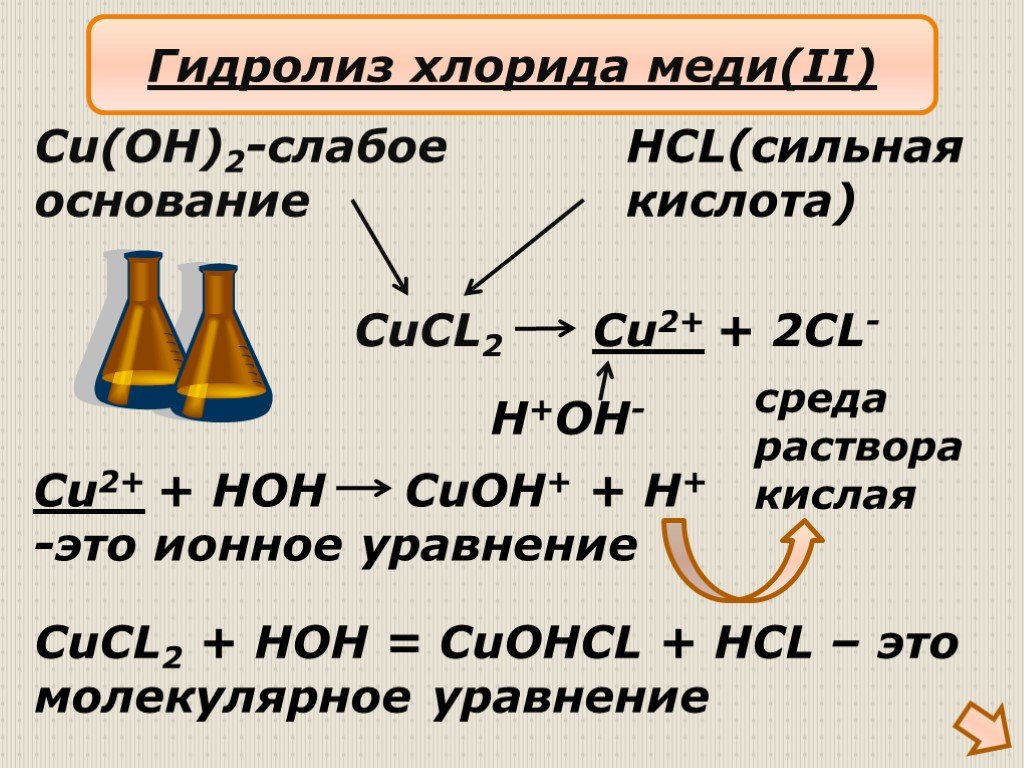
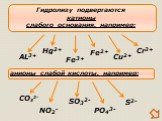
Химическая среда. Сама вода является очень слабым электролитом. При её электролитической диссоциации образуются катионы водорода и гидроксид-ионы ...Гидролиз солей
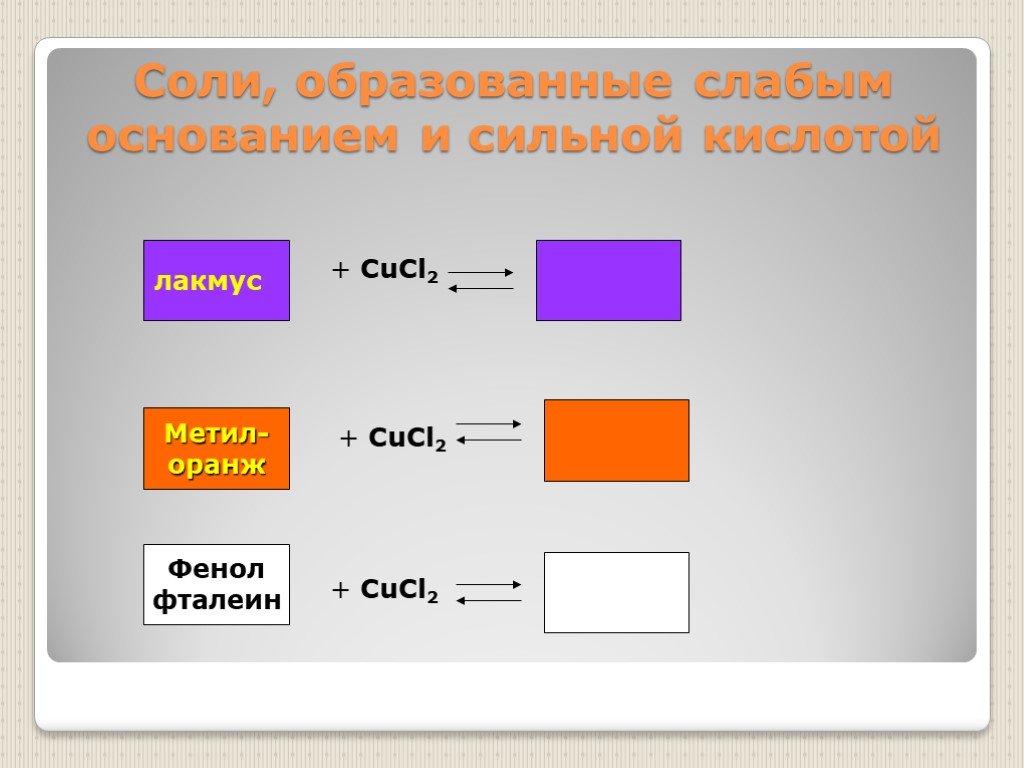
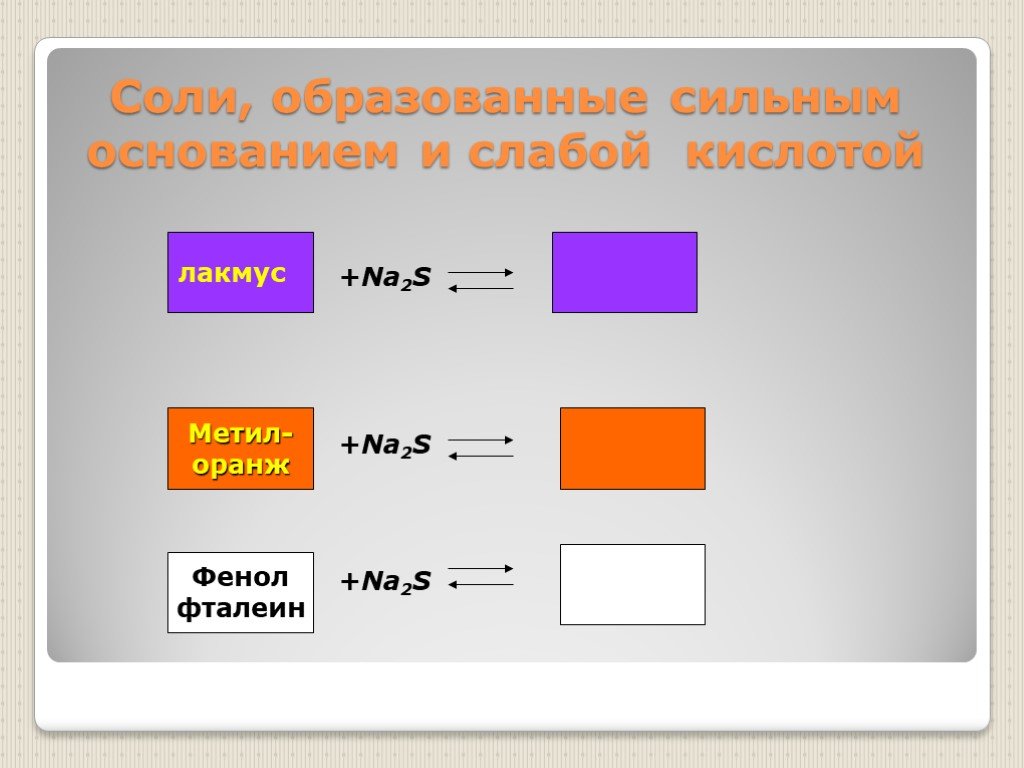
ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ. Тема: Гидролиз солей. Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать ..."Гидролиз неорганических солей
« Вода!.... Ты не просто необходима для жизни, ты и есть сама жизнь!»? А.Экзюпери. Проблемный вопрос: Почему при изжоге больному лучше выпить раствор ...Гидролиз неорганических солей
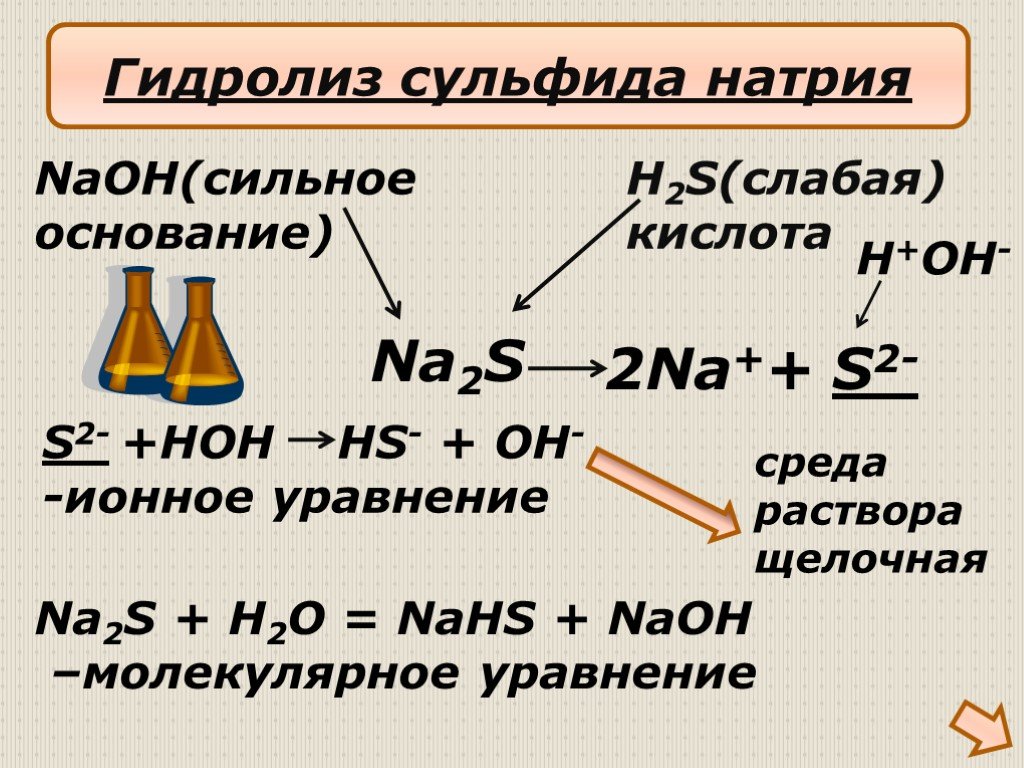
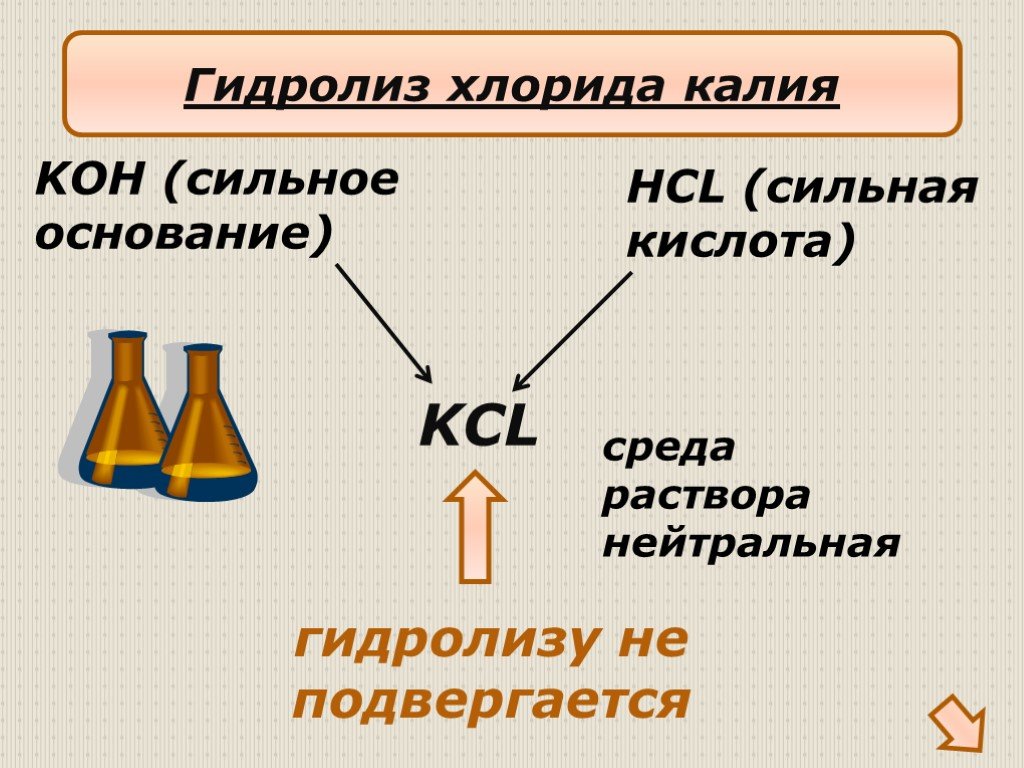
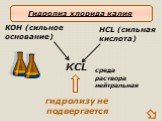
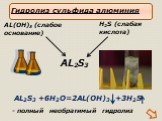
Словарь. Гидролиз – реакция обмена между растворимыми солями и водой Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, ...Химические свойства солей
Определение солей. Мех(КО)у. КО - кислотный остаток. Na2SO4 2Na+ +SO42- CaCl2 Ca2+ + 2Cl-. Na2SO4 CaCl2 Сульфат натрия Хлорид кальция. Соли – ...Химические свойства солей
Кто хочет съесть ядро ореха, должен расколоть его скорлупу плавт. Вычеркните «лишние» формулы и допишите предложения. А) H2SO4 , HNO3, H3PO4, HCl, ...Применение солей в быту
СОЛИ, О КОТОРЫХ СЕГОДНЯ ПОЙДЕТ РЕЧЬ: Поваренная соль Питьевая или пищевая сода Хлорная известь Поташ Медный купорос Железный купорос Марганцовка Гидросульфит ...Применение солей
Соли на кухне. В приготовлении пищи поваренная соль употребляется как важная приправа. Соль имеет хорошо знакомый каждому человеку характерный вкус, ...Получение солей
Свойства солей. Некоторые физические свойства: все соли – твердые кристаллические вещества.Соли имеют различную окраску. Каждая индивидуальная соль ...Определение солей аммония
УРОК-ПРЕЗЕНТАЦИЯ «соли аммония». Цель урока: Показать учащимся, что все соли аммония получают взаимодействием аммиака и соответствующих кислот , обладают ...Гидролиз
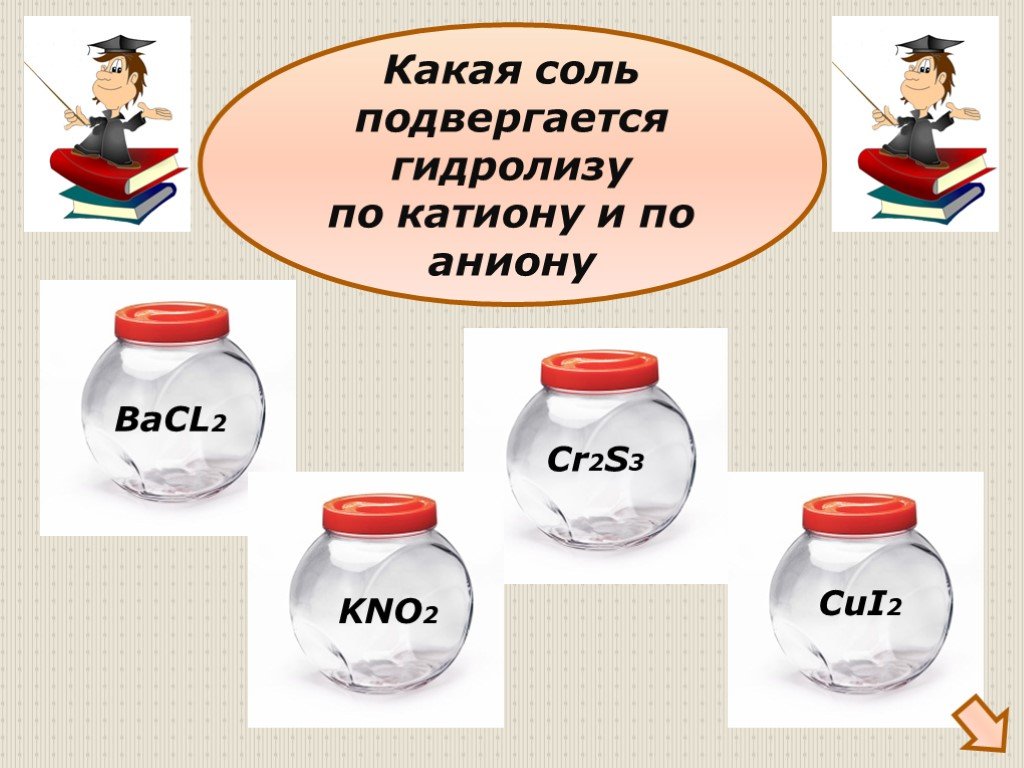
ТЕМЫ:. Гидролиз солей Электролиз водных растворов солей Задачи. Гидролиз солей. Задание А25: кислую среду имеет водный раствор хлорида цинка; 2) нитрата ...Классификация солей
Задачи урока: Познакомиться с понятиями кислые, средние, основные соли. Свойства оснований. А) P2O5 + 6KOH = 2K3PO4 + 3H2O P2O5 + 6K+ + 6OH- = 6K+ ...Диссоциация солей
Что такое основание в свете теории электролитической диссоциации? Задание 1: Выберите тот ряд, в котором находятся только основания и дайте им названия. ..."Гидролиз органических и неорганических соединени"
Цель урока:. повторить гидролиз солей, закрепить полученные знания, отработать навыки составления уравнений реакции гидролиза, предсказывать продукты ...Влияние внешних условий на рост кристаллов различных солей
Объект исследования:. насыщенные растворы медного купороса CuSO4∙5Н2О; алюмокалиевых квасцов KCl(SO4)2*12H2O. Задачи исследования:. приготовление ...Гидролиз
Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H , t ∕∕ R1-C + H2O ↔ R2-OH + R1- C O-R2 OH. О. Гидролиз углеводов:. ...Гидролиз органических веществ, содержащихся в продуктах питания человека
Цели и задачи проекта:. Показать практическую значимость знаний, полученных при изучении органической химии и биологии в 10 классе; Систематизировать ...Конспекты
Гидролиз солей
Тема урока:. . Гидролиз солей. Цели урока:. Сформировать представление о гидролизе, сущности гидролиза солей. . Научить ребят составлять уравнения ...Гидролиз солей
Муниципальное казённое общеобразовательное учреждение. «Кобыльская средняя общеобразовательная школа». Глушковского района Курской области. ...Гидролиз солей
11 класс. Тема:. «Гидролиз солей». Материал данной темы является объемным и сложным. Для лучшего понимания и усвоения этого материала необходимо, ...Гидролиз солей
Дата _____________ Класс ____________________. Тема: Гидролиз солей. Цели урока:. сформировать у учащихся понятие гидролиза солей. Ход урока. ...Гидролиз солей
ПЛАН-КОНСПЕКТ. . проблемного урока по химии для учащихся 9 класса. Тема урока:. «Гидролиз солей». Тип урока:. урок изучения нового материала. ...Гидролиз солей
Урок по теме: "Гидролиз солей". . . Цель урока. : Сформировать у учащихсе понятия гидролиза солей. Задачи урока:. . Развить у учащихся ...Гидролиз солей
Новикова Ирина Петровна. Учитель химии. МОУ Совхозная сош. Тамбовский район. Тема урока: «Гидролиз солей». Тип урока:. Изучение нового материала. ...Гидролиз солей
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №18 имени братьев Могилевцевых». . г. Брянска. ...Гидролиз солей
Муниципальное бюджетное образовательное учреждение. "Белогорская средняя общеобразовательная школа". МО "Холмогорский муниципальный район". ...Исследование гидролиза солей
Тема занятия:. . Исследование гидролиза солей. Цели занятия:. Провести исследования растворов некоторых солей и доказать, что большинство из них ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 февраля 2019
Категория:Химия
Содержит:35 слайд(ов)
Поделись с друзьями:
Скачать презентацию