Презентация "Гидролиз" по химии – проект, доклад
Презентацию на тему "Гидролиз" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 28 слайд(ов).
Слайды презентации
Список похожих презентаций
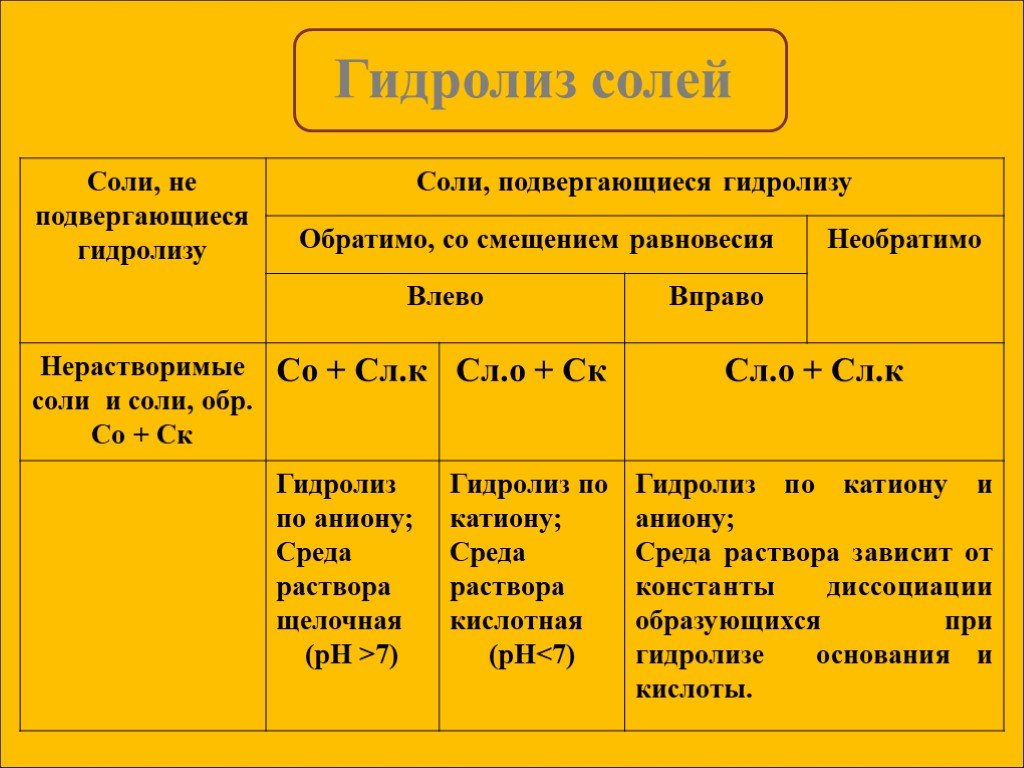
Гидролиз солей
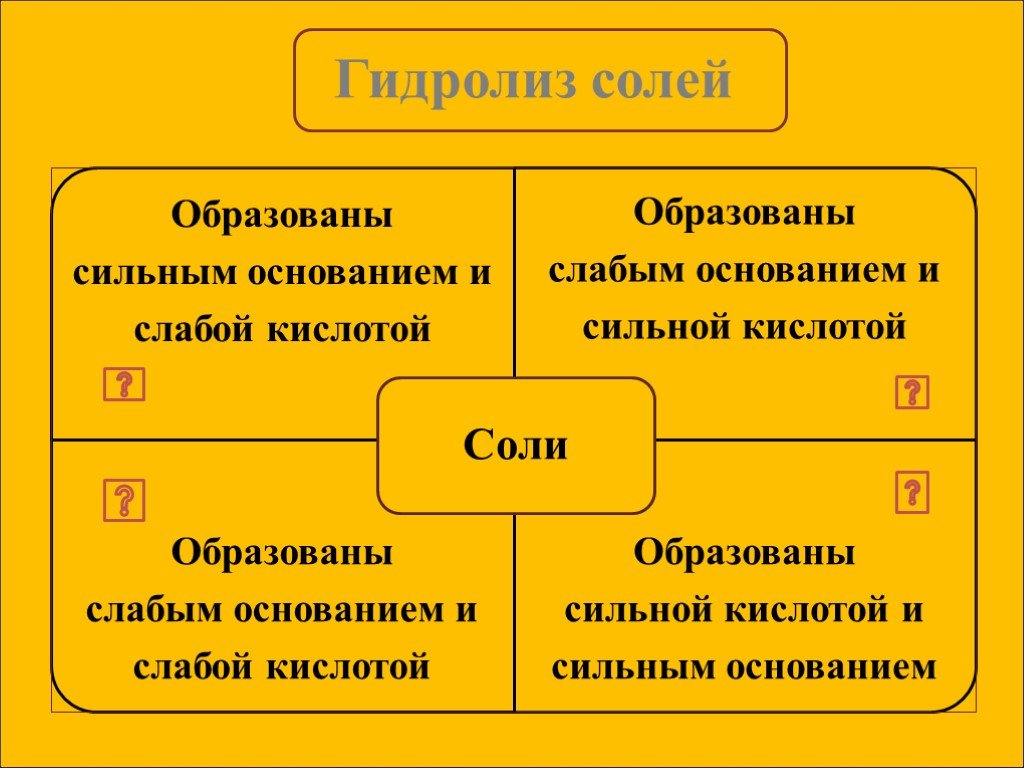
СОДЕРЖАНИЕ Определение. Типы солей,участвующих в гидролизе. Алгоритм составления уравнений гидролиза. Применение гидролиза. Примеры солей,участвующих ...Гидролиз солей
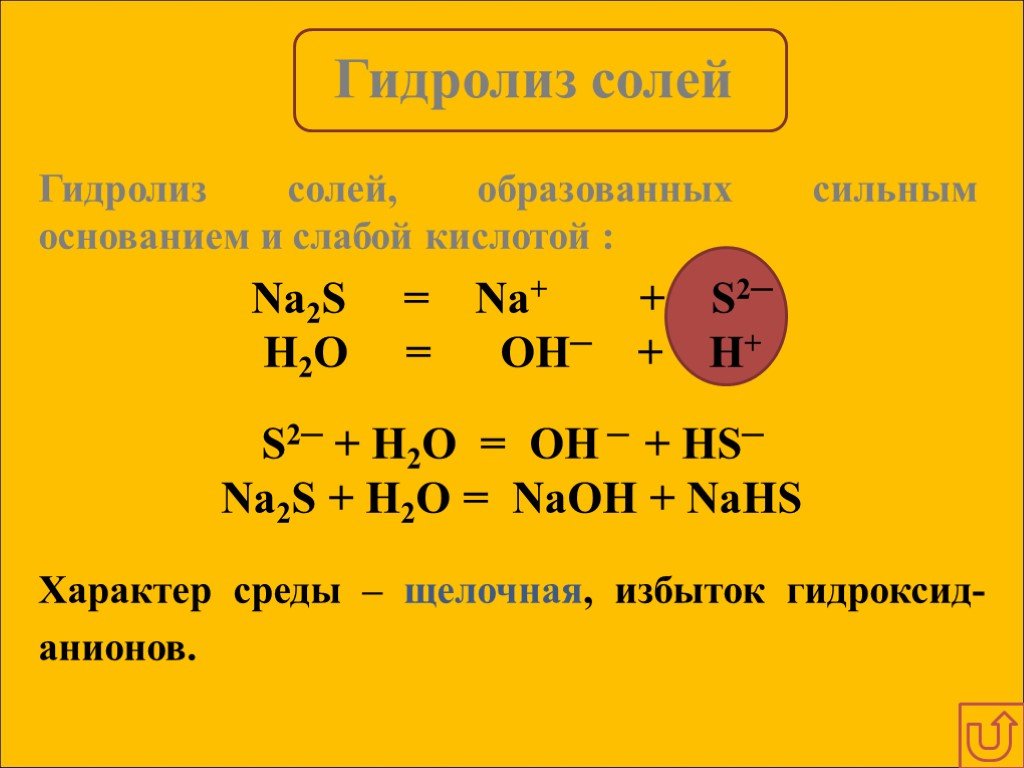
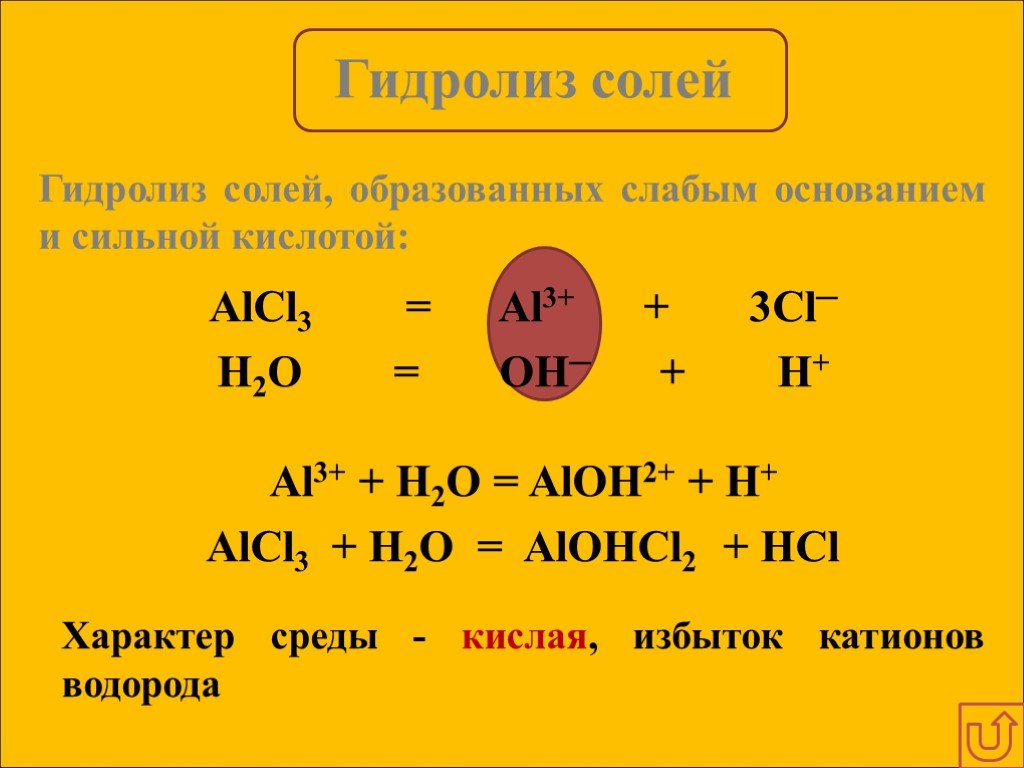
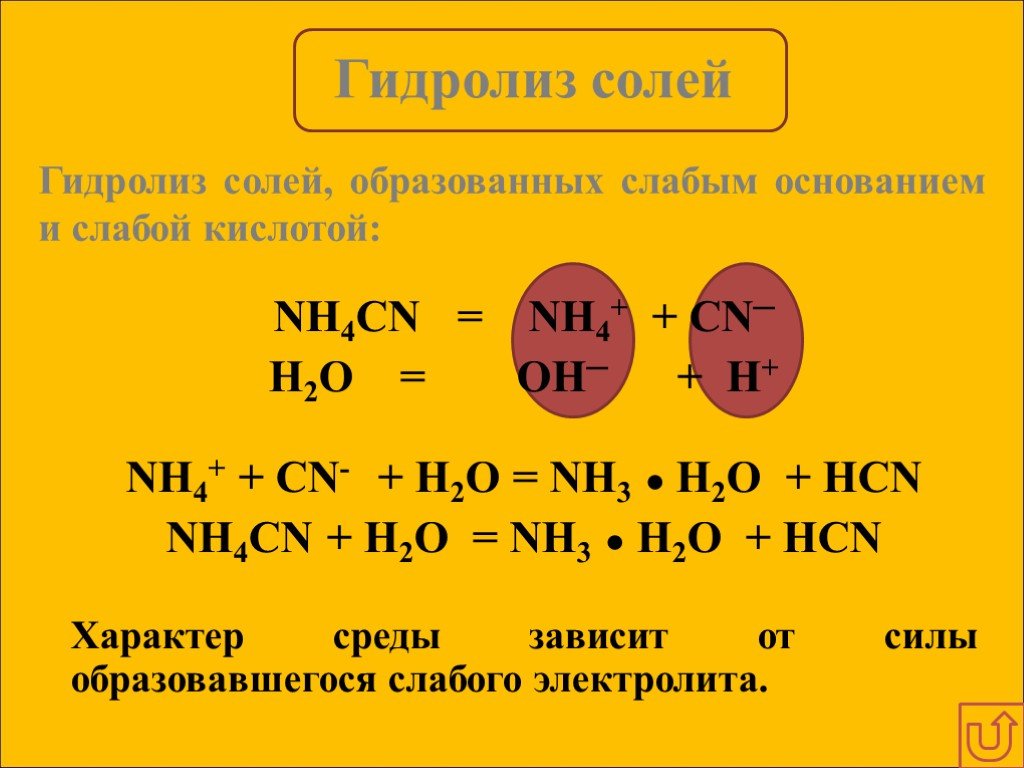
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды. В процессе гидролиза соли в водном растворе ...Гидролиз солей
ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ. Тема: Гидролиз солей. Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать ...Гидролиз органических веществ, содержащихся в продуктах питания человека
Цели и задачи проекта:. Показать практическую значимость знаний, полученных при изучении органической химии и биологии в 10 классе; Систематизировать ...Гидролиз солей
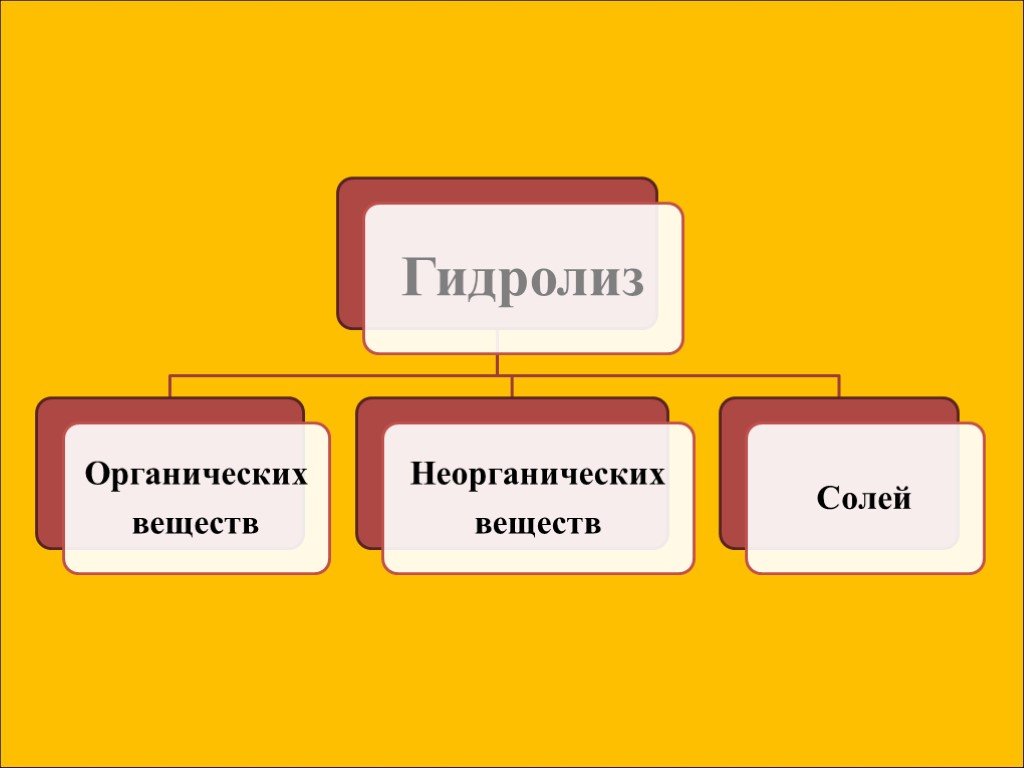
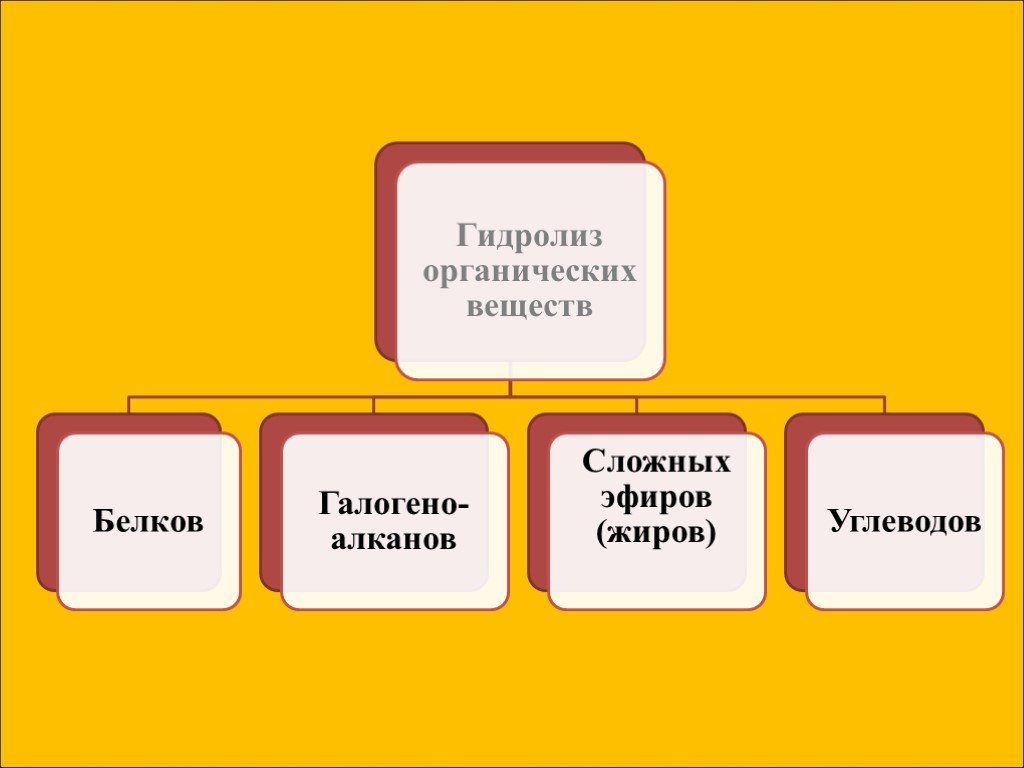
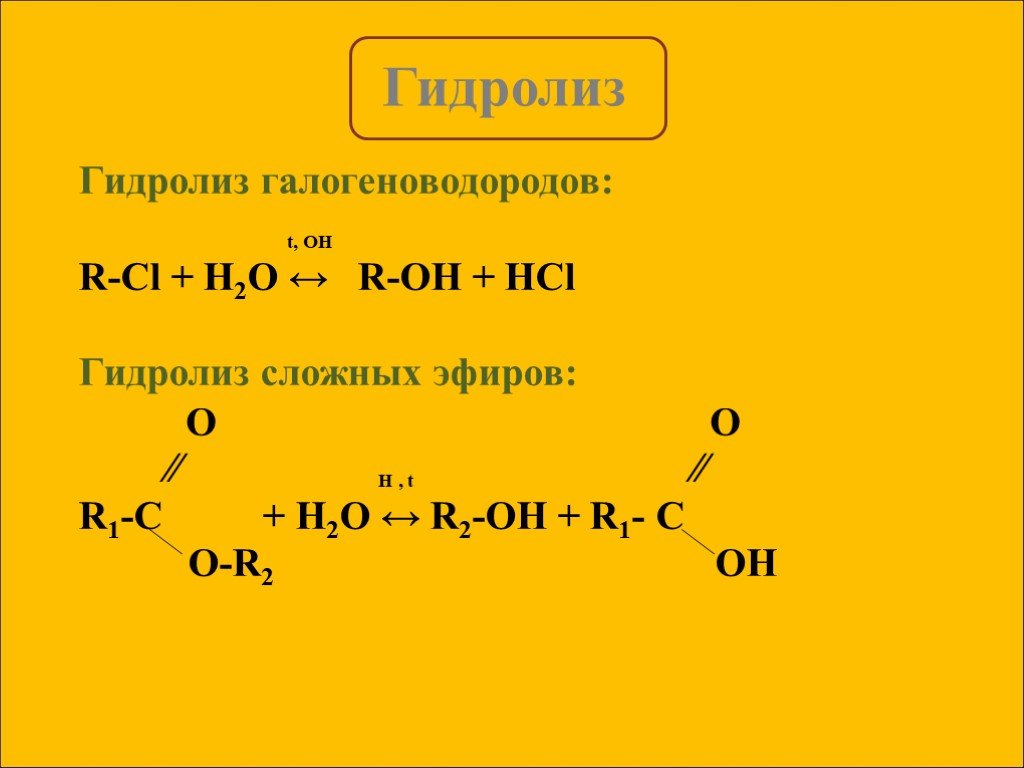
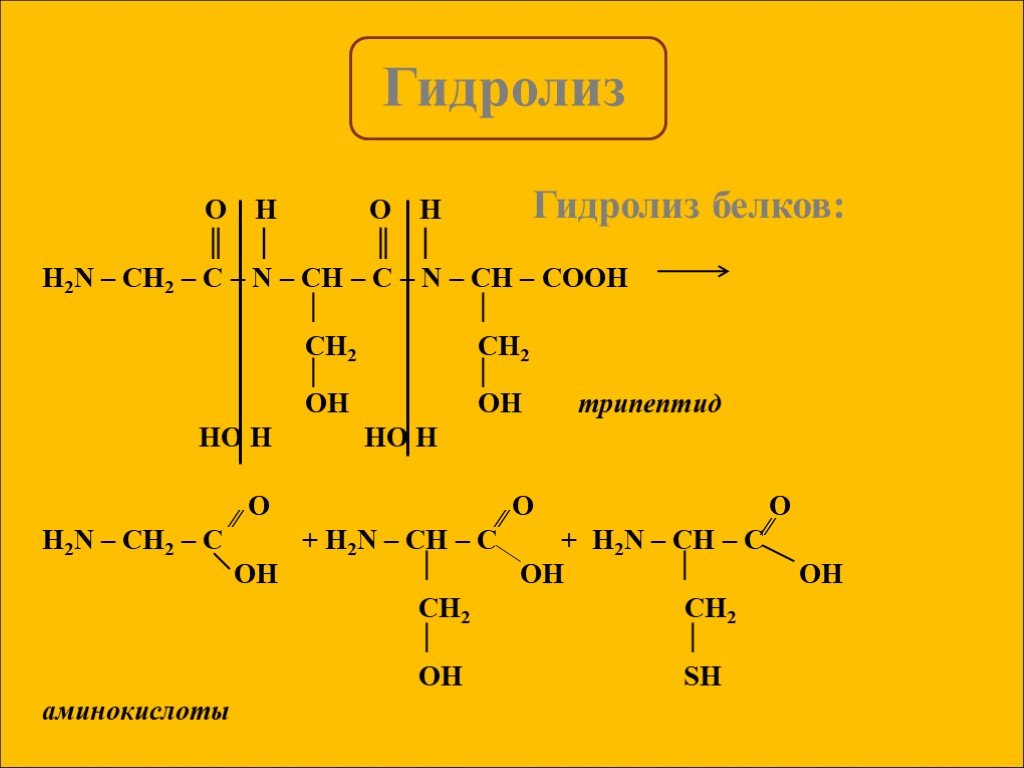
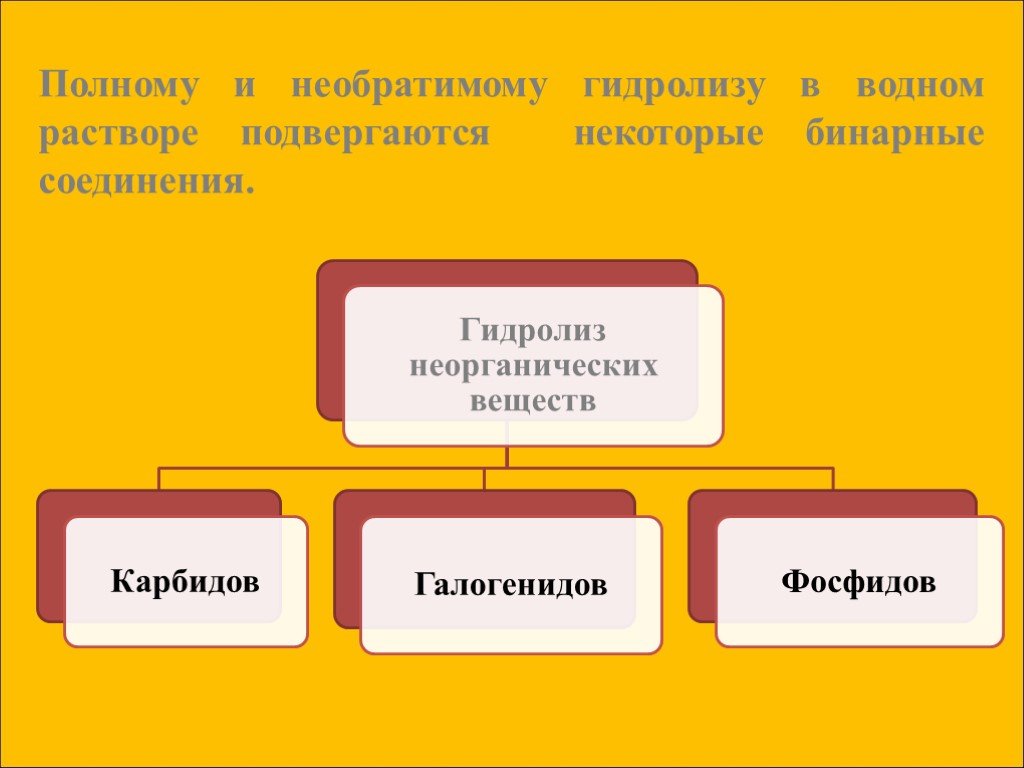
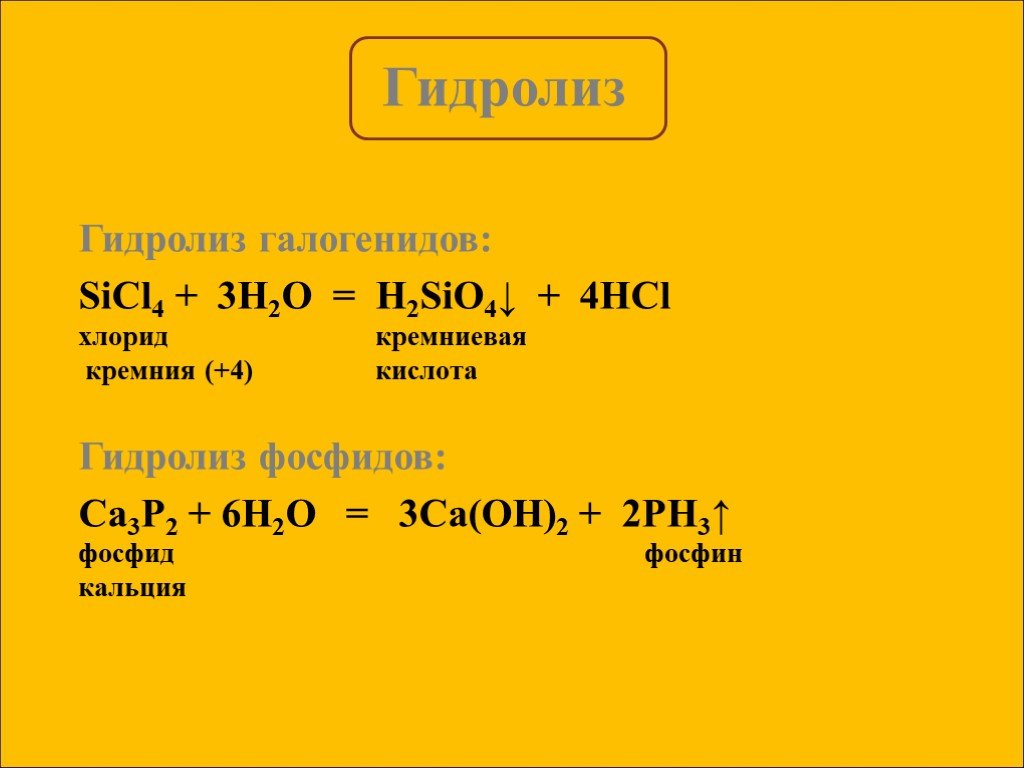
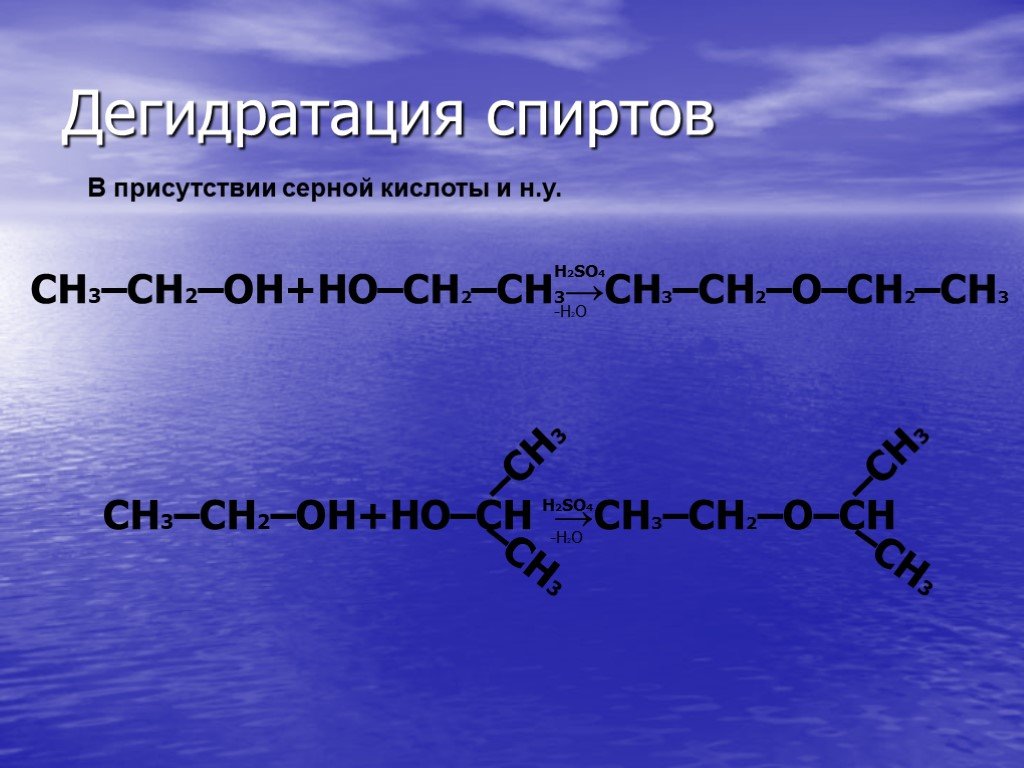
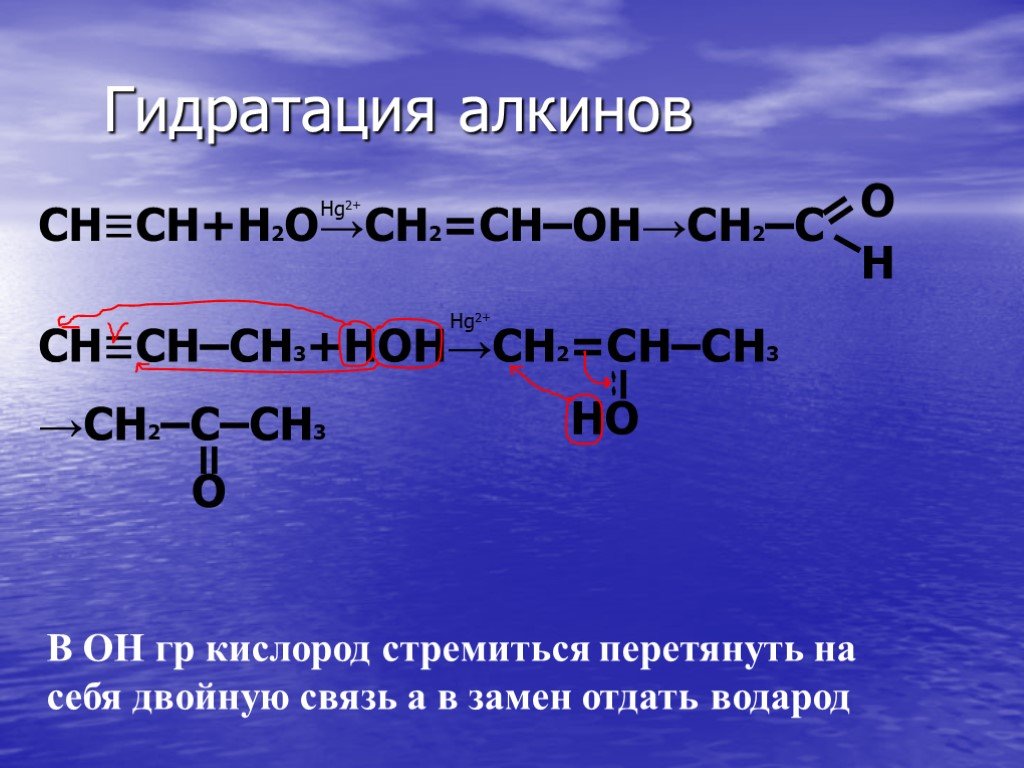
Гидролиз – это реакция обменного разложения веществ водой. Гидролиз органических веществ. 1. Гидролиз галогеналканов. С2Н5Сl + Н2О →С2Н5ОН + НСl 2. ...Гидролиз
ТЕМЫ:. Гидролиз солей Электролиз водных растворов солей Задачи. Гидролиз солей. Задание А25: кислую среду имеет водный раствор хлорида цинка; 2) нитрата ...Гидролиз неорганических солей
Словарь. Гидролиз – реакция обмена между растворимыми солями и водой Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, ...Гидролиз
Гидролиз – это реакции обменного Взаимодействия вещества с водой, приводящие к их разложению. Гидролизу подвергаются соединения различных классов: ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Химическая среда. Сама вода является очень слабым электролитом. При её электролитической диссоциации образуются катионы водорода и гидроксид-ионы ...Химия Гидролиз
Самоанализ урока химии. Тема урока: «ГИДРОЛИЗ СОЛЕЙ» Место урока в теме: Первый урок Тип урока: Изучение нового материала Вид урока: Комбинированный. ..."Гидролиз органических и неорганических соединени"
Цель урока:. повторить гидролиз солей, закрепить полученные знания, отработать навыки составления уравнений реакции гидролиза, предсказывать продукты ..."Гидролиз неорганических солей
« Вода!.... Ты не просто необходима для жизни, ты и есть сама жизнь!»? А.Экзюпери. Проблемный вопрос: Почему при изжоге больному лучше выпить раствор ...Своя игра. Физика и химия
Интегрированный урок ФИЗИКА+ХИМИЯ. Авторы: Орлова И.В., Шувалова Л.В. Муниципальное образовательное учреждение Фоминская средняя общеобразовательная ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Конспекты
Гидролиз солей
11 класс. Тема:. «Гидролиз солей». Материал данной темы является объемным и сложным. Для лучшего понимания и усвоения этого материала необходимо, ...Гидролиз солей
Дата _____________ Класс ____________________. Тема: Гидролиз солей. Цели урока:. сформировать у учащихся понятие гидролиза солей. Ход урока. ...Гидролиз солей
ПЛАН-КОНСПЕКТ. . проблемного урока по химии для учащихся 9 класса. Тема урока:. «Гидролиз солей». Тип урока:. урок изучения нового материала. ...Гидролиз солей
Урок по теме: "Гидролиз солей". . . Цель урока. : Сформировать у учащихсе понятия гидролиза солей. Задачи урока:. . Развить у учащихся ...Гидролиз солей
Тема урока:. . Гидролиз солей. Цели урока:. Сформировать представление о гидролизе, сущности гидролиза солей. . Научить ребят составлять уравнения ...Гидролиз солей
Муниципальное казённое общеобразовательное учреждение. «Кобыльская средняя общеобразовательная школа». Глушковского района Курской области. ...Гидролиз солей
Новикова Ирина Петровна. Учитель химии. МОУ Совхозная сош. Тамбовский район. Тема урока: «Гидролиз солей». Тип урока:. Изучение нового материала. ...Гидролиз солей
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №18 имени братьев Могилевцевых». . г. Брянска. ...Гидролиз неорганических соединений
ТЕМА УРОКА: Гидролиз неорганических соединений. Тип урока:. Изучение нового материала, обобщение и систематизация знаний. Вид урока:. Проблемно- ...Гидролиз солей
Муниципальное бюджетное образовательное учреждение. "Белогорская средняя общеобразовательная школа". МО "Холмогорский муниципальный район". ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:21 февраля 2019
Категория:Химия
Содержит:28 слайд(ов)
Поделись с друзьями:
Скачать презентацию