Решение задач "выход продукта от теоретически возможного" презентация, проект, доклад
Презентацию на тему "Решение задач "выход продукта от теоретически возможного"" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Использование Диофантовых уравнений при решении задач в математике и химии
Цель: Рассмотреть использование неопределенных уравнений при решении задач в математике и химии. Диофант Александрийский -древнегреческий математик ...Использование комбинаторных задач для подсчета вероятностей
Решить уравнение. ПРИМЕР 1. Из колоды в 36 карт случайным образом вытаскивают три карты. Какова вероятность того, что среди них: нет пиковой дамы? ...Изучение реакции среды в зависимости от типа гидролиза соли
Лабораторная работа Изучение реакции среды в зависимости от типа гидролиза соли. Цели: понять сущность гидролиза. научиться определять реакцию и тип ...Изучение характеристик мороженого как продукта питания
Изучить химический состав и энергетическую ценность наиболее предпочитаемых сортов мороженого. Цель научной работы. изучить информационную базу по ...Изменение качества растительных масел в зависимости от условий хранений
ОБЪЕКТАМИ ИССЛЕДОВАНИЯ:. 1)Масло подсолнечное «Аведовъ» 2)Масло подсолнечное «Благо» 3)Масло оливковое «Lorado» 4)Масло подсолнечное «Золотая семечка» ...Защита зоны электродуговой сварки от окисления
Окисление. В зоне сварки кислород является наиболее вредной примесью, так как окисляет элементы, которые входят в состав металла шва, и ухудшает его ...Вопросы от …
Что? Где? Когда? Время от времени полезно заглядывать в архивы. Полнее сознавая прошедшее, мы уясняем современное. А. И.Герцен. ОТВЕТ Вопрос задает ...Алгоритм решения задач с расчётами по химическим уравнениям
Задача: Определи объём воздуха, необходимый для сжигания 24 г магния, содержащего 10 % негорючих примесей. 2Mg + O2 = 2 MgO. Составь уравнение реакции: ...Алгоритм решения задач по химии
Алгоритм решения задач по химии:. Записать краткое условие задачи; *В случае необходимости произвести предварительный расчет; Перевести величины, ...Конспекты
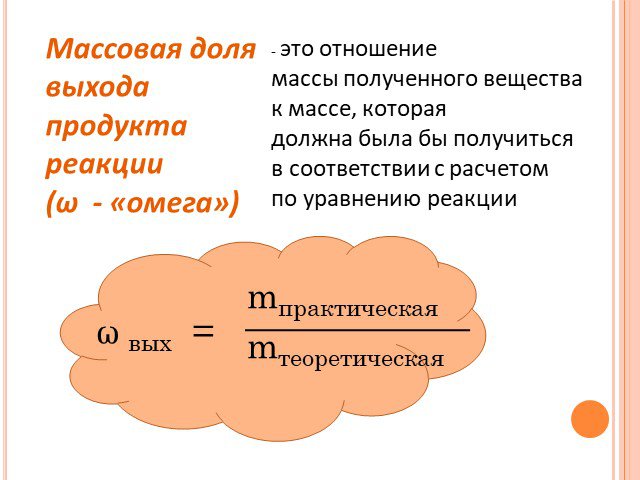
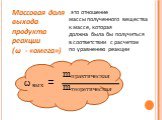
Решение задач на определение выхода продукта реакции
Тема урока: Решение задач на определение выхода продукта реакции. Алгоритм решения задач. Составьте краткое условие задачи. . Составьте ...Решение задач на молярный объем и относительную плотность газов
ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ШКОЛА №18. План конспект. открытого урока по химии. 8 класс. Тема урока:. . Решение задач на молярный ...Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока
Урок №39 9 класс. Тема: Решение задач на применение закона ЭДС индукции и определение энергии магнитного поля тока. Цель урока: проверить знания ...Решение экспериментальных задач по теме «Металлы и их соединения
Дата_____________ Класс_______________. Тема:. Практическая работа №6 «Решение экспериментальных задач по теме «Металлы и их соединения»». . ...Решение задач на вычисления, связанные с участием веществ, содержащих примеси
Тема: Решение задач на вычисления, связанные с участием веществ,. содержащих примеси. Цели: 1) Формировать умения решения расчетных задач на вычисления,. ...Решение задач по воде
Дата:. 14.03.14 г. Класс: 8 «А». Учитель:. Рощина Н.В. Роспись зам директора по УВР. __________________. Тема занятия № 4. Решение задач ...Решение задач на растворы
Урок №38. . . Тема урока:. Решение задач на растворы. Цели и задачи урока:. Закрепить понятие доля компонента;. . Научить делать расчеты, ...Решение экспериментальных задач на распознавание катионов и анионов
Название работы:. Урок-практикум в 8-м классе на тему «Решение экспериментальных задач на распознавание катионов и анионов». Тема урока. Урок-практикум ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Решение расчетных задач на вывод химической формулы органического вещества
Муниципальное бюджетное общеобразовательное учреждение. «Средняя общеобразовательная школа №55» г. Брянска. Урок по теме:. «Решение ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Красновская Елена Михайловна, учитель химии
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию