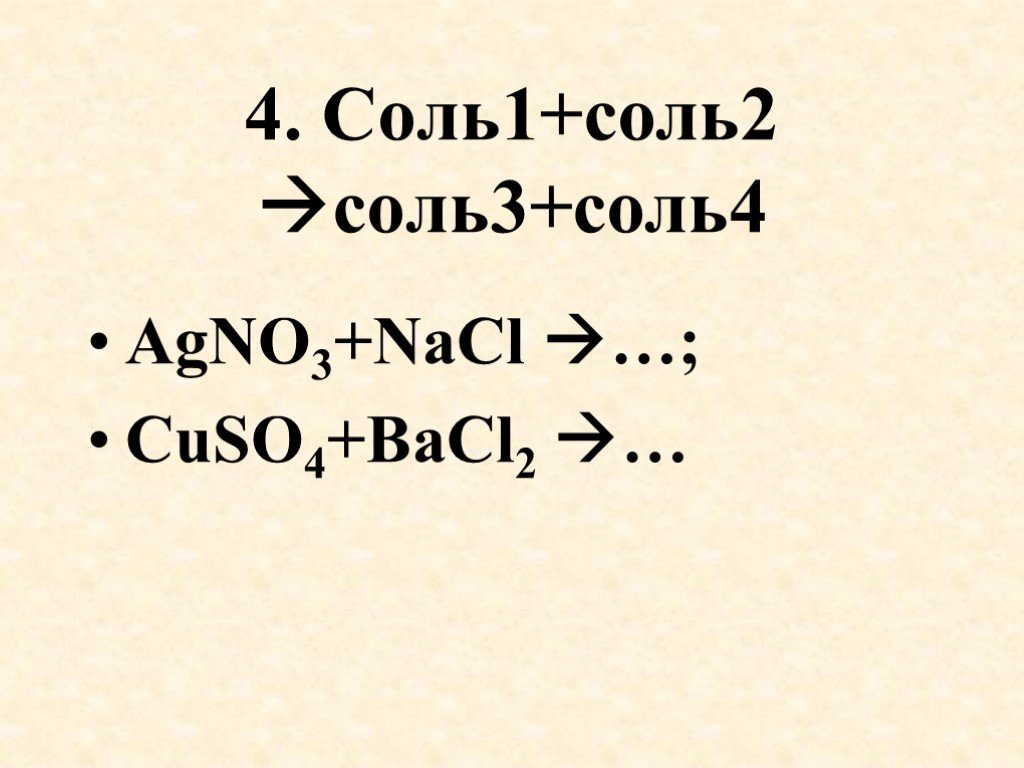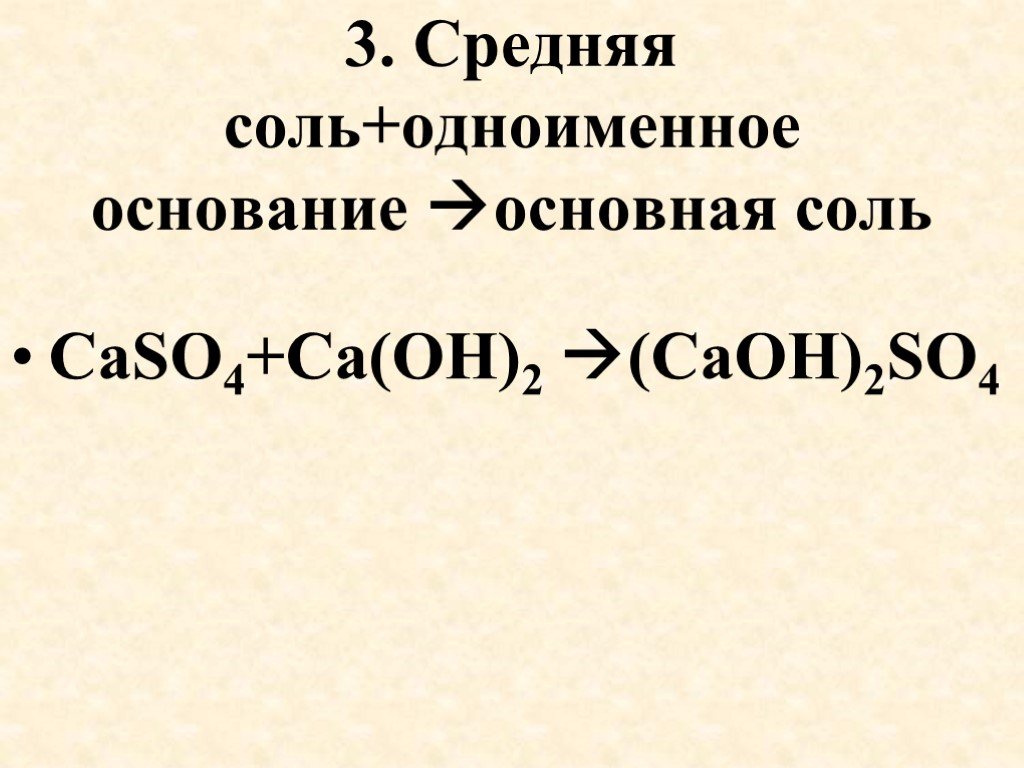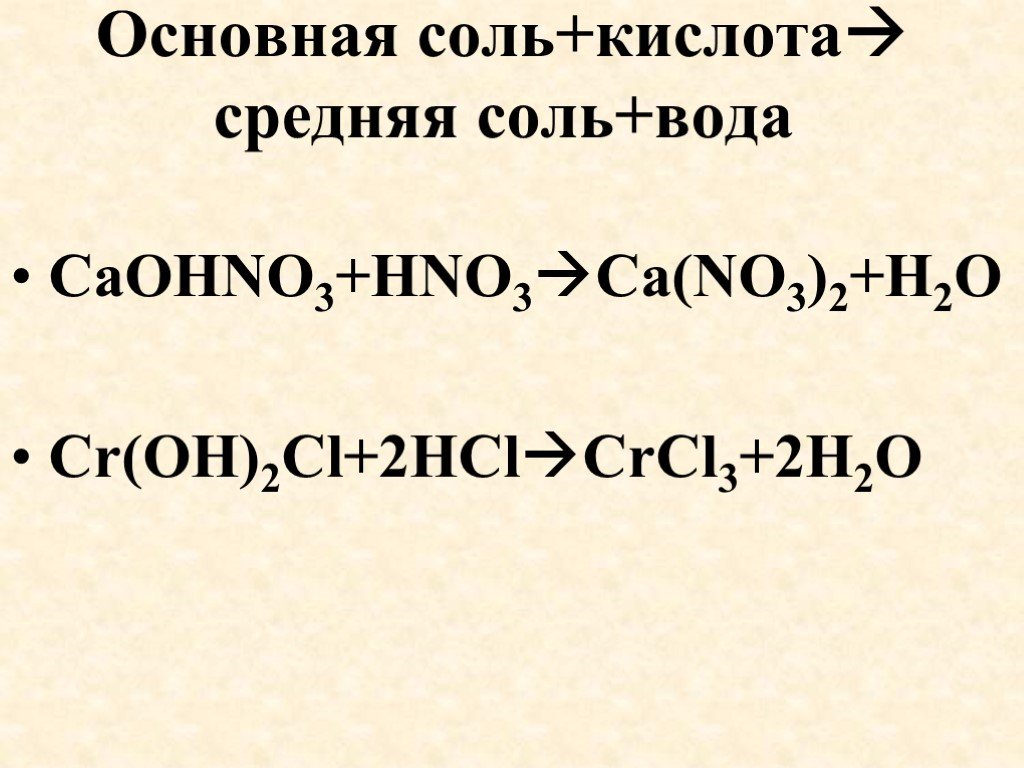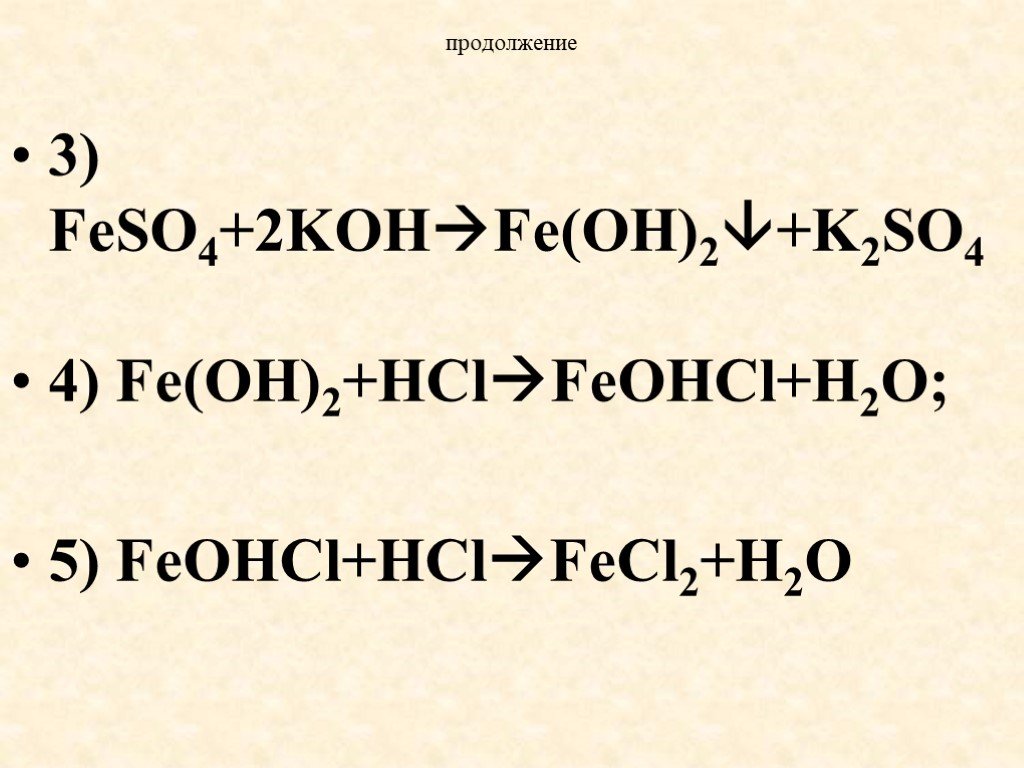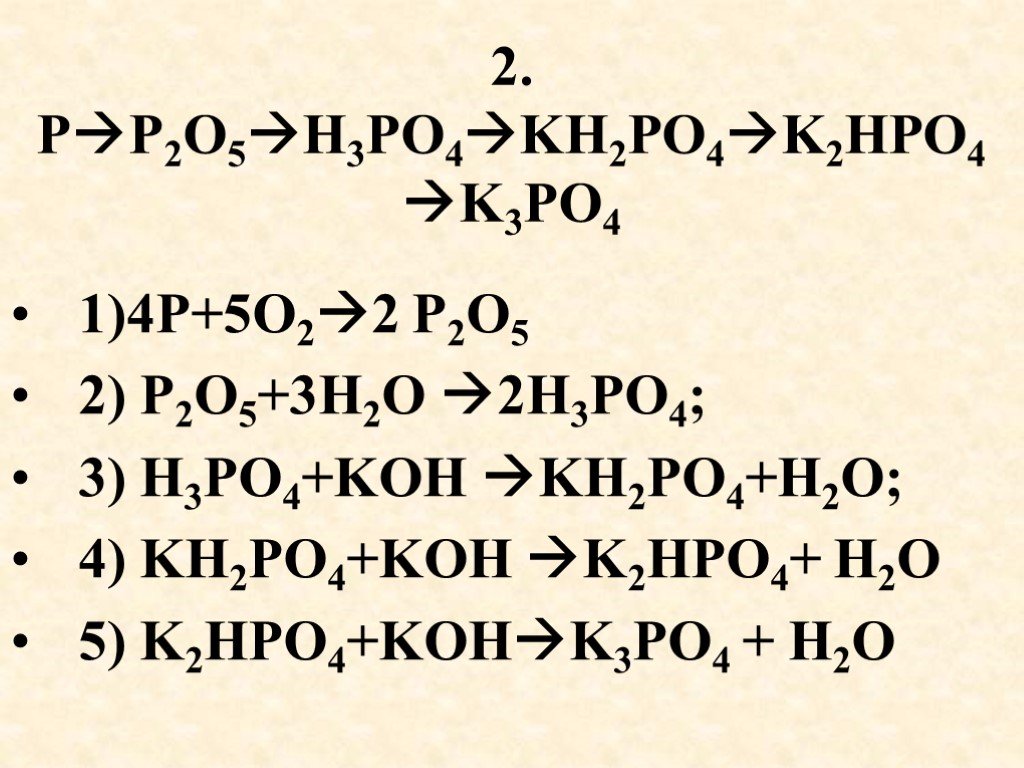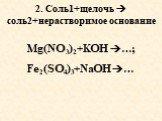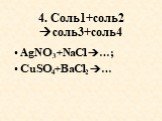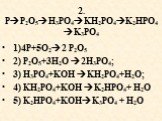Презентация "Получение солей" по химии – проект, доклад
Презентацию на тему "Получение солей" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 33 слайд(ов).
Слайды презентации
Список похожих презентаций
Получение радиоактивных изотопов и их применение
Определение. Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, ...Получение металлов
Металлы в природе. Самородные металлы (золото, серебро, медь, платина ). Минералы (красный железняк, цинковая обманка, галенит, киноварь и т.д.). ...Получение полимеров
Классификация полимеров. Классы полимеров Биополимеры. Синтетические полимеры. Искусственные полимеры. Полисахариды Белки Крахмал Целлюлоза. Натуральный ...Получение и свойства алканов
Оглавление. Определение Гомологического ряд метана Строение молекулы метана Номенклатура Изомерия Получение Физические свойства Химические свойства ...Получение и химические свойства кислорода
Цели и задачи урока:. Выяснить источник кислорода в природе; познакомиться с лабораторными и промышленными способами получения кислорода Познакомиться ...Применение солей в быту
СОЛИ, О КОТОРЫХ СЕГОДНЯ ПОЙДЕТ РЕЧЬ: Поваренная соль Питьевая или пищевая сода Хлорная известь Поташ Медный купорос Железный купорос Марганцовка Гидросульфит ...Химические свойства солей
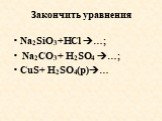
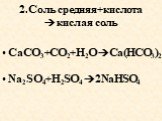
Определение солей. Мех(КО)у. КО - кислотный остаток. Na2SO4 2Na+ +SO42- CaCl2 Ca2+ + 2Cl-. Na2SO4 CaCl2 Сульфат натрия Хлорид кальция. Соли – ...Гидролиз солей
СОДЕРЖАНИЕ Определение. Типы солей,участвующих в гидролизе. Алгоритм составления уравнений гидролиза. Применение гидролиза. Примеры солей,участвующих ...Диссоциация солей
Что такое основание в свете теории электролитической диссоциации? Задание 1: Выберите тот ряд, в котором находятся только основания и дайте им названия. ...Гидролиз солей
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды. В процессе гидролиза соли в водном растворе ...Гидролиз солей
ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ. Тема: Гидролиз солей. Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать ...Гидролиз солей
Гидролиз – это реакция обменного разложения веществ водой. Гидролиз органических веществ. 1. Гидролиз галогеналканов. С2Н5Сl + Н2О →С2Н5ОН + НСl 2. ...Гидролиз неорганических солей
Словарь. Гидролиз – реакция обмена между растворимыми солями и водой Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, ...Влияние внешних условий на рост кристаллов различных солей
Объект исследования:. насыщенные растворы медного купороса CuSO4∙5Н2О; алюмокалиевых квасцов KCl(SO4)2*12H2O. Задачи исследования:. приготовление ...Получение сивушных масел и спирта при брожении углеводов
Fusel oil (сивушные масла). Смесь изомеров бутилового и амилового спиртов: ОН СН3-СН-СН2-СН3 СН3-С-СН3 ОН СН3 СН3-СН2-СН-СН2-СН3 СН3-СН - СН-СН3 ОН ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Получение фосфора (Р)
Фосфор (Р). Фосфор-это химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической ...Классификация солей
Задачи урока: Познакомиться с понятиями кислые, средние, основные соли. Свойства оснований. А) P2O5 + 6KOH = 2K3PO4 + 3H2O P2O5 + 6K+ + 6OH- = 6K+ ...Химические свойства бензола. Получение, применение
1. Дегидрирование циклоалканов. 2. Дегидроциклизация (ароматизация алканов): 3. Получение бензола тримеризацией ацетилена. 4. Сплавление солей ароматических ...Моделювання процесу кристалоутворення солей з розчинів
Об’єкт дослідження – алюмокалієві галуни – подвійні солі калій та алюміній сульфатів. Предметом дослідження є лабораторне моделювання процесу природного ...Конспекты
Химические свойства солей
. Зайчикова Ирина Николаевна. МБОУ «Пригородная СОШ». Учитель химии, биологии. Разработка урока по химии в 8 классе «Химические свойства ...Сложные эфиры. Получение и своиства
Открытый урок. . учителя химии МБОУ "СОШ им.И.С.Багаева с.Сунжа". . Алборовой Светланы Вардановны. . на тему: «Сложные эфиры строение, свойства, ...Химические свойства растворов солей с точки зрения теории электролитической диссоциации
9 класс. Химия. . Тема: химические свойства растворов солей с точки зрения теории электролитической диссоциации. . Цель:. формировать представления ...Получение, собирание и распознавание газов
Кудрявцева Ирина Александровна. учитель химии. первой квалификационной категории. БОУ г.Омска «СОШ № 53». Конспект урока химии в 11 классе, ...Практическая работа №3 Получение аммиака и изучение его свойств
Дата_____________ Класс_______________. Тема:. . Практическая работа №3 Получение аммиака и изучение его свойств. Цели урока:. закрепить умения ...Получение и применение предельных одноатомных спиртов
Урок по теме:. 10 класс. «Получение и применение. . предельных одноатомных спиртов». Хабибярова А.А., учитель химии. Цель урока:. п. ознакомить ...Получение и свойства соединений металлов
Муниципальное общеобразовательное учреждение лицей. Технологическая карта урока по химии. Практическая работа. «Получение и свойства соединений ...Гидролиз солей
Тема урока:. . Гидролиз солей. Цели урока:. Сформировать представление о гидролизе, сущности гидролиза солей. . Научить ребят составлять уравнения ...Гидролиз солей
Муниципальное казённое общеобразовательное учреждение. «Кобыльская средняя общеобразовательная школа». Глушковского района Курской области. ...Гидролиз солей
Новикова Ирина Петровна. Учитель химии. МОУ Совхозная сош. Тамбовский район. Тема урока: «Гидролиз солей». Тип урока:. Изучение нового материала. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Химия
Содержит:33 слайд(ов)
Поделись с друзьями:
Скачать презентацию