Презентация "Неметаллы.Применение неметаллов" по химии – проект, доклад
Презентацию на тему "Неметаллы.Применение неметаллов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
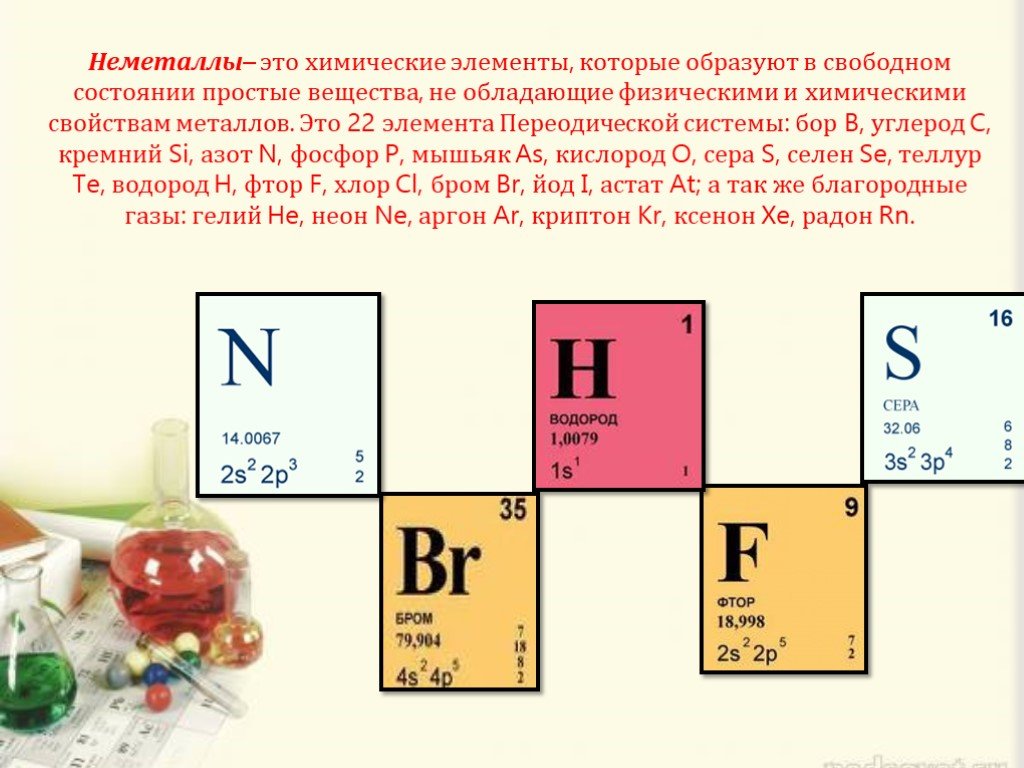
Характеристика неметаллов
Элементы с неметаллическими свойствами находятся в IIIA-VIIA - группах Периодической системы: III IV V VI VII B С N O F Si P S CI As Se Br Te I At. ...Положение металлов и неметаллов в периодической системе
Цель урока:. Изучить физические свойства металлов исследуя железо, алюминий, медь. Задачи урока:. 1.Изучить, на основе исследовательской работы с ...Примеры неметаллов
Цели и задачи урока. рассмотреть положение неметаллов в ПСХЭ Д.И.Менделеева и на основе строения атомов сделать вывод о физических и химических свойствах ...Общая характеристика неметаллов
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Неметаллы. Кислородные соединения неметаллов
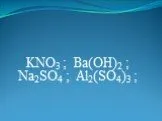
Кислоты. Высшим оксидам неметаллов соответствуют следующие кислоты. . Кислородосодержащие кислоты являются гидроксидами кислотных оксидов. По основности ...Водородные соединения неметаллов
метан аммиак вода сероводород кислоты. Метан. Газ без цвета и запаха, малорастворим в воде, легче воздуха, горит бледным синеватым пламенем. Смесь ...Химические свойства неметаллов
Цель. На этом уроке мы поведем разговор о простых веществах – неметаллах, их химических свойствах. Вы должны усвоить общие химические свойства неметаллов ...Химия неметаллов
НЕМЕТАЛЛЫ. ОБЩАЯ ХАРАКТЕРИСТИКА И СВОЙСТВА НЕМЕТАЛЛОВ. НЕМЕТАЛЛЫ В ПРИРОДЕ. В природе встречаются самородные неметаллы N2 и O2 (в воздухе), сера (в ...Аллотропные видоизменения неметаллов
Аллотропия неметаллов. Кислород, Озон. Кислород О2 при обычных условиях –газ без цвета и запаха, немного тяжелее воздуха в воде малорастворим. Жидкий ...Взаимодействие атомов элементов – неметаллов между собой
Что общего в составе частиц:. 1) 11H0, 21H0, 31H0 2) 168O0 , 168O2- , 178O0 3) 11H-, 21H-, 42He0. Разделите элементы на две группы: Cl, Mg, O, P, ...Ломоносов и химия
В 2011 году исполнится 300 лет со дня рождения великого русского ученого, основателя Московского государственного университета Михаила Васильевича ...Коррозия металла химия
Цель презентации. В этой презентации мы рассмотрим процесс коррозии металлов как окислительно-восстановительную реакцию. Изучим : что такое коррозия; ...Своя игра. Физика и химия
Интегрированный урок ФИЗИКА+ХИМИЯ. Авторы: Орлова И.В., Шувалова Л.В. Муниципальное образовательное учреждение Фоминская средняя общеобразовательная ...Строение вещества химия
СТРОЕНИЕ ВЕЩЕСТВА. Основополагающий вопрос КАК УСТРОЕН МИР? Проблемные вопросы Из чего сделано все на Земле? Почему все устроено так, а не иначе? ...Простые вещества - металлы и неметаллы
Цель урока:. Повторение основных сведений о простых веществах – металлах и неметаллах, путём выполнения различных заданий. Вопросы для обсуждения:. ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Металлы и неметаллы
Классификация веществ по составу:. Простые вещества состоят из атомов одного химического элемента. Сложные вещества состоят из атомов разных химических ...Незнайка в стране химия
Я – известный химик Незнайка. Я знаю все и все могу. Сейчас я взмахну волшебной палочкой и начнется извержение вулкана. Смотри! А теперь все за мной ...Конспекты
Химические свойства неметаллов и их соединений. Кислотные дожди
Разработка урока «Химические свойства неметаллов и их. . соединений. Кислотные дожди» 9 класс. . учителя химии МБОУ ССОШ №13 Зимовниковского ...Основные месторождения металлов и неметаллов в Казах¬стане и проблемы защиты окружающей среды при процессах добычи и переработке сырья
Урок №20, химия 10 класс. тема: Основные месторождения металлов и неметаллов в Казахстане. и проблемы защиты окружающей среды при процессах добычи ...Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия
Тема:Положение неметаллов в периодической системе химических элементов Д.И. Менделеева, строение их атомов, физические свойства. Аллотропия. Цели ...Общая характеристика неметаллов
Тема урока «. Общая характеристика неметаллов. »,. 9 класс. Федотова Е. Г. учитель химии МБОУ СОШ №4 г. Южно-Сахалинск. Цель:. Используя антитезу ...Общая характеристика неметаллов
Конспект урока по химии. Тема урока: «Общая характеристика неметаллов». УМК:. Габриелян О.С. Химия 9 кл. Возраст: 9 класс. Учителя химии ...Общая характеристика металлов и неметаллов
П . лан- конспект урока "Общая характеристика металлов и неметаллов". . Девиз урока. : “Зажечь, увлечь и повести”. . Цели. В нетрадиционной ...Неметаллы. Общая характеристика неметаллов
. План-конспект урока химии в 9 -м классе с использованием ЦОР по теме: «Неметаллы. Общая характеристика неметаллов». Автор: Кобелева Вера Ивановна. ...Водородные и кислородные соединения неметаллов
Описание методической разработки урока по химии. 1.Район: Кукморский. 2 Ф.И.ОГалимова Суфия Хатимовна. 3.Номинация: Методические материалы ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:28 августа 2018
Категория:Химия
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию