Презентация "Изготовление моделей веществ с водородной связью" по химии – проект, доклад
Презентацию на тему "Изготовление моделей веществ с водородной связью" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 16 слайд(ов).
Слайды презентации
Список похожих презентаций
Изготовление моделей веществ с водородной связью
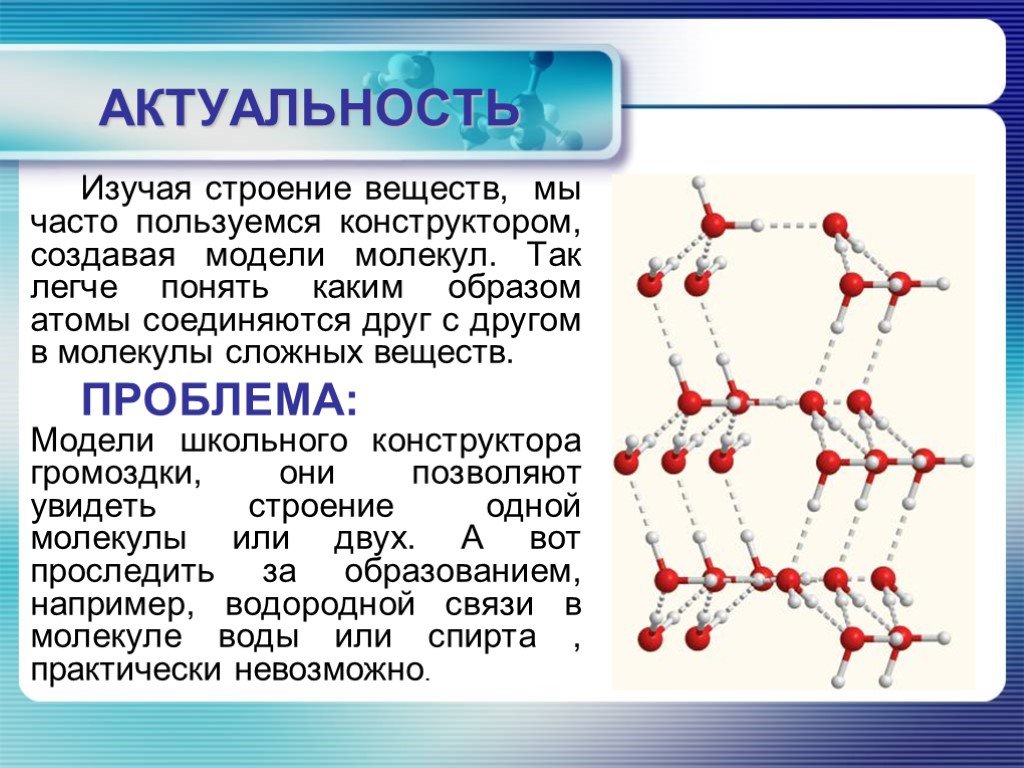
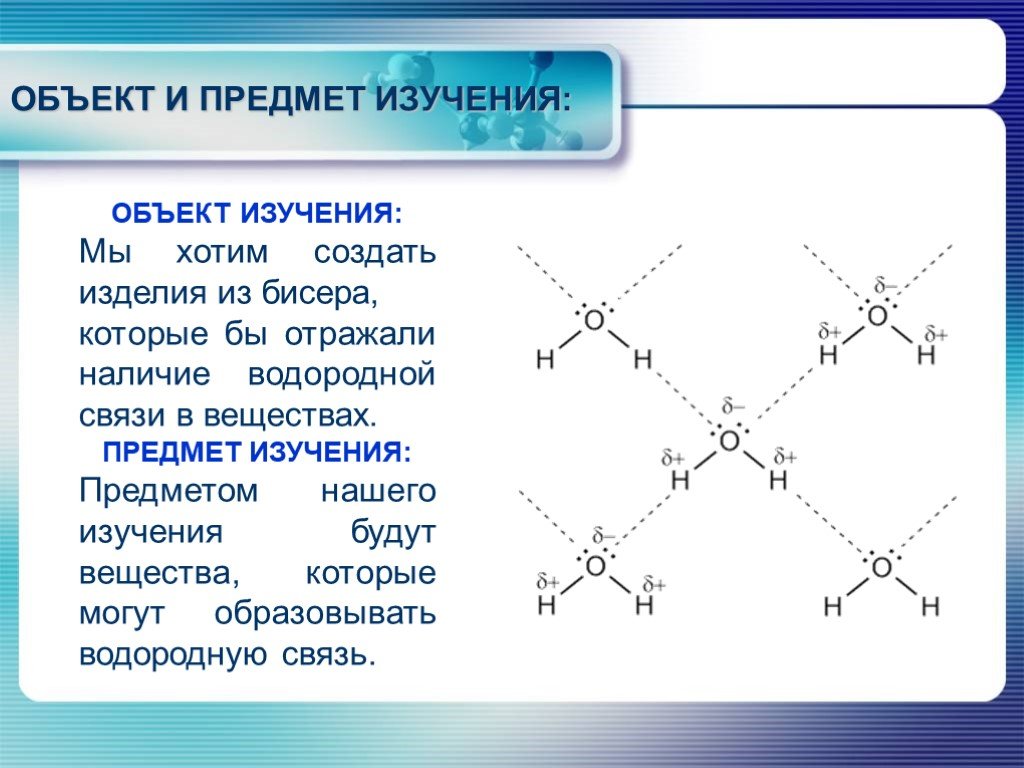
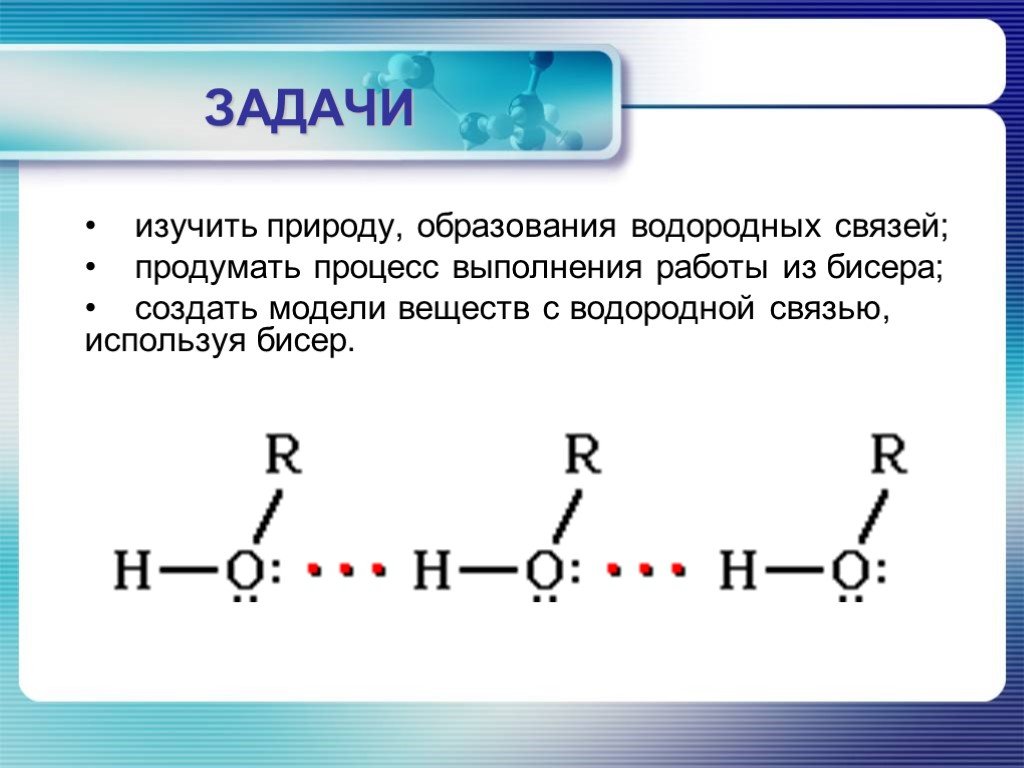
АКТУАЛЬНОСТЬ. Создать модели веществ с водородной связью. ЦЕЛЬ:. ОБЪЕКТ ИЗУЧЕНИЯ: Мы хотим создать изделия из бисера, которые бы отражали наличие ...Создание и использование комплекса моделей атомов и молекул для изучения строения вещества в курсе химии средней школы
Обзор содержания курса химии 8-11 классов. . . . Классификация моделей. Материальные Идеальные Статические Динамические Раздаточные Демонстрационные ...Основные классы неорганических веществ
Вспомним теорию. Какие вещества вы знаете? Какие вещества назы- ваются сложными? Что такое оксиды,кис- лоты,основания и соли? Распределить вещества ...Превращения веществ
Интегрированный урок по окружающему миру и химии по теме. «Тела и вещества. Превращения веществ». Цель урока:. Подвести учащихся к пониманию термина ...Многообразие веществ
1. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому оно принадлежит. Название вещества Класс ...Обобщение сведений об основных классах неорганических веществ
Цель урока. Обобщение и систематизация знаний по основным классам неорганических веществ. Задачи урока. 1)образовательная: а)отработать умение записывать ...Чистые вещества и смеси веществ
П л а н у р о к а. 1. Чистые вещества и смеси. Отличительные особенности. 2. Однородные и неоднородные смеси. 3. Способы разделения смесей. Что такое ...Круговорот веществ
Углерод является основным «строительным материалом» молекул углеводов, жиров, белков, нуклеиновых кислот (таких, как ДНК) и других важных, для жизни ...Генетическая связь между классами неорганических веществ
А13-6-2009. В схеме превращений веществом «X2» является 1) Fe2O3 2) FeO 3) FeCl3 4) FeCl2. А13-2-2009. В схеме превращений веществами «X1» и «X2» ...Свойства простых веществ
Металл + Неметалл = Оксид. Составьте уравнения реакций лития, кальция, алюминия с кислородом. 4Li + 2O2 = 2Li2O 2Ca + O2 = 2CaO 4Al + 3O2 = 2Al2O3. ...Генетическая связь веществ
Найдите ошибки в уравнениях:. Na+SO42- + Ba2+Cl- = BaSO4 + NaCl Ba + SO4 = BaSO4. CaO, CO2 , MgO, C, H2CO3, Ca, NaCl, Ca(OH)2, NaOH, CaCO3, H2SO4. ...Генетическая связь между классами неорганических веществ
Взаимосвязь между классами веществ выражается генетическими цепочками. Генетический ряд – это осуществление химических превращений, в результате которых ...Влияние химических веществ на рост и развитие растений
Цель исследования: выяснить стимулирующее влияние обработки семян различными химическими веществами на развитие растений фасоли. Гипотеза: Обработка ...Взаимосвязь путей обмена веществ
Включение безазотистого остатка аминокислот в общий путь катаболизма. Взаимосвязь гликолиза и гликонеогенеза. Гликонеогенез из липидов. дегидро-геназа. ...Вещество. Свойства веществ
Вещество-это то, из чего состоит физическое тело. Задание. Нарисуйте тела для перечисленных веществ. тело вещество. Стекло Пластмасса древесина. Вещество ...Важнейшие классы неорганических веществ
Неорганические вещества. Простые Сложные. Простые вещества Металлы Неметаллы. Сложные вещества. Оксиды - сложные вещества, состоящие из двух химических ...Гидролиз органических веществ, содержащихся в продуктах питания человека
Цели и задачи проекта:. Показать практическую значимость знаний, полученных при изучении органической химии и биологии в 10 классе; Систематизировать ...Реакции веществ
Цель создания данной работы – показать возможности использования мультимедийных технологий и интерактивной доски на уроках химии. Фрагменты презентаций ...Группа веществ, изолируемых из биологического материала дистилляцией
ТОКСИКОДИНАМИКА И ТОКСИКОКИНЕТИКА ЛЕТУЧИХ ЯДОВ. Абсорбция происходит в альвеолах, в верхних отделах дыхательных путей. Распределение. Растворители, ...Теория химического строения органических веществ
"Просто знать - мало, знания нужно уметь использовать" Гёте. Кластер ОО. Органическая химия. Органические вещества. Теория химического строения. Валентные ...Конспекты
Виды химических связей. Типы кристаллических решеток. П.р. Изготовление моделей молекул
План учебного занятия № 5. Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. Виды химических связей. Типы ...Решение задач на вычисления, связанные с участием веществ, содержащих примеси
Тема: Решение задач на вычисления, связанные с участием веществ,. содержащих примеси. Цели: 1) Формировать умения решения расчетных задач на вычисления,. ...Путешествие в мир веществ
Балыклинский филиал ГБОУ СОШ с.Камышла. Урок химии в 8 классе. «Путешествие. в мир веществ. ». . Цели:. Отработать умения, ...Предмет органической химии. Особенности строения органических веществ
Муниципальное бюджетное образовательное учреждение. . «Аргуновская средняя общеобразовательная школа». Никольский район. Вологодская область. ...Основные классы неорганических веществ
Тема урока:. . «Обобщение по теме: «Основные классы неорганических веществ»». . форма проведения урок-путешествие. Задачи:. Закрепление и ...Основные классы неорганических веществ
Интеллектуальная игра по теме. . «Основные классы неорганических веществ». Цель:. способствовать формированию интереса к химии, развивать творческие ...Основные классы неорганических веществ
Химический бой. 8-9 класс. Закрепление: «Основные классы неорганических веществ». Цель:. обобщить знания учащихся по теме «Основные классы неорганических ...Обобщение сведений об основных классах неорганических веществ
Урок по химии в 8 классе. . Тема: «Обобщение сведений об основных классах неорганических веществ». . Цель:. обобщение и систематизация знаний ...Гидролиз неорганических веществ
Тема « Гидролиз солей» рассчитана по программе на 2 часа. Целью всей темы является усвоение понятия гидролиз соли и отработка умения составлять уравнения ...Генетическая связь между классами веществ
Муниципальное общеобразовательное учреждение. лицей № 9. имени заслуженного учителя школы Российской Федерации А.Н.Неверова Дзержинского района ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:16 слайд(ов)
Поделись с друзьями:
Скачать презентацию