Презентация "Кислород" (9 класс) по химии – проект, доклад
Презентацию на тему "Кислород" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
Кислород О2
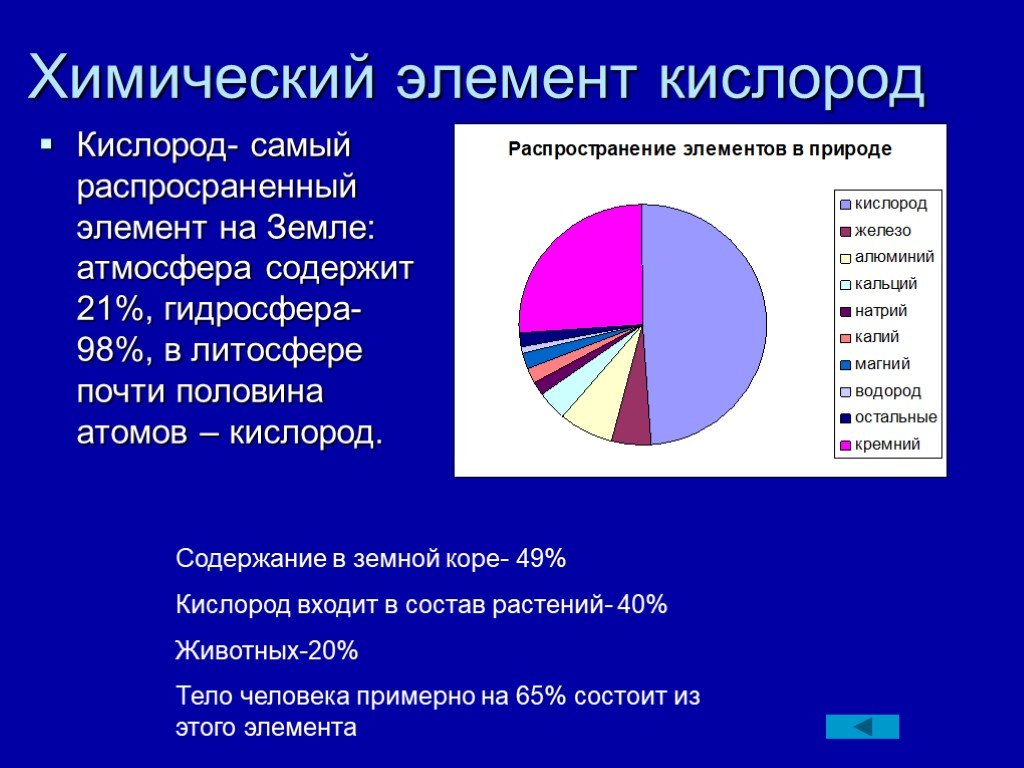
Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, 2. Строение атома: P11 = 8; n01 ...Кислород и сера и их характеристика
Положение в периодической системе. КИСЛОРОД и СЕРА элементы VIA группы периодической системы Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ, ...Кислород как химический элемент и простое вещество
Тема урока. «Кислород как химический элемент и простое вещество». «Dum spiro spero»…… Пока дышу, надеюсь…. Кислород – это вещество, вокруг которого ...Кислород – основа жизни?
Строение атома О ) ) 1s2 2s2 2p6 +8 2 6 8 е. История открытия кислорода. Швед К. Шееле путем нагревания селитры Англичанин Дж. Пристли при нагревании ...Кислород и водород
повторить физические и химические свойства водорода и кислорода, распространение их в природе вспомнить уравнения горения простых и сложных веществ ...Кислород
Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar = 16. 2. Строение атома: P11 ...Кислород - химический элемент
познакомиться с историей открытия кислорода; рассмотреть распространение кислорода в природе; дать общую характеристику элементу кислород; изучить ...Кислород
Природный кислород состоит из …. Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней ...Кислород
Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, 2. Строение атома: P11 = 8; n01 ...Кислород
Содержание: Общие понятия История открытия Физические свойства Химические свойства Взаимодействие Применение кислорода Получение кислорода. Кислоро́д ...Кислород
Положение в периодической системе. В периодической таблице химических элементов кислород О расположен во втором периоде главной подгруппы VI группы. ...Кислород
В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород ...Кислород
Которое зовут озоном. И в этом есть большой резон: В грозу запахнет над газоном – От слова «пахнущий» - озон. Как по составу различают Два аллотропных ...Кислород
31.08.2018. Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar = 16. 2. Строение ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Кислород
«Спешите спасти Землю». В первой половине XIX века появилось слово «кислород» в переводе с греческого языка означает «кислый» , «рождаю». До этого ...Урок Кислород
Цели :. 1. Помочь учителю в работе по усвоению програмного материала учащимися в процессе изучения химии в 8 классе по теме «Кислород. Нахождение ...Кислород
Кислоро́д — элемет главной подгруппы VI группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. ...Где используется кислород?
Кислород – это вещество, вокруг которого вращается вся земная химия. (Я.Берцелиус). Кислород играет исключительную роль в существовании на Земле жизни ...М.В. Ломоносов и химия
- М.В. Ломоносов был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). - Он разработал технологию и ...Конспекты
Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия. Тип урока:. комбинированный,. язык обучения. : русский. Оборудование:. флипчарт, ...Кислород, его общая характеристика и нахождение в природе. Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Краснощёковская средняя общеобразовательная школа№1». Краснощековского района. . Алтайского ...Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода
Урок химии в 8 классе «Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода». Цель: . изучение и первичное осознание ...Кислород и Озон: значение, получение, физические и химические свойства, применение
Тема урока: « Кислород и Озон: значение, получение, физические и химические свойства, применение.». Цель: использование идей модуля «Обучение критически ...Кислород химический элемент и простое вещество
«Утверждено. » «Рассмотрено». Директор школы: ________________ Зам УВР: ________________. Урок №. 34. дата. ____________. Краткосрочное планирование ...Кислород в природе как химический элемент. Оксиды
МОУ Бендерская гимназия №2. . Урок химии 8 класс. По теме:«Кислород в природе как химический элемент. Оксиды». . ...Кислород — химический элемент и простое вещество. Получение кислорода
Муниципальное общеобразовательное автономное учреждение. . «СОШ № 10». Урок по теме "Кислород — химический элемент и простое ...Кислород
Тема урока: «Кислород». Цели:. Образовательные:. . закрепить:. . -умения в составлении формул оксидов, уравнений реакций горения простых ...Кислород
Тема урока: Кислород. Цели урока:. . . Цель: Познакомить учащихся с элементом кислородом в свете ПСХЭ. Дать характеристику физическим и химическим ...Кислород
Тема урока:. «Кислород». Цель урока:. использовать практико-ориентированный подход с целью создания оптимальных условий для мотивации познавательной ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:5 сентября 2018
Категория:Химия
Классы:
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию