Презентация "Кислород и сера и их характеристика" по химии – проект, доклад
Презентацию на тему "Кислород и сера и их характеристика" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Кислородные соединения азота и их свойства
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Неметаллы и их характеристика
Разгадайте ребусы и назовите три химических элемента названия которых здесь зашифрованы:. уГ+лес,Т=Д , газ + , ,,,+. К какой группе относятся эти ...Кислород. Общая характеристика, получение и свойства
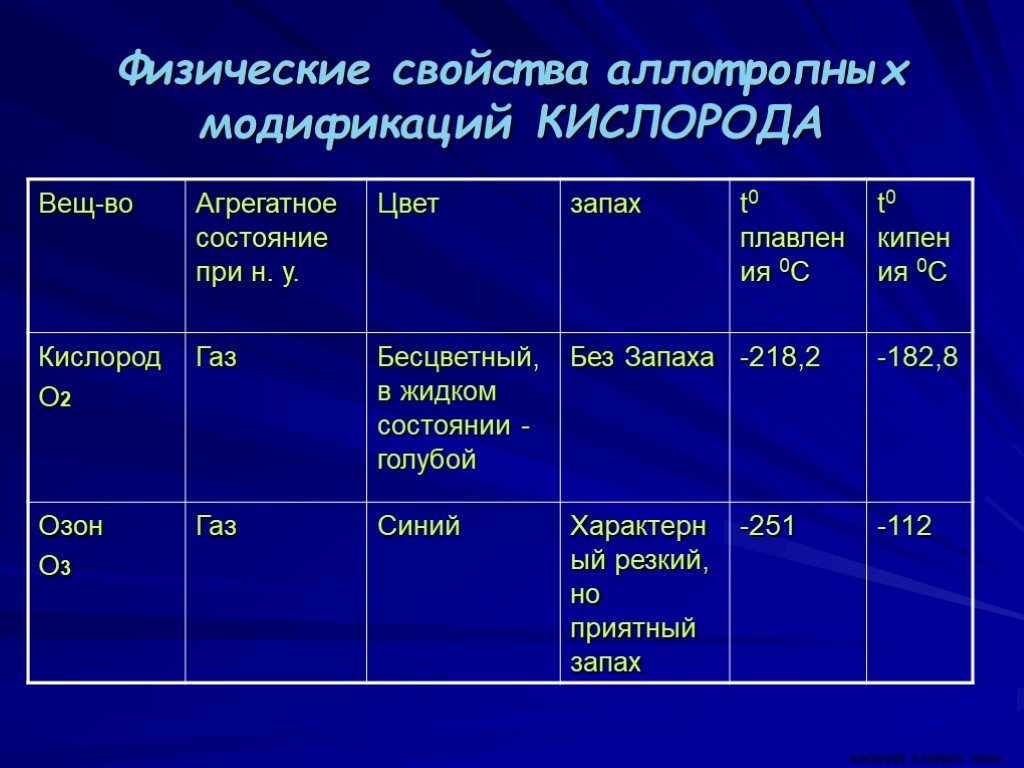
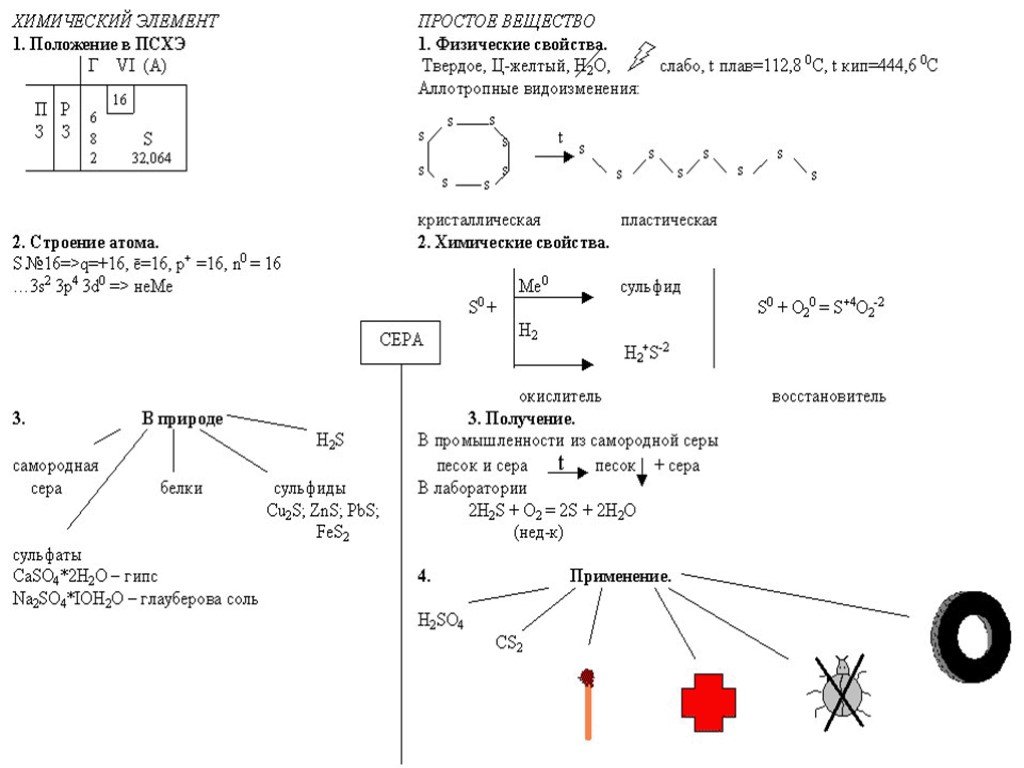
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II. Кислород. Простое вещество Неметалл Молекула – О2 Относительная ...Общая характеристика галогенов
Цели урока:. 1.Систематизировать знания учащихся о галогенах. 2.Ознакомить учащихся с окислительными свойствами галогенов. 3.Повторить, обобщить и ...Ниобий и тантал. Свойства элементов и их соединений
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Металлы и их соединения
Определите металл. 1. Этот металл легче свинца в 5 раз, а золота – в 20 раз. Стержень этого металла пишет по бумаге. 2. «Зелёное золото» содержит ...Кислород и водород
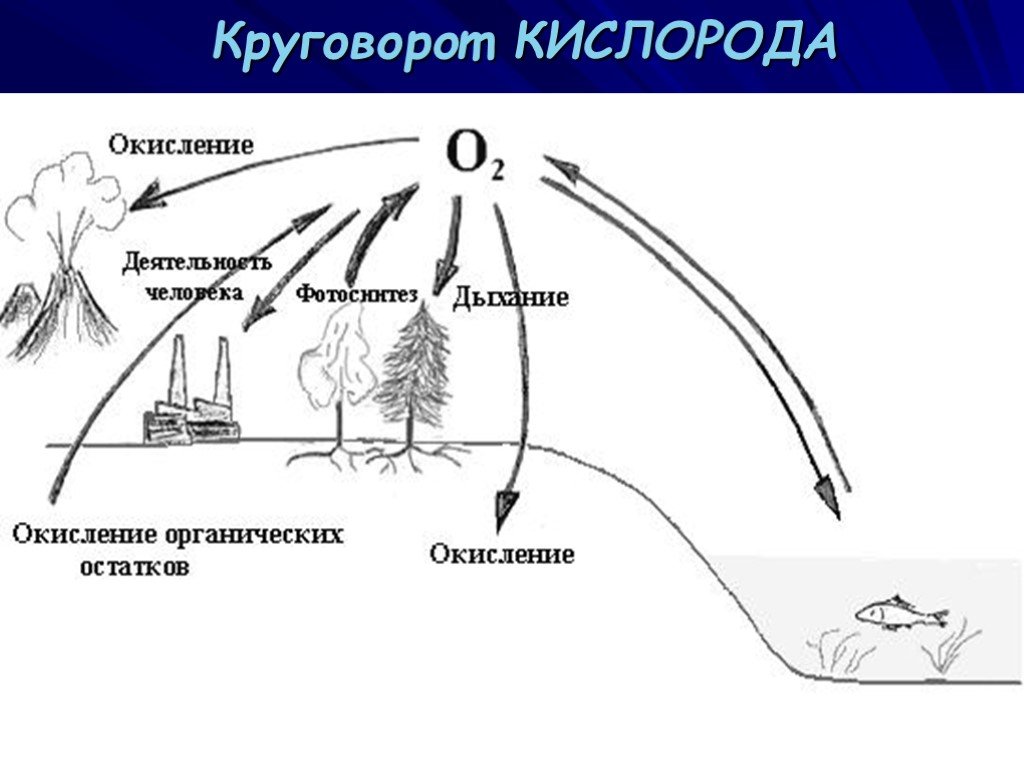
повторить физические и химические свойства водорода и кислорода, распространение их в природе вспомнить уравнения горения простых и сложных веществ ...Кислород
Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, 2. Строение атома: P11 = 8; n01 ...Алюминий и его характеристика
Цель урока. Рассмотрение характеристики алюминия по трем формам существования химических элементов: атомов, простых и сложных веществ. Задачи урока. ...Альдегиды и их свойства
Содержание Строение молекул Изомерия и номенклатура Физические свойства Получение Химические свойства Применение Контрольные вопросы. Альдегиды – ...Алкины и их свойства
Непредельные углеводороды с тройной связью С=С в молекулах. Простейший представитель ряда – ацетилен С2Н2, общая формула СnH2n-2 (n>2). Атомы углерода ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Азотные удобрения и их роль
Роль азота в жизни растений. Азот - важнейший питательный элемент для всех растений. Он входит в состав таких важных органических веществ как белки, ...Азот. Общая характеристика
Азот – это вечный источник танталовых мук человечества, это вечные терзания голода среди океана изобилия. М.Камен (американский биохимик). Источник ...Общая характеристика оксидов
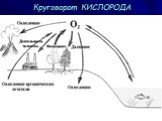
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2, Al2O3, CO. Оксиды. Оксиды – соединения элементов ...Кислород
Положение в периодической системе. В периодической таблице химических элементов кислород О расположен во втором периоде главной подгруппы VI группы. ...Аминокислоты. История их открытия
История открытия. К началу XIX столетия появляются первые работы по химическому изучению белков. Уже в 1803 г. Дж. Дальтон дает первые формулы белков ...Кислород - химический элемент
познакомиться с историей открытия кислорода; рассмотреть распространение кислорода в природе; дать общую характеристику элементу кислород; изучить ...Ароматические эфирные масла и их использование
Объект исследования:. Ароматические эфирные масла. Предмет исследования:. влияние ароматических масел на организм человека; эфирные масла – натуральные ...Кислород О2
Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, 2. Строение атома: P11 = 8; n01 ...Конспекты
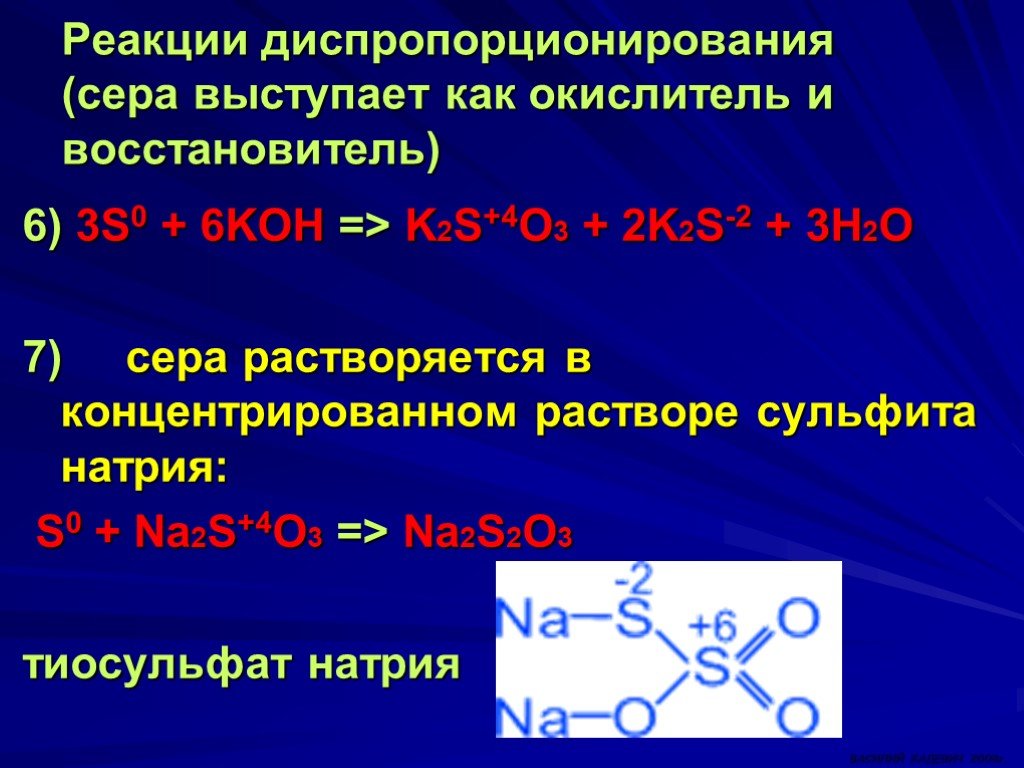
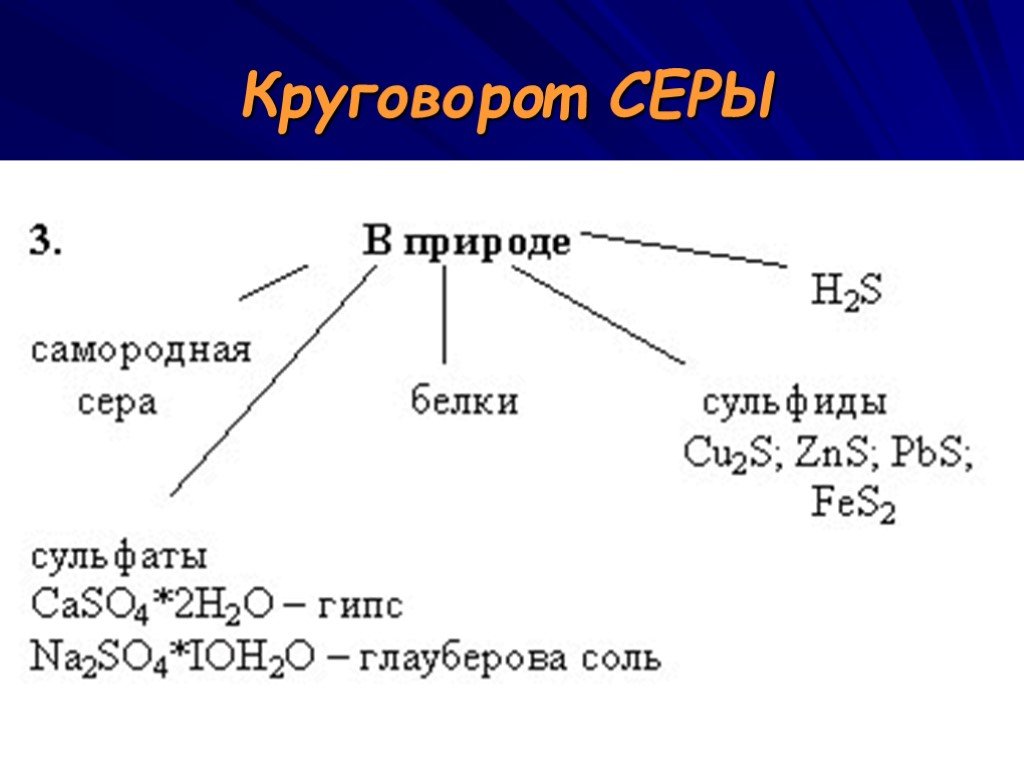
Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли
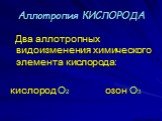
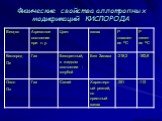
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия. Тип урока:. комбинированный,. язык обучения. : русский. Оборудование:. флипчарт, ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон – аллотропная модификация кислорода
Дата _____________ Класс ___________________. Тема: Положение кислорода и серы в периодической системе химических элементов, строение их атомов. ...Кислородсодержащие органические соединения и их природные источники
ПЛАН-КОНСПЕКТ УРОКА. «Химические свойства спиртов». . ФИО (полностью). . Хочуева Фатима Заурбековна. . . . Место работы. . ...Общая характеристика кислорода
Конспект урока по химии в 8 классе. Раздел « Кислород. Оксиды. Горение». Тема урока: «Общая характеристика кислорода». Цель урока: Формировать ...Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Общая характеристика неметаллов. Элементы IV А группы. Углерод, кремний и их соединения
План учебного занятия № 13. Дата Предмет. химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . І. Тема занятия:. Общая характеристика неметаллов. ...Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода
Урок химии в 8 классе «Кислород, его общая характеристика. Нахождение в природе.Получение и свойства кислорода». Цель: . изучение и первичное осознание ...Общая характеристика металлов и их значение для человека
Технология развития критического мышления. Интегрированный урок химии - биологии. на тему: «Общая характеристика металлов и их значение для человека». ...Кислород, его общая характеристика и нахождение в природе. Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Краснощёковская средняя общеобразовательная школа№1». Краснощековского района. . Алтайского ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон-аллотропная модификация кислорода
Технологическая карта урока. . . Учитель Дьячук Е.Ю. учитель химии МБОУ СОШ №1 г.Оха Сахалинская область. Предмет. химия. . Класс. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 октября 2018
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию