Конспект урока «Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли» по химии для 10 класса



 Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия.
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия.
Тип урока: комбинированный, язык обучения: русский.
Оборудование: флипчарт, ноутбуки, интерактивная доска, тестирующие устройства актив от, электронные учебники, карточки с заданиями, тесты на электронных носителях, опорная схема, оборудование и реактивы для химического эксперимента.
Урок: Общая характеристика элементов главной подгруппы VI группы. Кислород и сера. Нахождение в природе. Получение. Строение молекул. Аллотропные видоизменения. Важнейшие соединения: оксиды, кислоты и их соли. Обнаружение сульфат – иона. Применение кислорода, серы и их соединений. Физические и химические окислительно-восстановительные свойства.
Цель урока: На основе ранее изученного материала познакомить с особенностями элементов VIА группы на примере кислорода и серы, показав закономерности в свойствах соединений. Развивать логическое мышление, воспитывать умение работать в коллективе, взаимопомощь, отработать умение применять методы сравнения, объяснять, делать выводы, наблюдать, умение применять теоретические знания при решении практических задач, воспитывать интерес к науке.
План урока:
1.Организационный момент
2. Опрос: пары учитель – ученик, индивидуальный при помощи тестов на компьютере (4 варианта), фронтальный при помощи слайд – фильма, решение задач, опрос у доски, 3 имеют индивидуальное задание.
3. Введение новых знаний с элементами работы на компьютере по электронным учебникам, с решением задач исследовательского характера.
4. Обобщение при работе в группах и парах
5. Разноуровневое и творческое домашнее задание.
На доске: «Химия в руках человека является ключом к познанию тайн природы». (И. Гете).
Урок начинается с приветствия учителя: под шум волн Балхаша учитель представляется, и знакомиться с классом. Познакомимся мы с вами необычным способом, у вас на столе 4 карточки красного, синего, зелёного и жёлтого цвета. Выберите ту, которая больше всего нравиться, положите её первой, из оставшихся трёх, ещё одну и положите её к первой, затем из оставшихся двух выберите, ту, которая вам по душе и положите её к первым двум и добавьте к полученному ряду последнюю. Полученную цветовую гамму запишите в тетрадях. На карточке, которая понравилась больше всего напишите своё имя и поставьте её на стол. Ваши цветовые пристрастия мне кое – что о вас рассказали, этот тест психологи применяют для изучения характера человека, так как мы с вами избирательно реагируем на цвет, а почему я выбрала такой способ знакомства и начала урок под шум любимого озера вы мне ответите чуть позже. А сейчас перед тем как начать изучение темы урока мы с вами повторим и проверим домашнее задание.
4 ученика работают на компьютере, проходят тестирование (4 варианта), создается 2 пары учитель – ученик, которые работают по домашнему заданию с контрольным вопросом учителя, 3 работают у доски, 1решает задачу, другой – цепочку превращений, третий – устный ответ об элементах 5А группы, 3 имеют индивидуальные задания. Остальные работают фронтально с учителем по слайд – вопроснику.
Задание для учащихся у доски:
1 ученик: Решите цепочку превращений, там, где возможно приведите уравнения в ионном виде.
Al ↔ Al2O3 → AlCl3 ↔ Al(OH)3 → Al2(SO4)3→BaSO4
↓
Na[Al(OH)4]
2ученик: При полном электролизе раствора сульфата меди (w = 16%, ρ = 1,02 г/мл) получено 12,8 г металла. Какой объем раствора CuSO4 был израсходован?
Слушается ответ у доски, вопросы задают учащиеся.
Молодцы, вы видите в задаче в процессе электролиза образовалась серная кислота, это важнейшее соединение элемента, о котором и его группе мы будем сегодня говорить? А какая это группа? Ответить на вопрос мой вам поможет ребус:

Халькогены
,,
Молодцы, это элементы VI А группы. А почему они так названы? Какие элементы в эту группу входят? Озвучивается тема и цели урока. Помните я начала наш урок со звуков Балхашской волны и цветных карточек? Почему? Как вы думаете? Действительно вода – это самое важное вещество на земле и это соединение кислорода, а сера – это важнейшая часть кадмиевых красок. А более подробно об элементах этой группы вы узнаете, поработав в группах – научных центрах с ноутбуками, электронными учебниками, класс делиться на группы.
Научный центр - статисты, которые будут давать общую характеристику группе, понятию аллотропия.
Научный центр – физико – географо - биологический, задача которого дать общую характеристику, физическим свойствам, биологической роли и применению, получению кислорода и серы.
Химический научный центр, который будет давать химические свойства кислорода и серы.
Научный цент по соединениям работает в двух отделах: оксиды и кислоты серы, задача которых дать характеристику этим соединениям.
Аналитический центр, задача которого изучить качественные реакции на обнаружение сульфат – иона.
На работу групп отводиться 7 минут, у каждой группы, на столе лежит опорная схема и во время ответов она выводиться на интерактивной доске.

О – 1772 г. Шееле
S - с древности
Se - 1817 г. Берцелиус
Te - 1782 г. Мюллер – фон Райхенштайн
Po – 1898 г. супруги Кюри
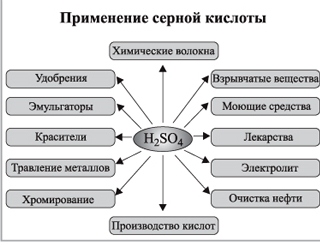
Применение:
Биологическая роль:


Во время объяснения нового материала демонстрируются видео фрагменты по свойствам элементов этой группы.
Выступление аналитического центра.
Обобщим наш материал, я задаю первый вопрос, кто на него ответит, задает свой любому ученику класса. (3 минуты), игра « учитель всегда прав».
По окончании обобщения класс проходит контрольное тестирование с помощью тестирующих устройств Аktiv vot.
Рефлексия: Китайская мудрость гласит «Даже если вы достигли вершины горы, продолжайте карабкаться дальше. Многие армянские сказки заканчиваются фразой: «… первое яблоко тому, кто рассказывал. Второе – тому, кто слушал. А третье-кому? Тому – кто понял». Я уверена, что сегодня с урока вы уходите с яблоками, хотя и виртуальным. Спасибо за сотрудничество! Урок окончен! До свидания! Всем добра и успехов!
Итоги, оценки.
Домашнее задание: §§ 8.14- 8.19, стр. 268-269 «3» в. 1-4, «4» в. 1-8, «5» в. 1-12.
Творческое задание: напишите химическую сказку о соединениях элементах VI А группы.
Приложение № 1:
Индивидуальное задание № 1.
Задание: Напишите уравнение реакции, происходящей между кальцием и концентрированной азотной кислотой. Расставьте коэффициенты методом электронного баланса. Вычислите объём выделившегося газа и массу соли, если для неё взято 20 г. металла и 63 г. кислоты.
Индивидуальное задание № 2.
Задание: Напишите уравнения реакций, позволяющие осуществит следующие превращения: С→СаС2→С2Н2→СО2→Na2CO3→CO2↔CO, там где возможно уравнения представьте в ионном виде.
Индивидуальное задание № 3.
Задание: Составьте уравнение взаимодействия оксида магния с азотной кислотой, представьте уравнение в ионном виде. Вычислите массу полученной соли, если для реакции использовали 4,8 г металла и 21 г. кислоты.
Задания научным центрам:
Научный центр - статисты- дайте общую характеристику VI А группе, годы и авторов открытия элементов этой группы, проследите изменение свойств в группе, перечислите степени окисления, дайте понятие аллотропии, применение и биологическая роль.
Научный центр – физико – географо – биологический - Дайте в сравнительной характеристике, нахождение в природе, строение, получение, физические свойства кислорода и серы, промышленные центры
Химический научный центр - Сравните химические свойства кислорода и серы.
Научный цент по соединениям - отдел оксиды и отдел кислоты.
Дайте характеристику, строение, физические и химические свойства оксидов серы и кислот серы.
Аналитический центр – практически докажите свойства серы, проанализируйте и проведите реакции, с помощью которых можно обнаружить сульфат и сульфит ионы.
Дано: S, химическая ложечка, нагрев, вода, индикатор, сульфит натрия, сульфат натрия, нитрат бария, соляная кислота, гидроксид натрия. Проведите реакции горения серы, растворение продукта горения в воде, определите индикатором характер полученного соединения. Проанализируйте и проведите качественные реакции на сульфит и сульфат ионы.
Приложение № 2.
Красный цвет - Человек отличается смелостью, силой воли, властностью, вспыльчивостью, общительностью, склонностью к альтруизму, если это его любимый цвет. У людей, которых этот цвет раздражает, развиты комплекс неполноценности, страх перед ссорами, любовь к уединению, нестабильность в отношениях.
Синий цвет - Поскольку это цвет неба, то его обычно связывают с духовной возвышенностью человека, его чистотой. Приверженность к нему говорит о скромности и меланхолии. Такому человеку нужно часто отдыхать, он быстро и легко устает, для него крайне важны чувство уверенности в себе, благожелательность окружающих. Те, которые его не приемлют, хотят показать, что им все на свете подвластно. Но, по сути, они — неуверенные и замкнутые люди. Безразличие к этому цвету говорит об известном легкомыслии в области чувств, скрытом под маской обходительности.
Зелёный цвет – Тот, кто его предпочитает, боится чужого влияния, ищет способа самоутверждения, так как это для него жизненно важно; а тот, кто его не любит, страшится житейских проблем, превратностей судьбы, вообще всех трудностей.
Жёлтый цвет - Символизирует спокойствие, непринужденность в отношениях с людьми, интеллигентность. Люди, которые его любят, отличаются общительностью, любопытством, смелостью. Они легко приспосабливаются ко всему и любят нравиться и привлекать к себе внимание. Неприятен он людям замкнутым, пессимистически настроенным, с которыми бывает трудно завязать знакомство.
Приложение № 3.
Опорная схема по теме: «Элементов главной подгруппы VI группы. Кислород и сера. Нахождение в природе. Получение. Строение молекул. Аллотропные видоизменения. Важнейшие соединения: оксиды, кислоты и их соли. Обнаружение сульфат – иона. Применение кислорода, серы и их соединений. Физические и химические окислительно-восстановительные свойства».
О – 1772 г. Шееле
S - с древности
Se - 1817 г. Берцелиус
Te - 1782 г. Мюллер – фон Райхенштайн
Po – 1898 г. супруги Кюри
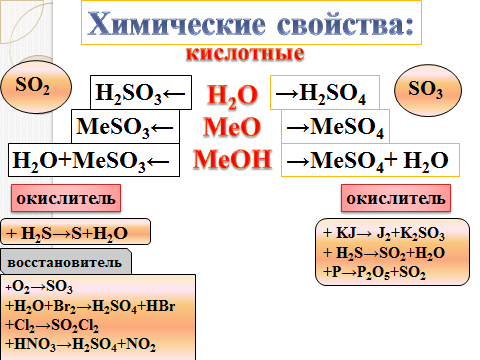
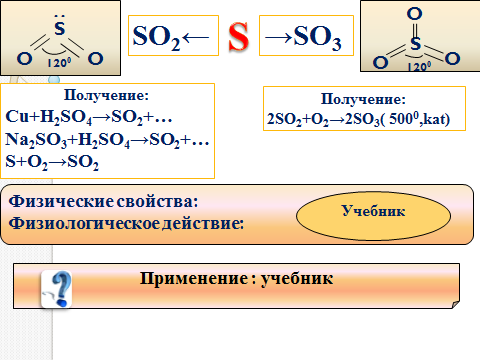
+4: SO2,H2SO3, MeHSO3, MeSO3 +6: SO3,H2SO4,MeHSO4, MeSO4 -2:H2S,MeHS, MeS
←S→

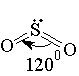
Получение:
Cu+H2SO4→SO2+… 2SO2+O2→2SO3( 5000,kat)
Na2SO3+H2SO4→SO2+…
S+O2→SO2
Ф.↑, р.з, ц ж, ц, tк= 44,60С, Н2О Х
Олеум!
Физ. Действие:
SO2 очень токсичен. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
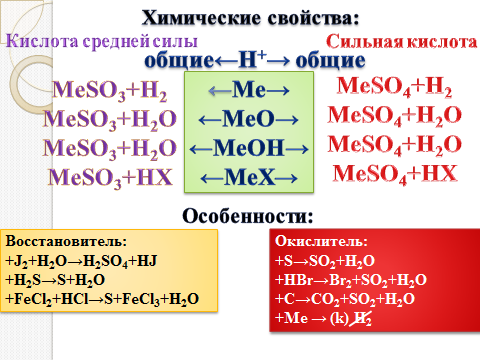
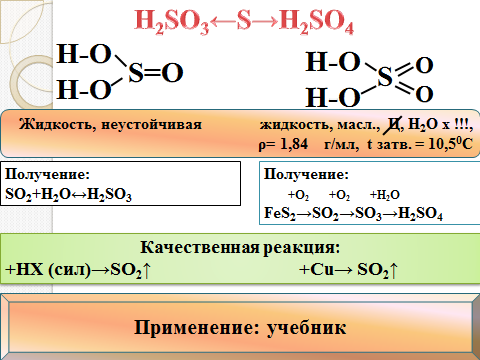
H2SO3←S→H2SO4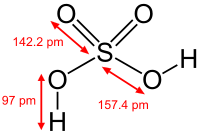
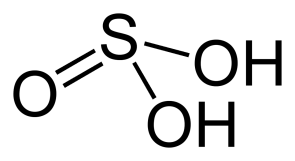
Жидкость, неустойчивая жидкость, масл., Ц, Н2О х !!!, ρ= 1,84 г/мл, t затв. = 10,50С
Получение: +O2 +O2 +H2O FeS2→SO2→SO3→H2SO4 Получение: SO2+H2O↔H2SO3
Качественная реакция: +НХ (сил)→SO2↑ +Cu→ SO2↑ Ba+2+SO42-→BaSO4

Н2SO3
восстановитель
Беление шерсти, шёлка
консервирование
Са(НSO3)2для обработки древесины, которую используют для производства бумаги
Научный центр - статисты- дайте общую характеристику VI А группе, годы и авторов открытия элементов этой группы, проследите изменение свойств в группе, перечислите степени окисления, дайте понятие аллотропии, применение и биологическая роль.
Научный центр – физико – географо – биологический - Дайте в сравнительной характеристике, нахождение в природе, строение, получение, физические свойства кислорода и серы, промышленные центры
Химический научный центр - Сравните химические свойства кислорода и серы.
Научный цент по соединениям - отдел оксиды и отдел кислоты. Дайте характеристику, строение, физические и химические свойства оксидов серы и кислот серы.
Научный цент по соединениям - отдел оксиды и отдел кислоты. Дайте характеристику, строение, физические и химические свойства оксидов серы и кислот серы.
Аналитический центр – практически докажите свойства серы, проанализируйте и проведите реакции, с помощью которых можно обнаружить сульфат и сульфит ионы. Дано: S, химическая ложечка, нагрев, вода, индикатор, сульфит натрия, сульфат натрия, нитрат бария, соляная кислота, гидроксид натрия. Проведите реакции горения серы, растворение продукта горения в воде, определите индикатором характер полученного соединения. Проанализируйте и проведите качественные реакции на сульфит и сульфат ионы.
Индивидуальное задание № 3. Задание: Составьте уравнение взаимодействия оксида магния с азотной кислотой, представьте уравнение в ионном виде. Вычислите массу полученной соли, если для реакции использовали 4,8 г металла и 21 г. кислоты. Индивидуальное задание № 2. Задание: Напишите уравнения реакций, позволяющие осуществит следующие превращения: С→СаС2→С2Н2→СО2→Na2CO3→CO2↔CO, там где возможно уравнения представьте в ионном виде. Индивидуальное задание № 1. Задание: Напишите уравнение реакции, происходящей между кальцием и концентрированной азотной кислотой. Расставьте коэффициенты методом электронного баланса. Вычислите объём выделившегося газа и массу соли, если для неё взято 20 г. металла и 63 г. кислоты.
Здесь представлен конспект к уроку на тему «Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (10 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

