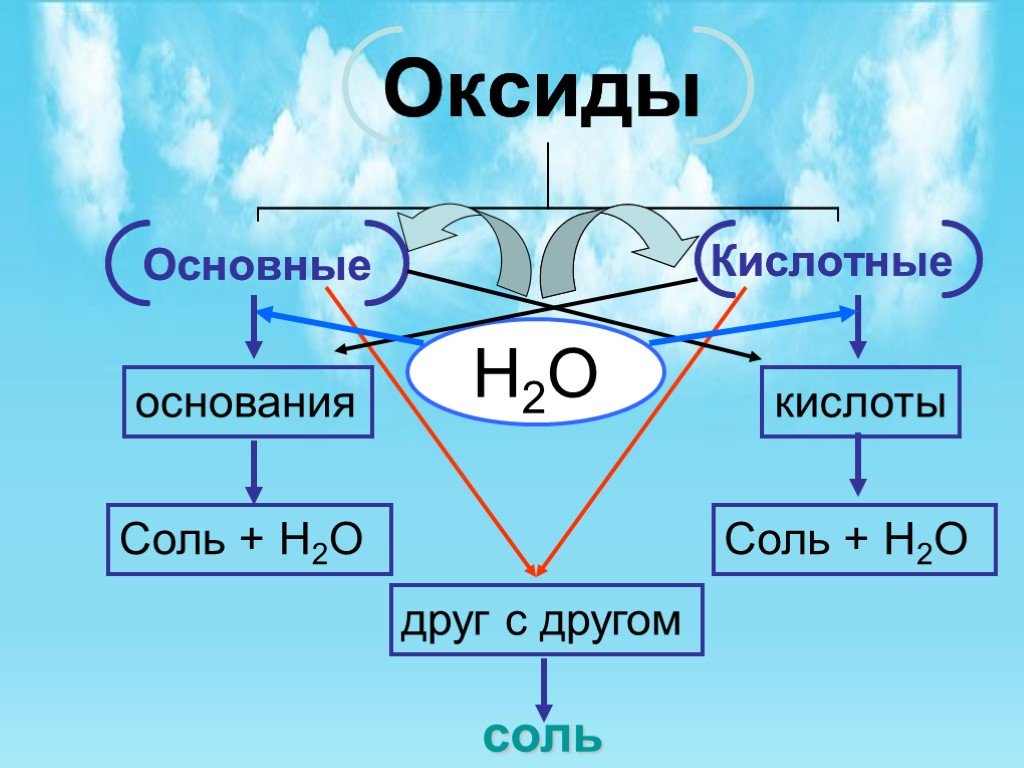
Презентация "Общая характеристика оксидов" по химии – проект, доклад
Презентацию на тему "Общая характеристика оксидов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
Водород, его общая характеристика, нахождение в природе и его свойства
Цели. сформировать знания учащихся о водороде как о атоме и простом веществе, его способах получении, свойствах и применении научить учащихся работать ...Общая характеристика галогенов.
Цели: Охарактеризовать положение галогенов в Периодической системе Д.И.Менделеева. Охарактеризовать особенности строения атомов галогенов. Охарактеризовать ...Азот. Общая характеристика
Азот – это вечный источник танталовых мук человечества, это вечные терзания голода среди океана изобилия. М.Камен (американский биохимик). Источник ...Общая характеристика металлов главных подгрупп I-III
Характеристика металлов главной подгруппы I группы. Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы ...Токсикологическая характеристика оксидов серы
Физические свойства. SO2 (серистый ангидрид; сернистый газ). SO3 (серный ангидрид). Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) ...Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Строение атома. КИСЛОРОД. Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле; в воздухе - 21% по объему; ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Общая характеристика реакций органических соединений
Классификация органических реакций. I. По результату реакции делят на 1) реакции замещения , S , (substitution замещение). CH4 + Cl2 CH3Cl + HCl ...Общая характеристика галогенов
Цели урока:. 1.Систематизировать знания учащихся о галогенах. 2.Ознакомить учащихся с окислительными свойствами галогенов. 3.Повторить, обобщить и ...Кислород. Общая характеристика, получение и свойства
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II. Кислород. Простое вещество Неметалл Молекула – О2 Относительная ...Неметаллы-общая характеристика
Неметаллы. Общая характеристика Кислород и кремний составляют 76% от массы земной коры (О – 49%, Si – 27%) C,H,O,N,P,S – биогенные элементы, составляют ...Общая характеристика галогенов
Цель урока:. Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики. Ответы ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Общая характеристика неметаллов
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Тема: “Загальна характеристика основ”.
Мета уроку:. 1. Познайомити учнів з новим класом неорганічних сполук – основами. 2. Розглянути класифікацію, склад та номенклатуру основ. 3.Фізичні ...Алюминий и его характеристика
Цель урока. Рассмотрение характеристики алюминия по трем формам существования химических элементов: атомов, простых и сложных веществ. Задачи урока. ...Общая жесткость воды
Общие сведения.Как утверждают ученые, жизнь на Земле возникла в водной среде. Все живые организмы почти на 2/3 состоят из воды. Качество жизни людей ...
Неметаллы и их характеристика
Разгадайте ребусы и назовите три химических элемента названия которых здесь зашифрованы:. уГ+лес,Т=Д , газ + , ,,,+. К какой группе относятся эти ...Конспекты
Общая характеристика металлов и неметаллов
П . лан- конспект урока "Общая характеристика металлов и неметаллов". . Девиз урока. : “Зажечь, увлечь и повести”. . Цели. В нетрадиционной ...Общая характеристика кислорода
Конспект урока по химии в 8 классе. Раздел « Кислород. Оксиды. Горение». Тема урока: «Общая характеристика кислорода». Цель урока: Формировать ...Общая характеристика металлов и их значение для человека
Технология развития критического мышления. Интегрированный урок химии - биологии. на тему: «Общая характеристика металлов и их значение для человека». ...Общая характеристика галогенов
Цели урока:. Образовательные:. Охарактеризовать особенности положения галогенов в Периодической системе Д.И.Менделеева. . Охарактеризовать ...Общая характеристика галогенов. Хлор
Тема:. Общая характеристика галогенов. Хлор. Цели:. Развивать. знания о семействе галогенов на примере хлора и его соединений, изучить строение ...Общая характеристика водорода. Получение водорода
Муниципальное казенное общеобразовательное учреждение. « Суриндинская основная общеобразовательная школа». Урок по химии 8 класс. Общая ...Неметаллы. Общая характеристика неметаллов
. План-конспект урока химии в 9 -м классе с использованием ЦОР по теме: «Неметаллы. Общая характеристика неметаллов». Автор: Кобелева Вера Ивановна. ...Кислород, его общая характеристика и нахождение в природе. Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Краснощёковская средняя общеобразовательная школа№1». Краснощековского района. . Алтайского ...Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Общая характеристика неметаллов
Конспект урока по химии. Тема урока: «Общая характеристика неметаллов». УМК:. Габриелян О.С. Химия 9 кл. Возраст: 9 класс. Учителя химии ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:9 января 2019
Категория:Химия
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию