Презентация "Общая характеристика реакций органических соединений" по химии – проект, доклад
Презентацию на тему "Общая характеристика реакций органических соединений" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 104 слайд(ов).
Слайды презентации
Список похожих презентаций
Основные классы неорганических соединений
Многообразие веществ. Состав Сложные вещества, включающие в себя два химических элемента, причём один из них – кислород. Примеры Газы: CO2, SO2, NO2. ...Основные классы неорганических соединений
Классификация неорганических веществ. Сложные Н2О, НNО3 Соли NaCl. Неорганические вещества. Простые Cu, Н2, F2 Металлы Fe, Na Неметаллы С, О2 Основания ...Азот. Общая характеристика
Азот – это вечный источник танталовых мук человечества, это вечные терзания голода среди океана изобилия. М.Камен (американский биохимик). Источник ...Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Характеристика химических элементов и их соединений на основе положения элементов в периодической системе.
Цель урока? Химический элемент. Семейство Щелочные Ме Халькогены Период Группы Изотопы Валентность Д.И.Менделеев. Горячий стул. Химический диктант ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Строение атома. КИСЛОРОД. Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле; в воздухе - 21% по объему; ...Важнейшие классы неорганических соединений
Оксид - сложное вещество, состоящее из атомов двух элементов, один из которых - кислород. Э Ме неМе + О2 ЭО-2. Гидроксиды — соединения оксидов химических ...Общая характеристика оксидов
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2, Al2O3, CO. Оксиды. Оксиды – соединения элементов ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Генетические связи между важнейшими классами неорганических соединений
Тема. Генетические связи между важнейшими классами неорганических соединений. А. С. Макаренко: «Теория и практика неотъемлемы». . SO2 HCl H3PO4 H2O ...Водород, его общая характеристика, нахождение в природе и его свойства
Цели. сформировать знания учащихся о водороде как о атоме и простом веществе, его способах получении, свойствах и применении научить учащихся работать ...Общая характеристика неметаллов
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Теория строения органических соединений
Например: Сбраживая виноградный сок, получали вино, а при его перегонке - спирт; Нагревая жир с содой, получали мыло; Из цветов извлекали эфирные ...Взаимосвязь между классами неорганических соединений
19.02.2019 Оськина Т.А. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. ...Теория строения органических соединений А.М. Бутлерова
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма). В состав органических веществ входят радикалы;. Радикалы всегда постоянны, не подвергаются ...Теория строения строения органических соединений
Первые теории строения органических соединений. Органическая химия в начале XIX века: Ученые определяли количественный и качественный состав вещества. ...Строение органических соединений А.М. Бутлерова
Биография А.М.Бутлерова Теория химического строения органических веществ Предпосылки создания теории Теории до Бутлерова Основные положения теории ...Класса неорганических соединений
Результат теста. Верно: 9 Ошибки: 1 Отметка: 4. Время: 0 мин. 33 сек. ещё исправить. Вопрос 1. 1. Образует щелочь при взаимодействии с водой. K2O ...Классификация и номенклатура неорганических соединений
ОТВЕТИТЬ НА ПРЕДЛОЖЕННЫЕ ВОПРОСЫ В ПОРЯДКЕ ИХ ПОСТАНОВКИ. Вариант 1 Основания – это… Кислотные оксиды – это … С водой реагирую только оксиды металлов ...Конспекты
Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций
Дата ____________ Класс _____________. Тема: Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций. ...Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Общая характеристика неметаллов
Конспект урока по химии. Тема урока: «Общая характеристика неметаллов». УМК:. Габриелян О.С. Химия 9 кл. Возраст: 9 класс. Учителя химии ...Общая характеристика металлов и их значение для человека
Технология развития критического мышления. Интегрированный урок химии - биологии. на тему: «Общая характеристика металлов и их значение для человека». ...Общая характеристика металлов и неметаллов
П . лан- конспект урока "Общая характеристика металлов и неметаллов". . Девиз урока. : “Зажечь, увлечь и повести”. . Цели. В нетрадиционной ...Важнейшие классы неорганических соединений
МОУ Кинель – Черкасская средняя общеобразовательная школа № 1. «Образовательный центр». Конспект. . открытого урока по химии в 8 ...Важнейшие классы неорганических соединений
ГБОУ СОШ пос. Сургут муниципального района Сергиевский Самарской области . . ПЛАН-КОНСПЕКТ УРОКА. . по химии в 8 классе Важнейшие ...Общая характеристика галогенов. Хлор
Тема:. Общая характеристика галогенов. Хлор. Цели:. Развивать. знания о семействе галогенов на примере хлора и его соединений, изучить строение ...Общая характеристика кислорода
Конспект урока по химии в 8 классе. Раздел « Кислород. Оксиды. Горение». Тема урока: «Общая характеристика кислорода». Цель урока: Формировать ...Водород. Его общая характеристика, нахождение в природе и получение
14 октября 2014 года. Открытый урок химии в 9 классе разработан на основе УМК Н.С.Новошинской по технологии критического мышления. Учитель: Королева ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 января 2019
Категория:Химия
Содержит:104 слайд(ов)
Поделись с друзьями:
Скачать презентацию












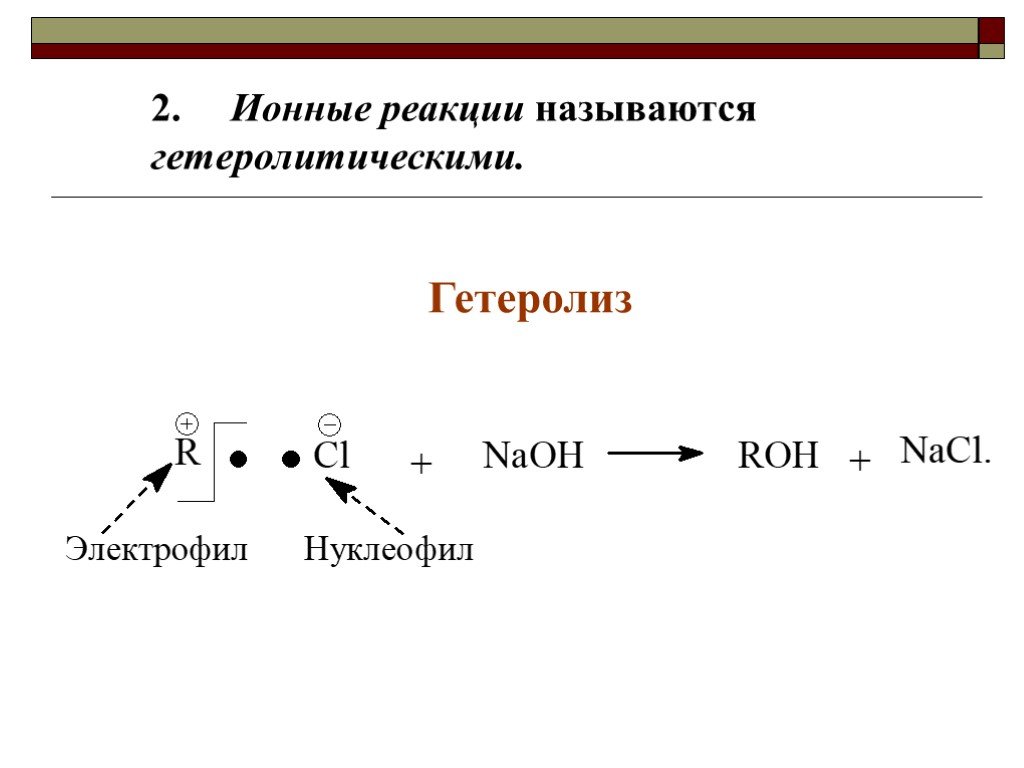
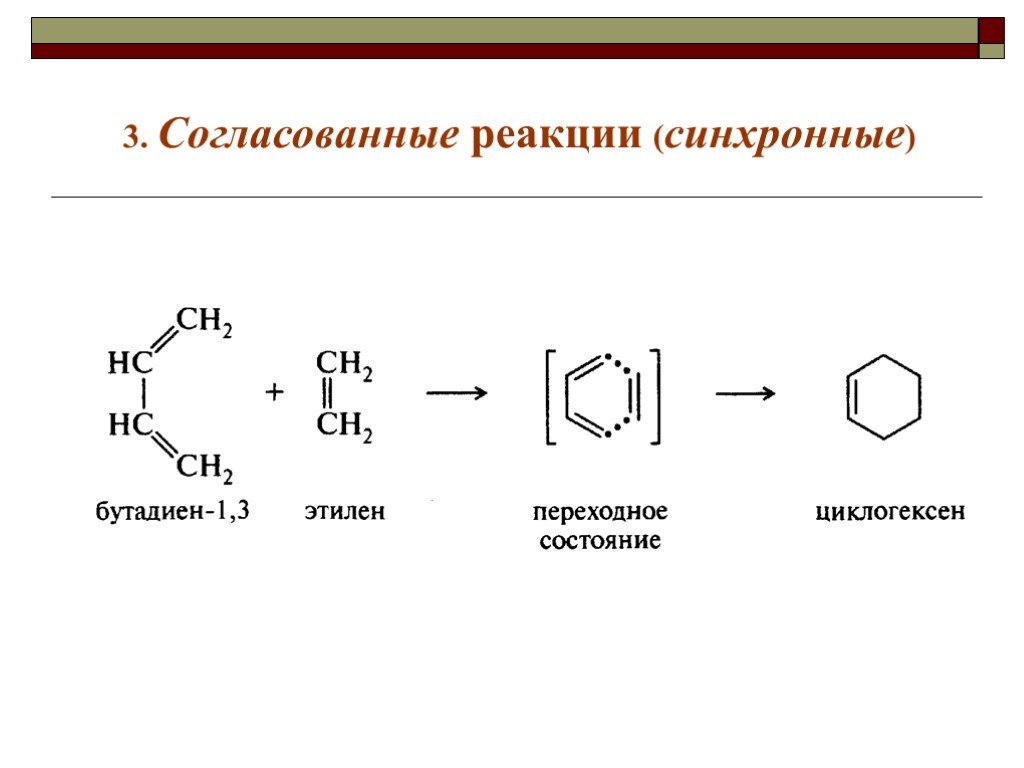

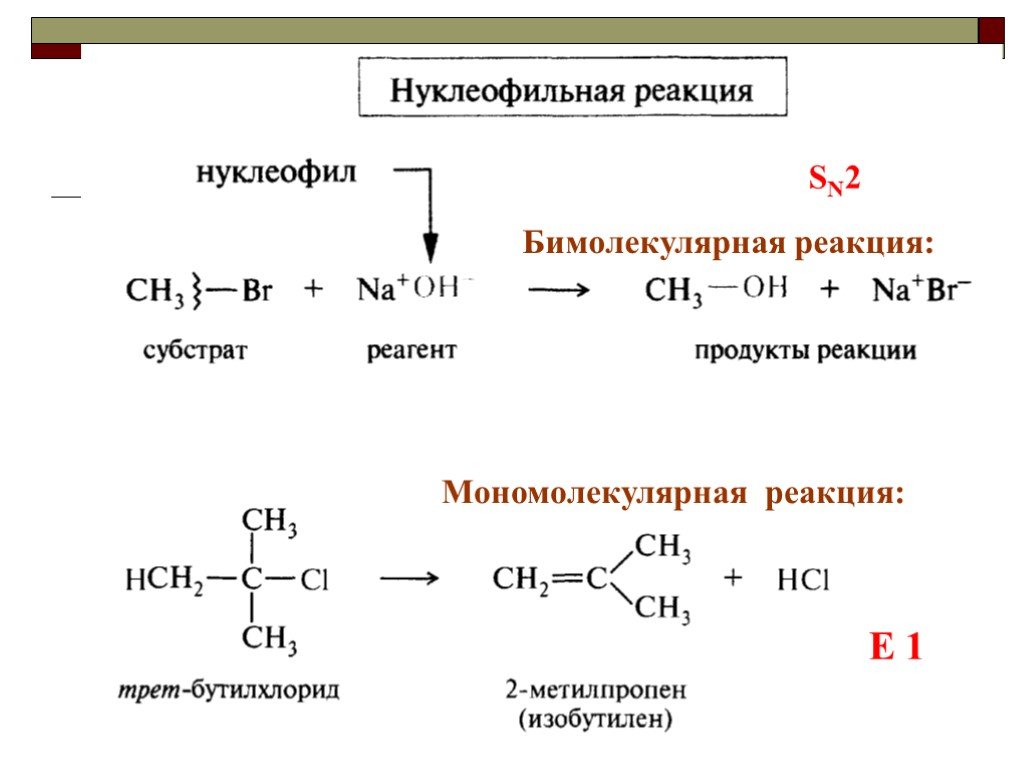



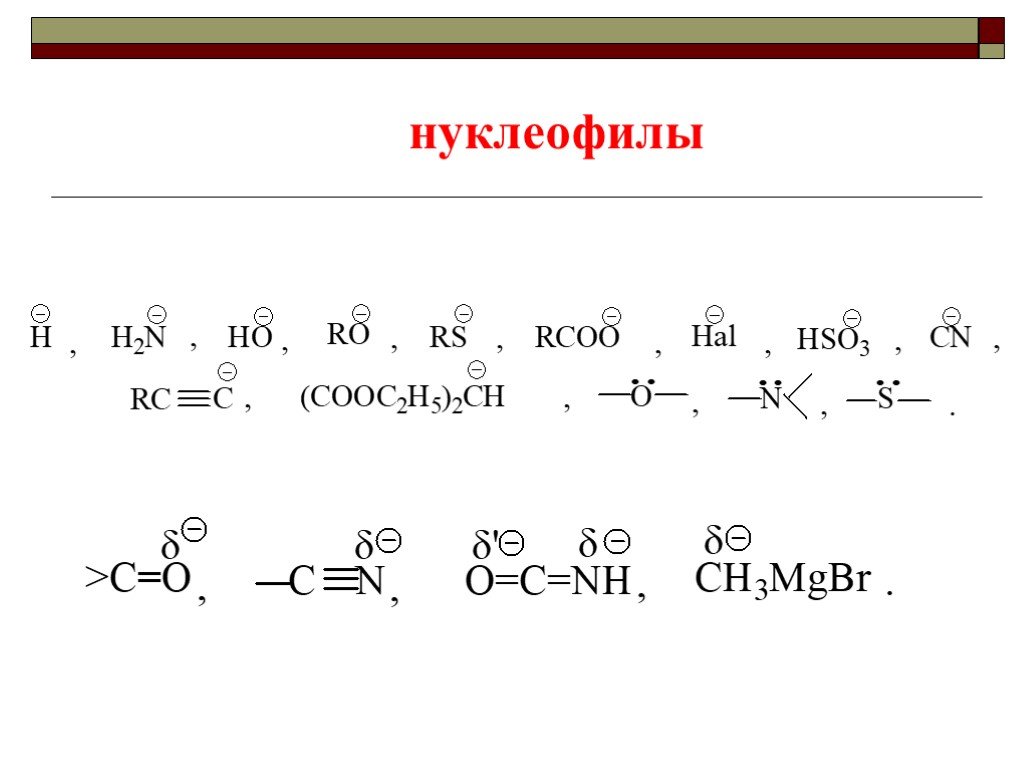







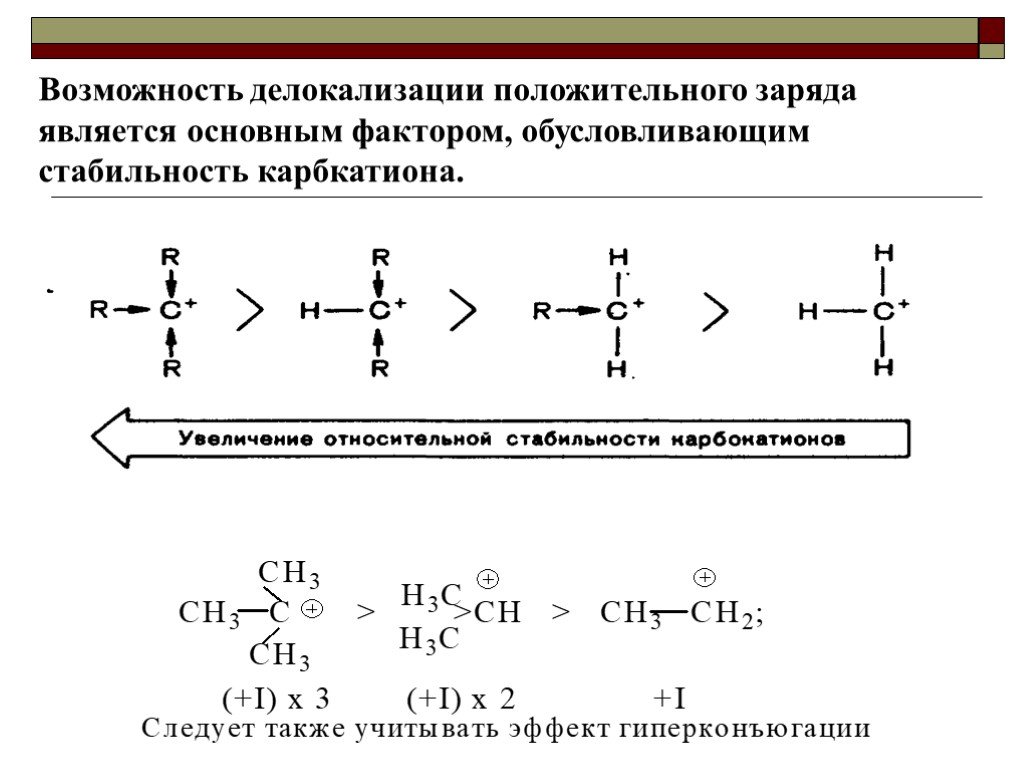
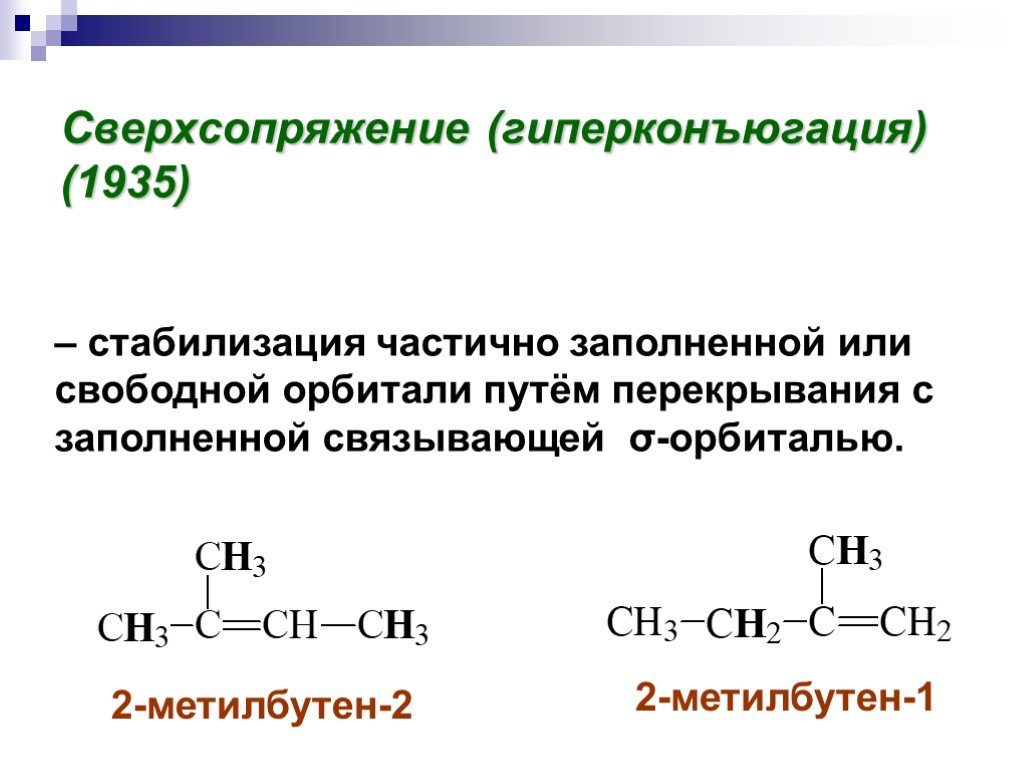
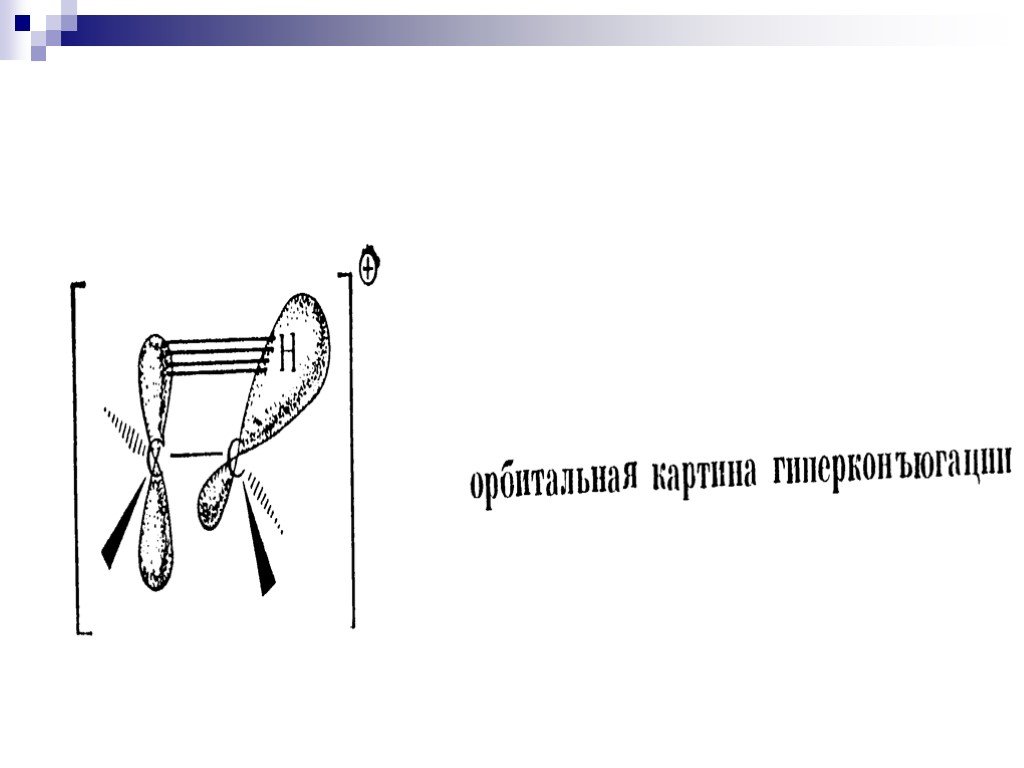
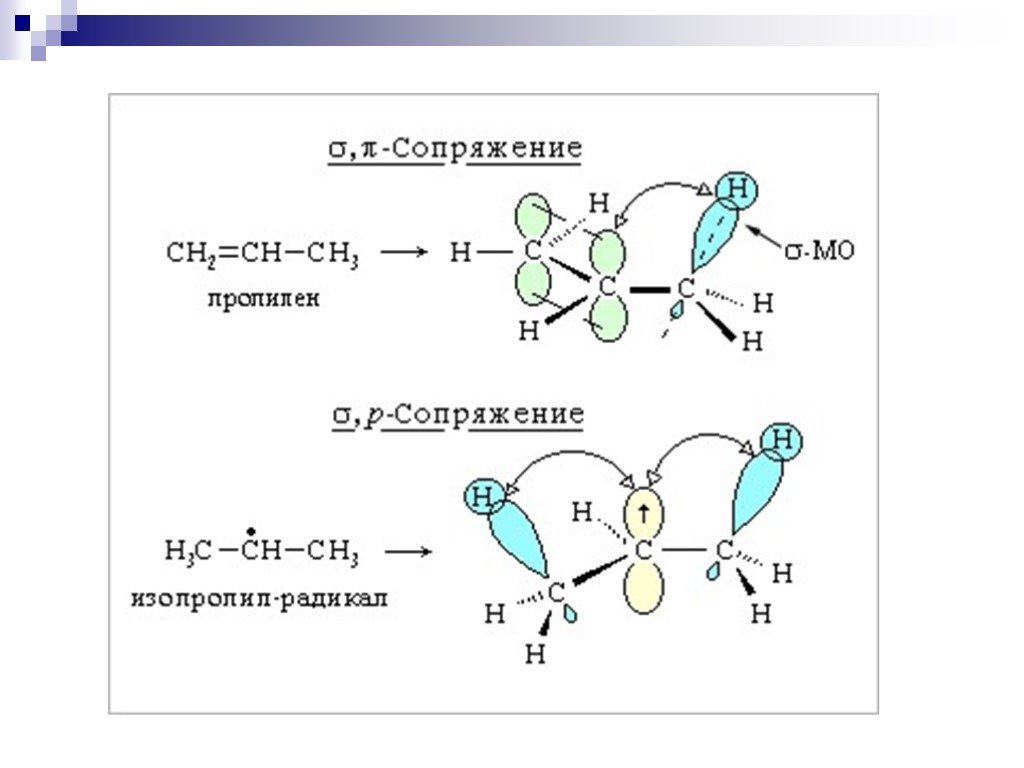
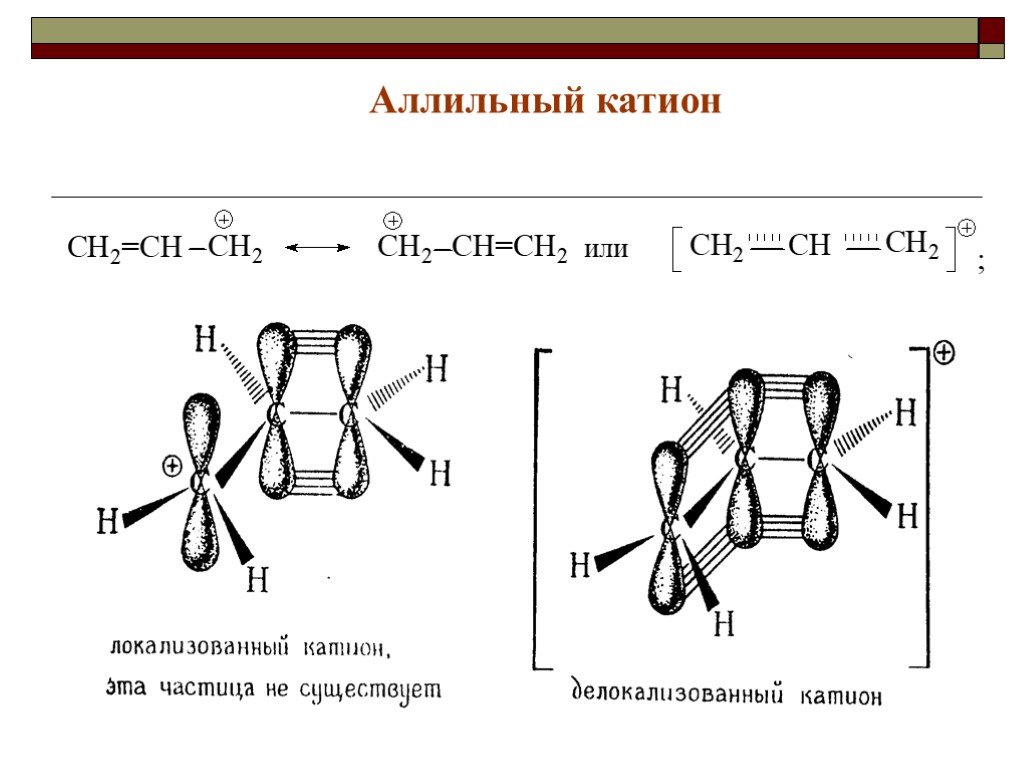
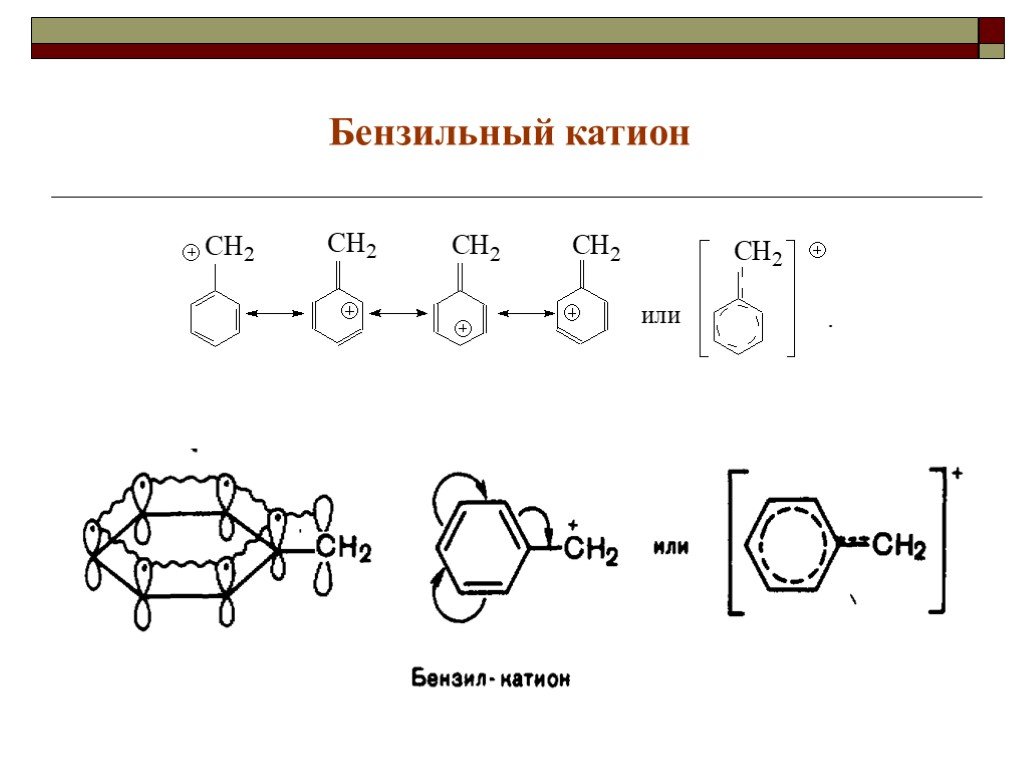


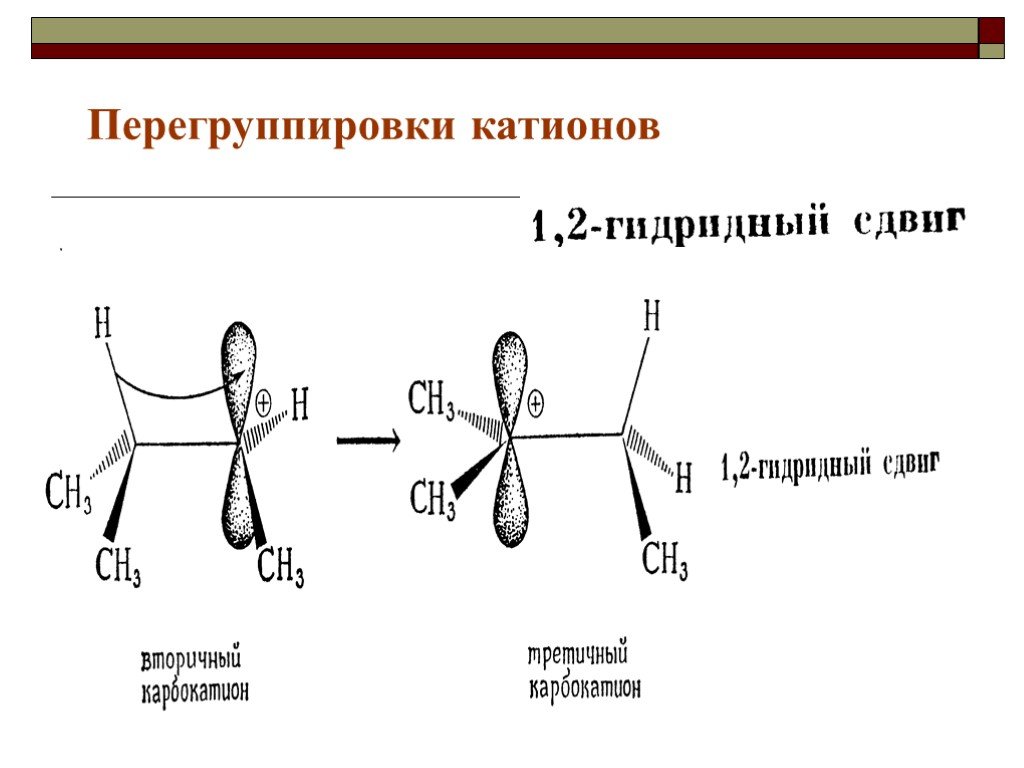
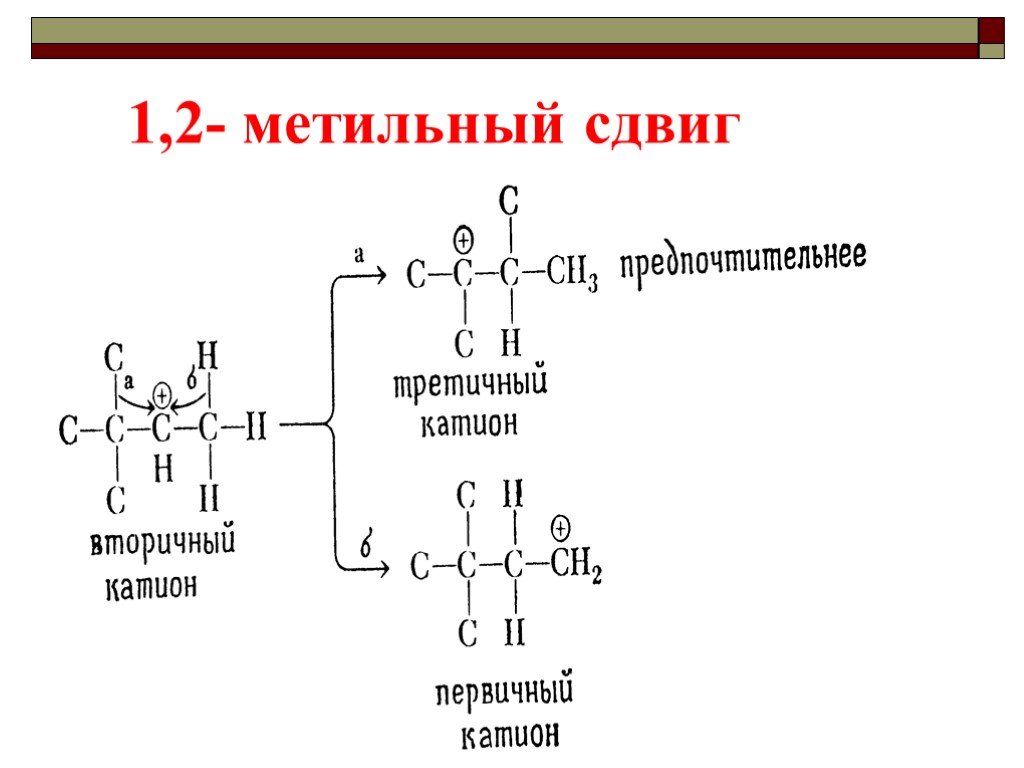




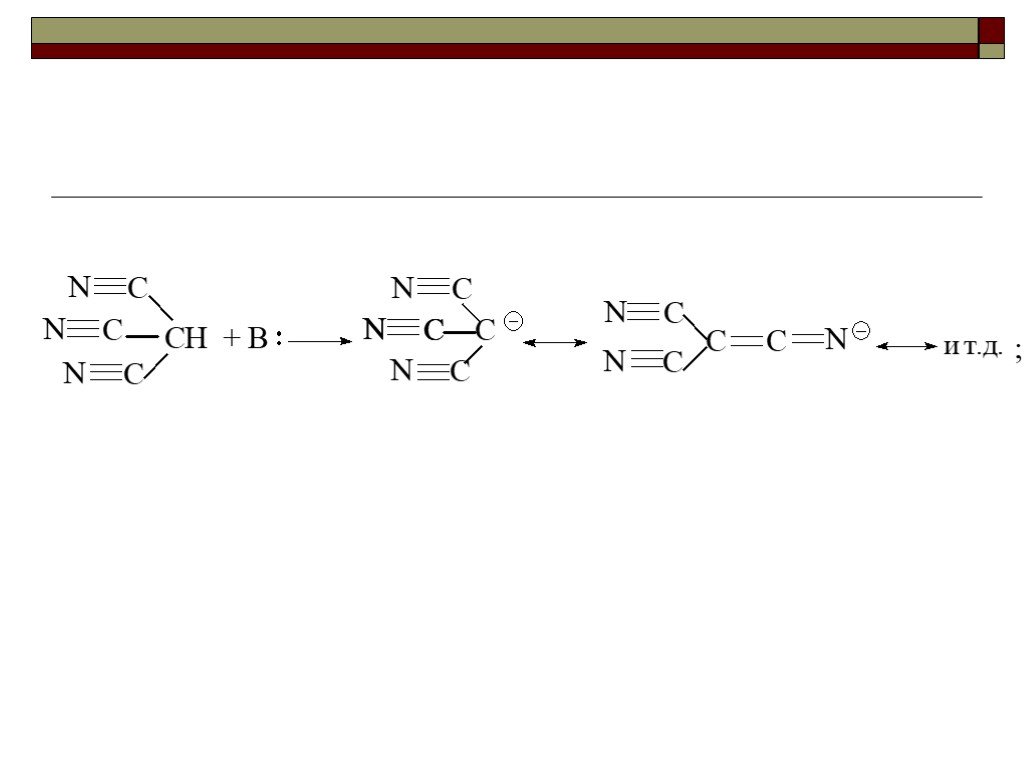



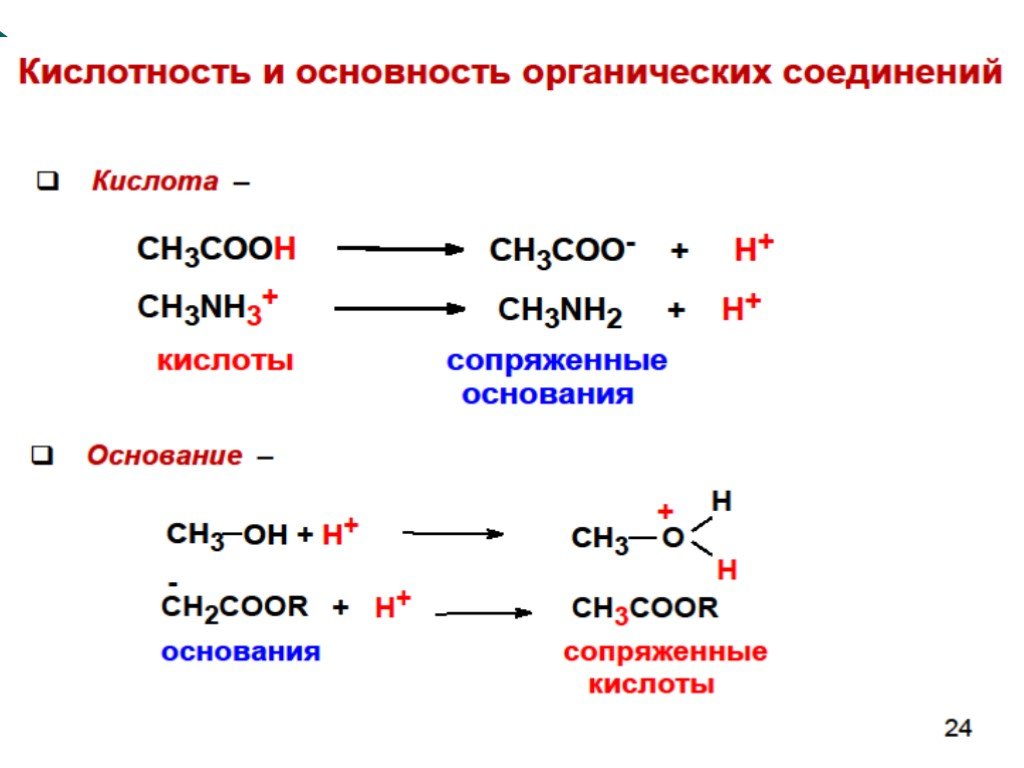
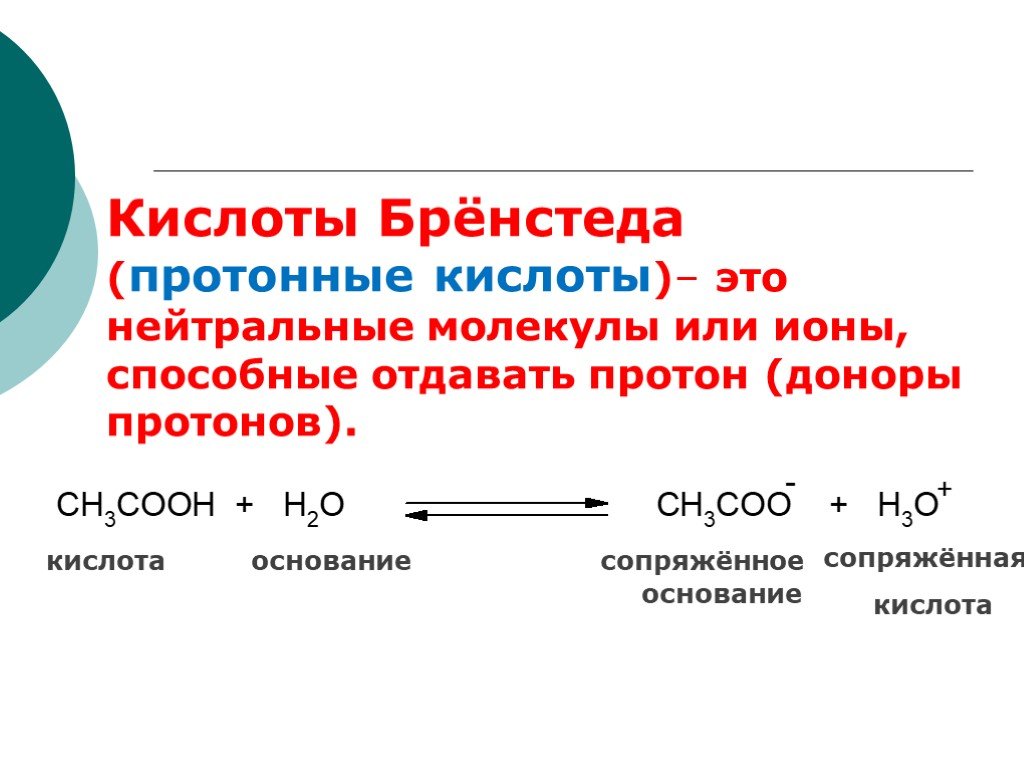


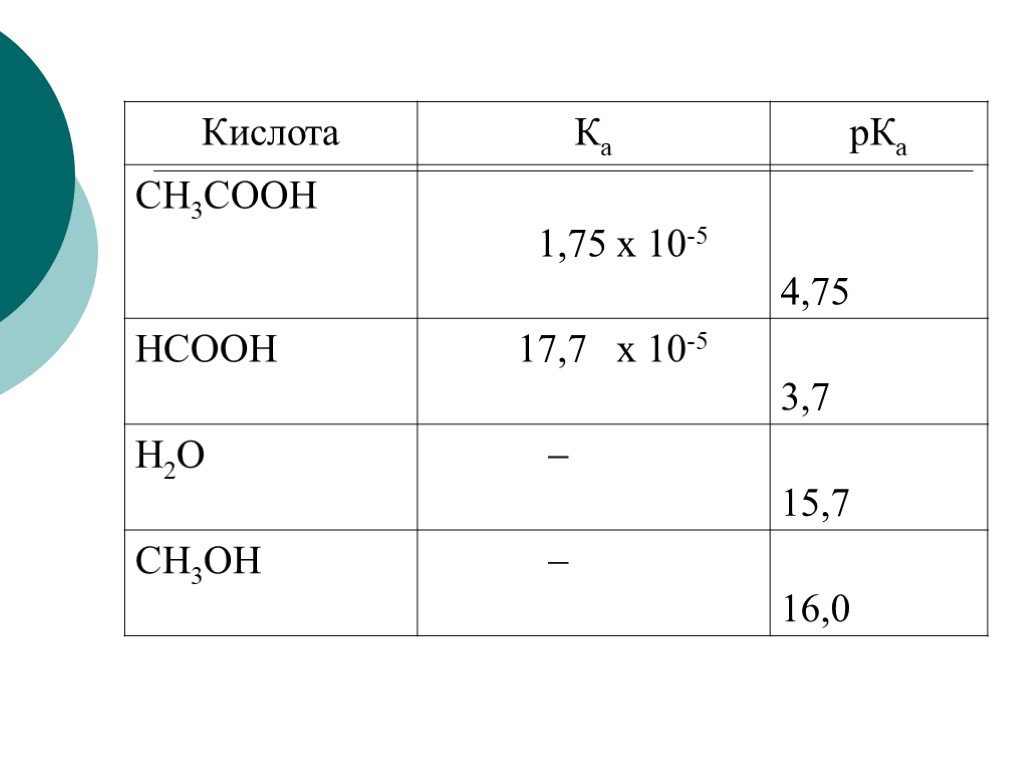

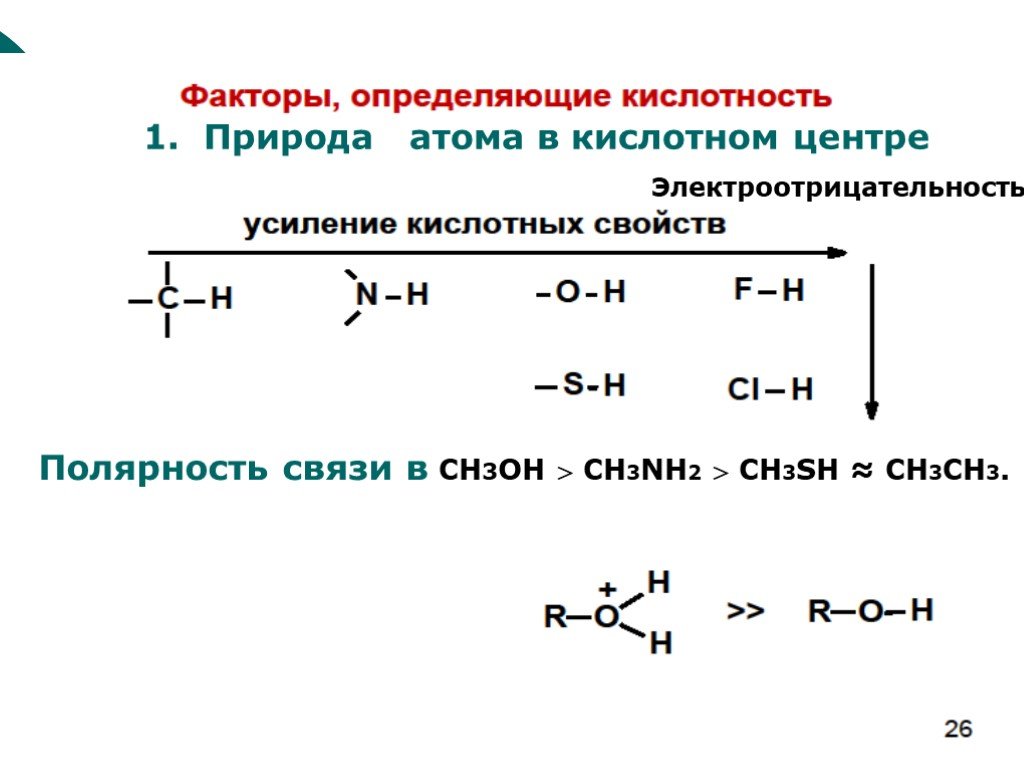
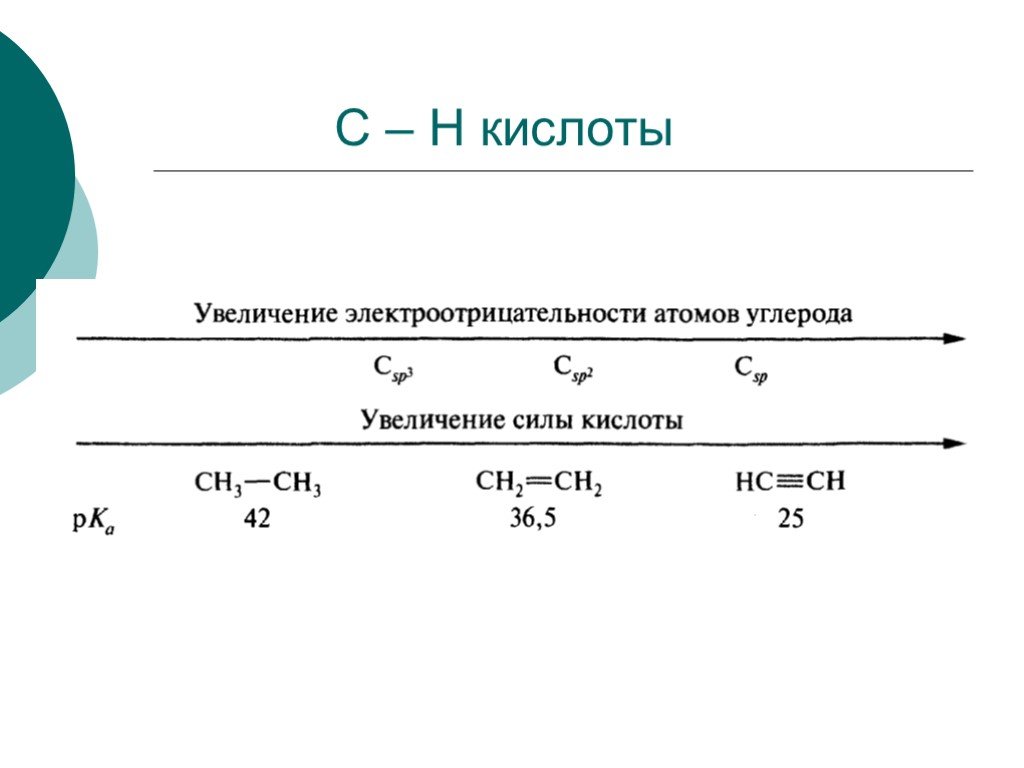

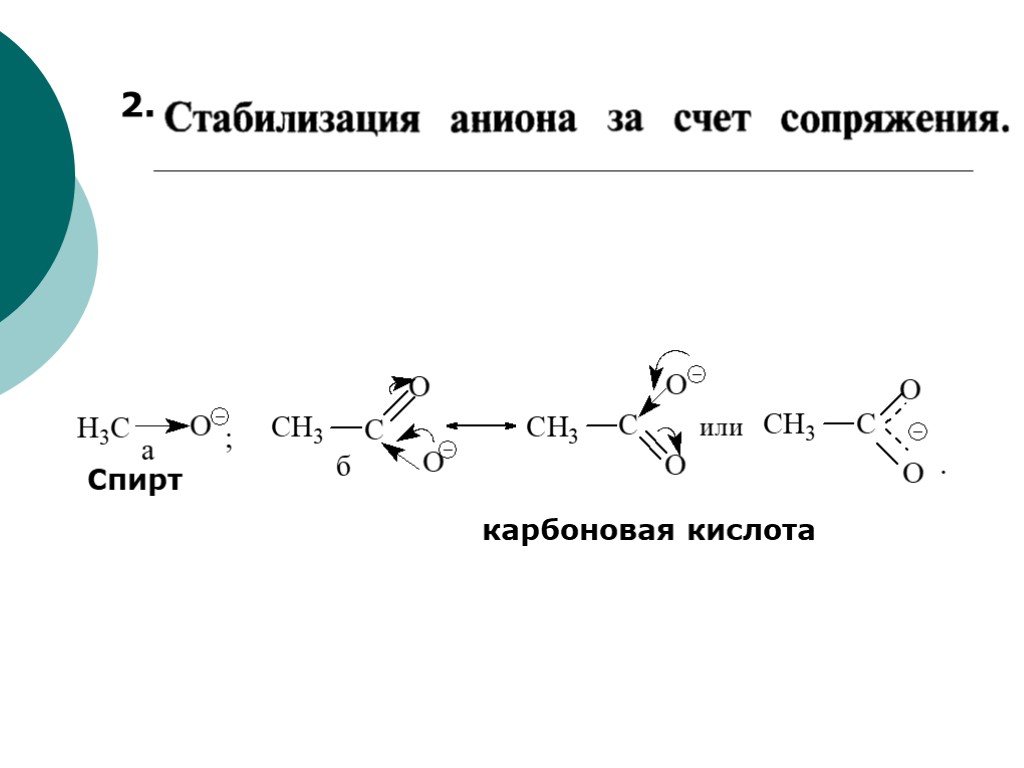
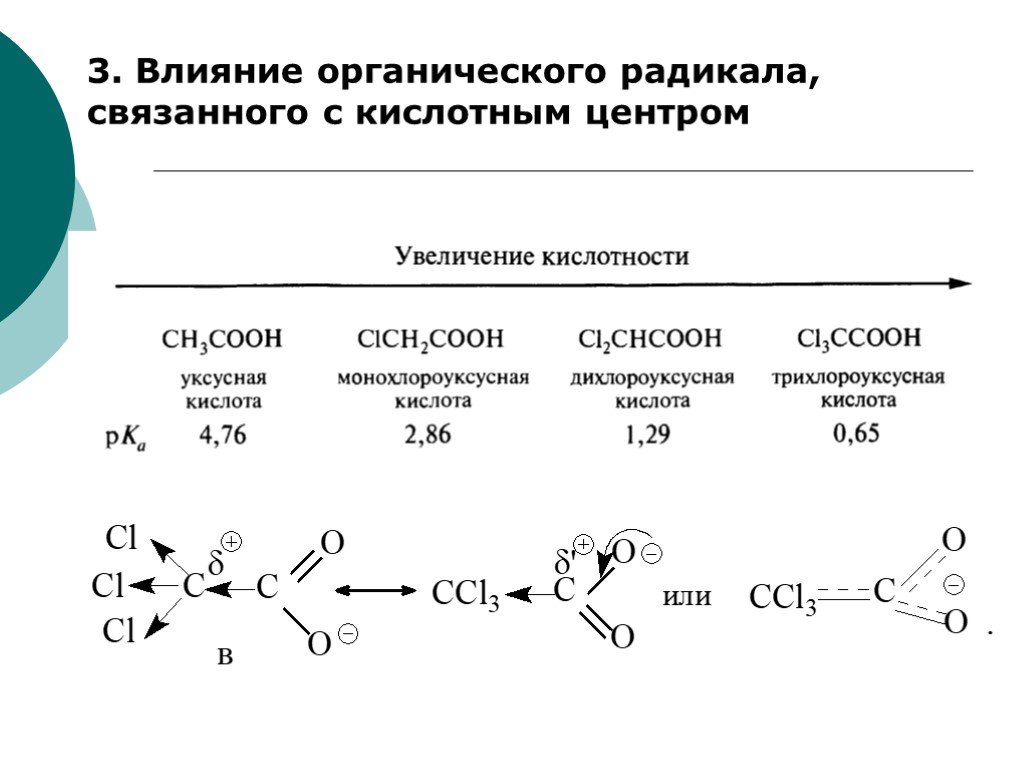

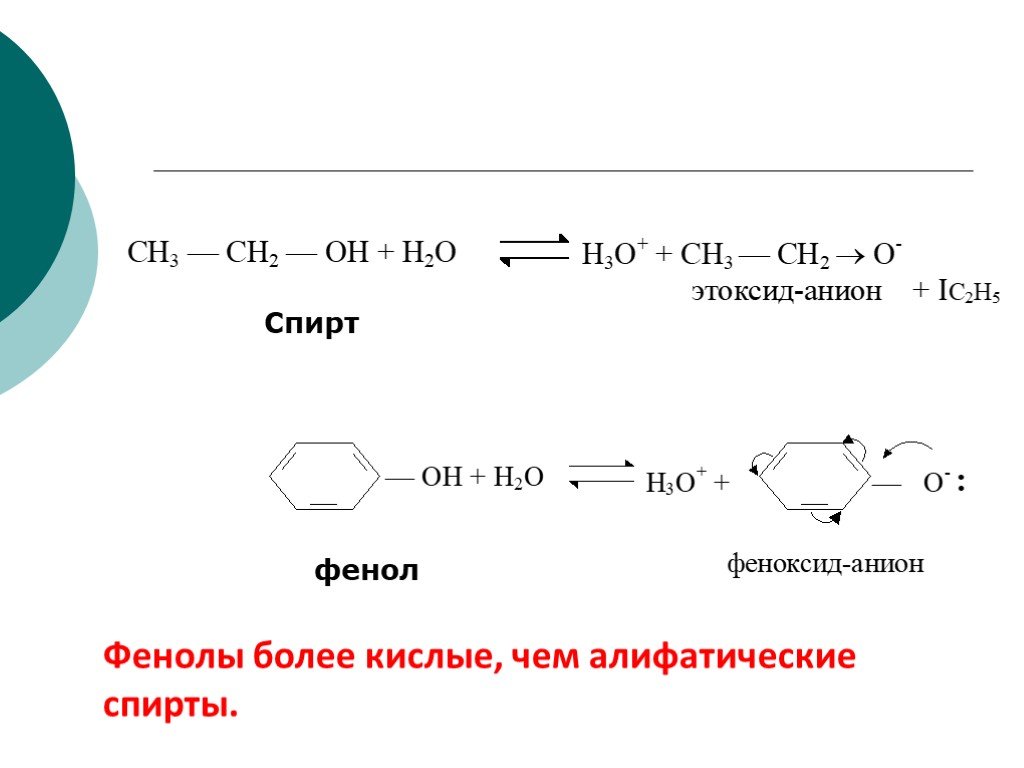
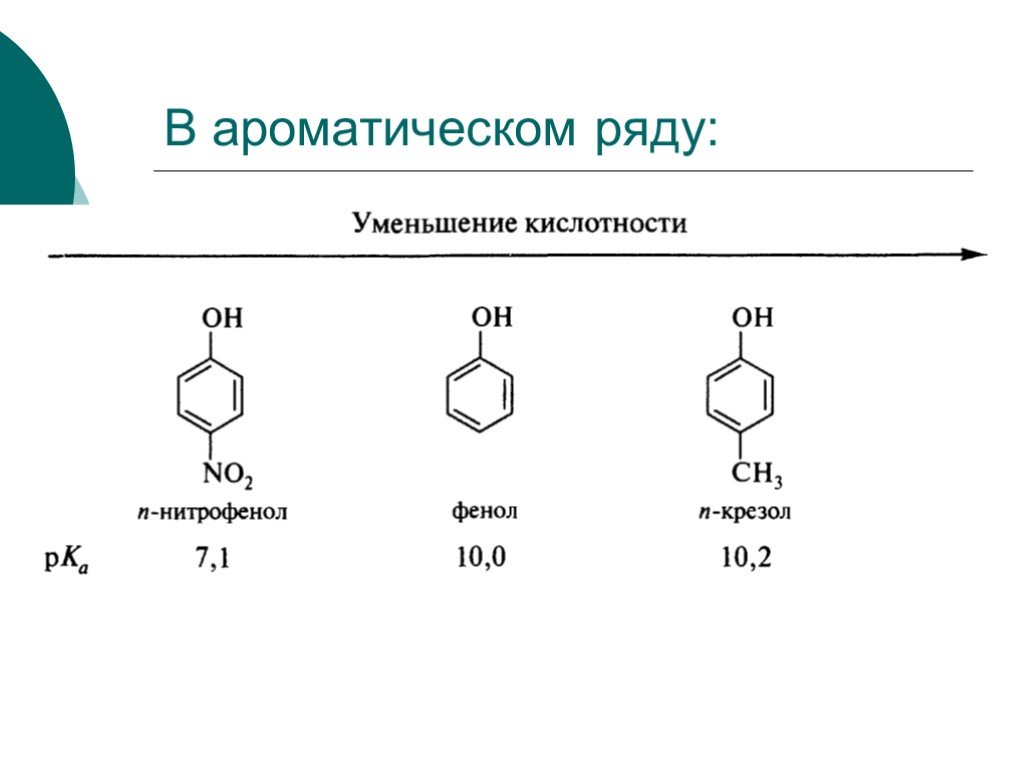

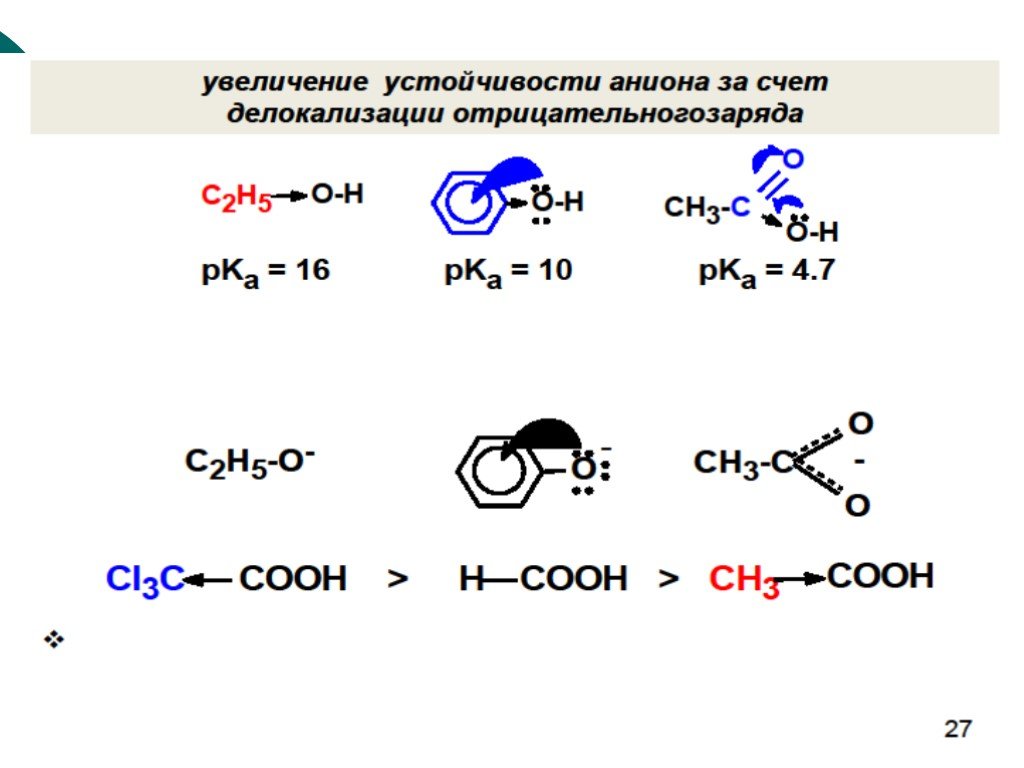
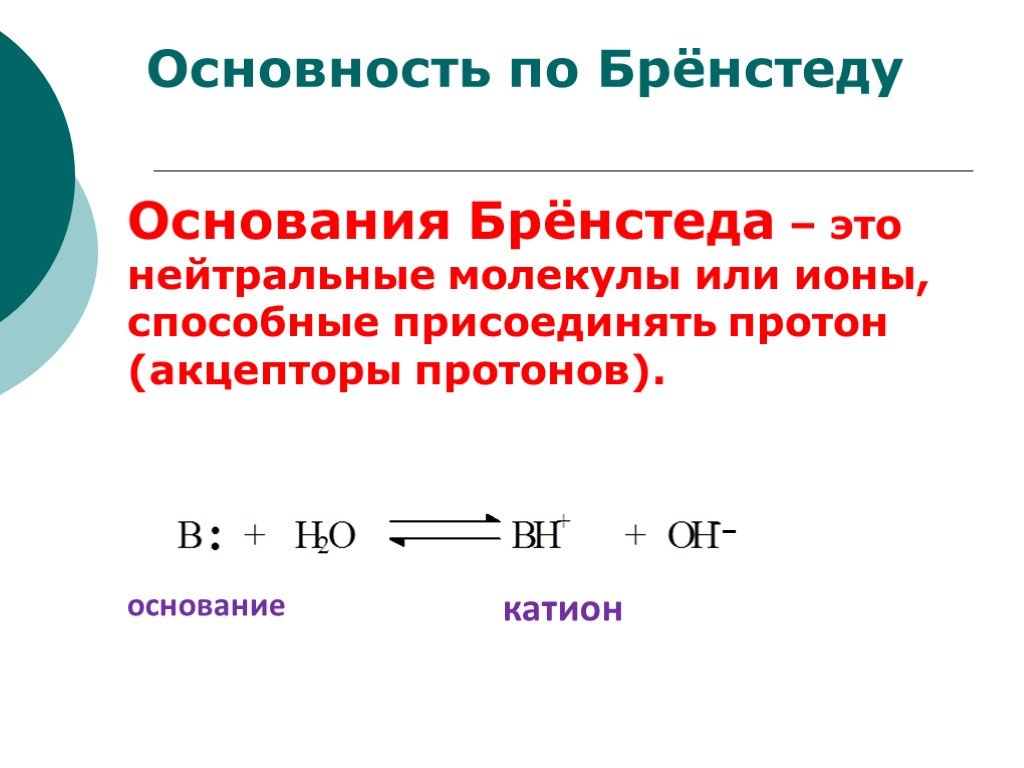
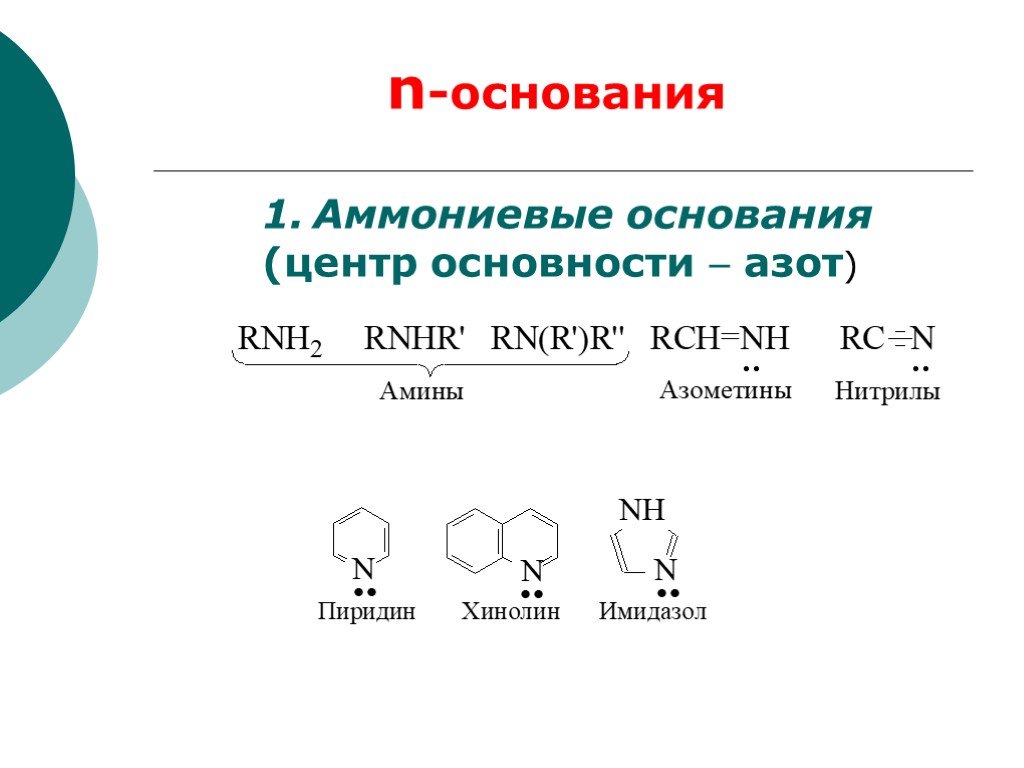
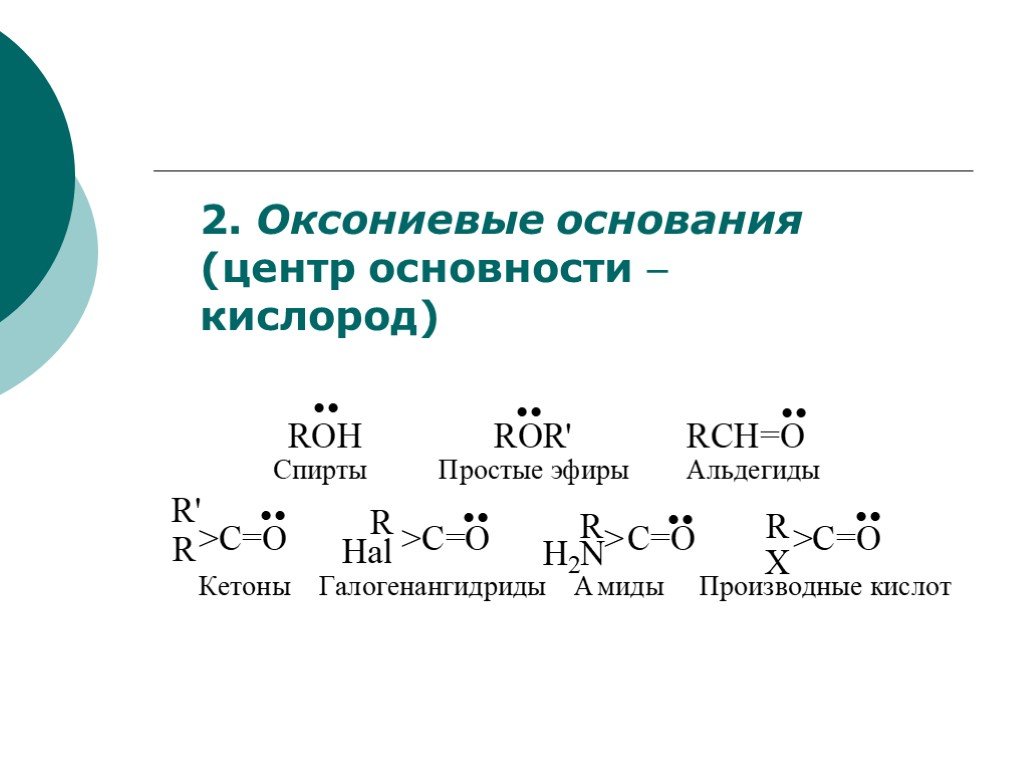


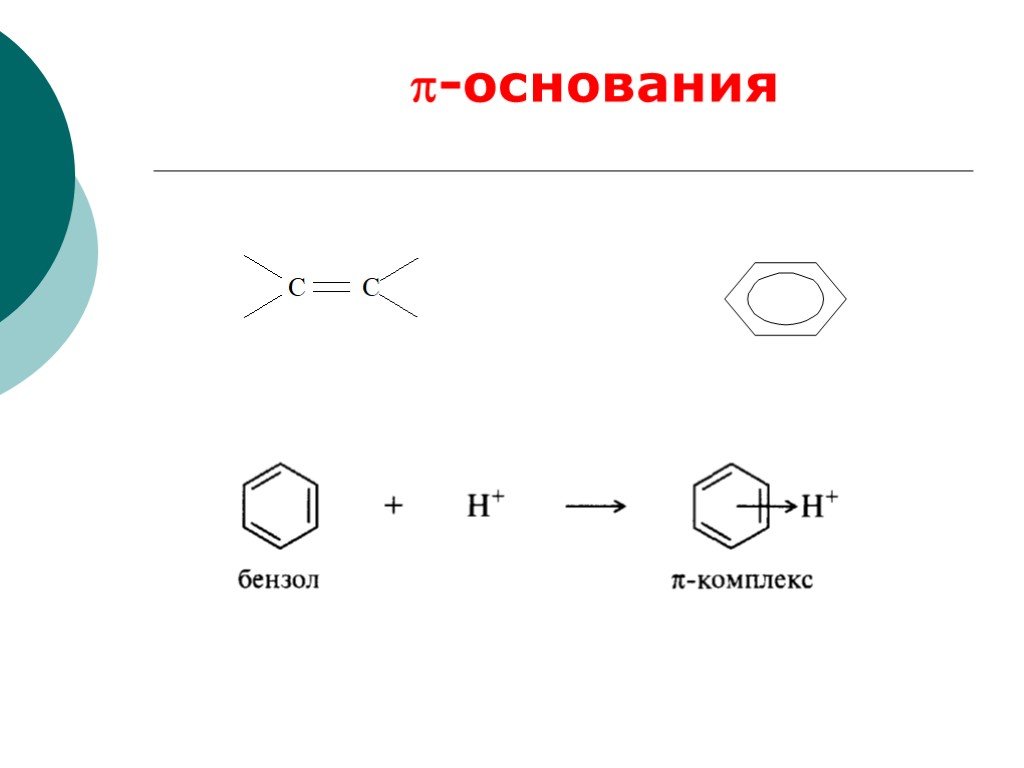
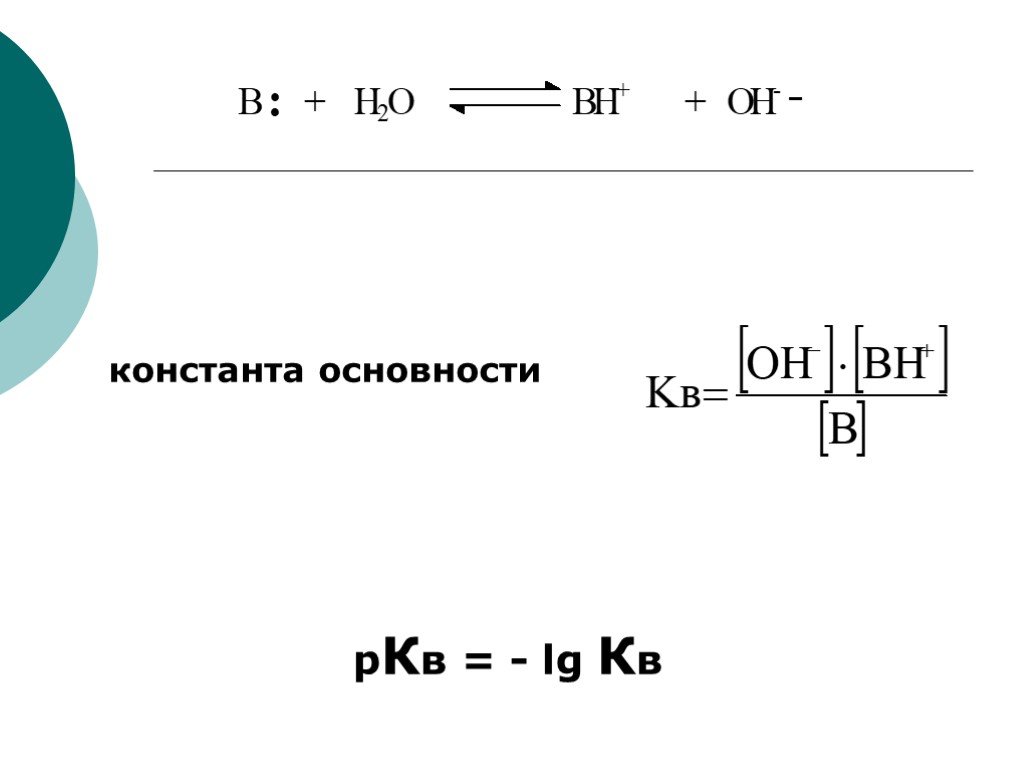

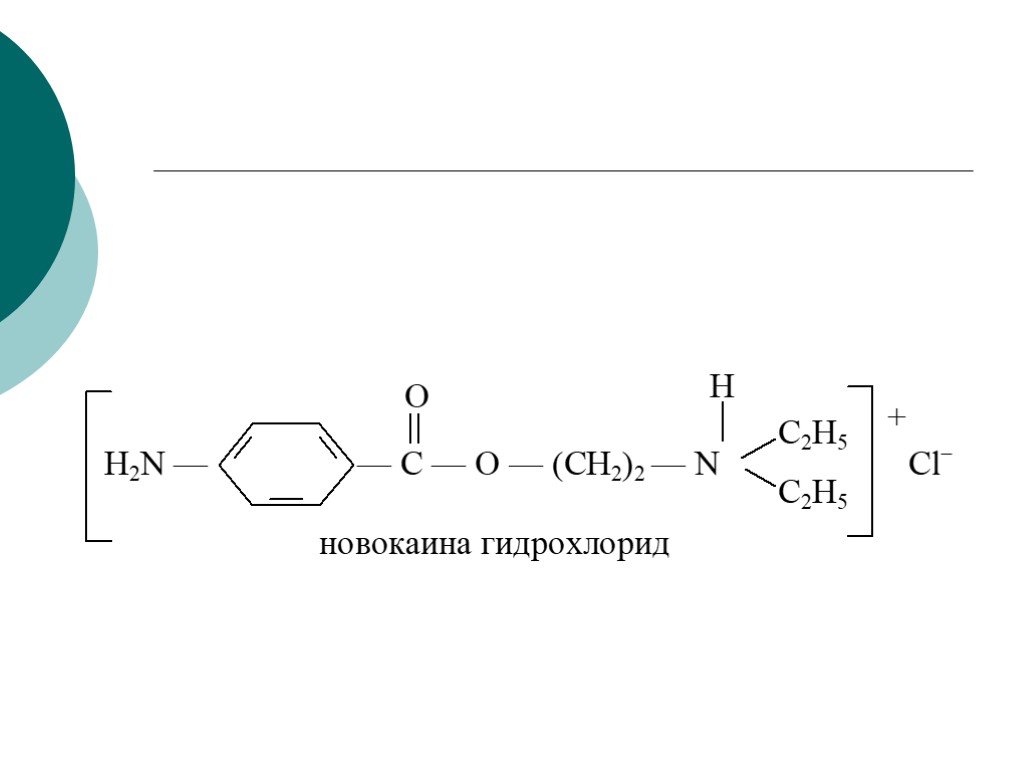
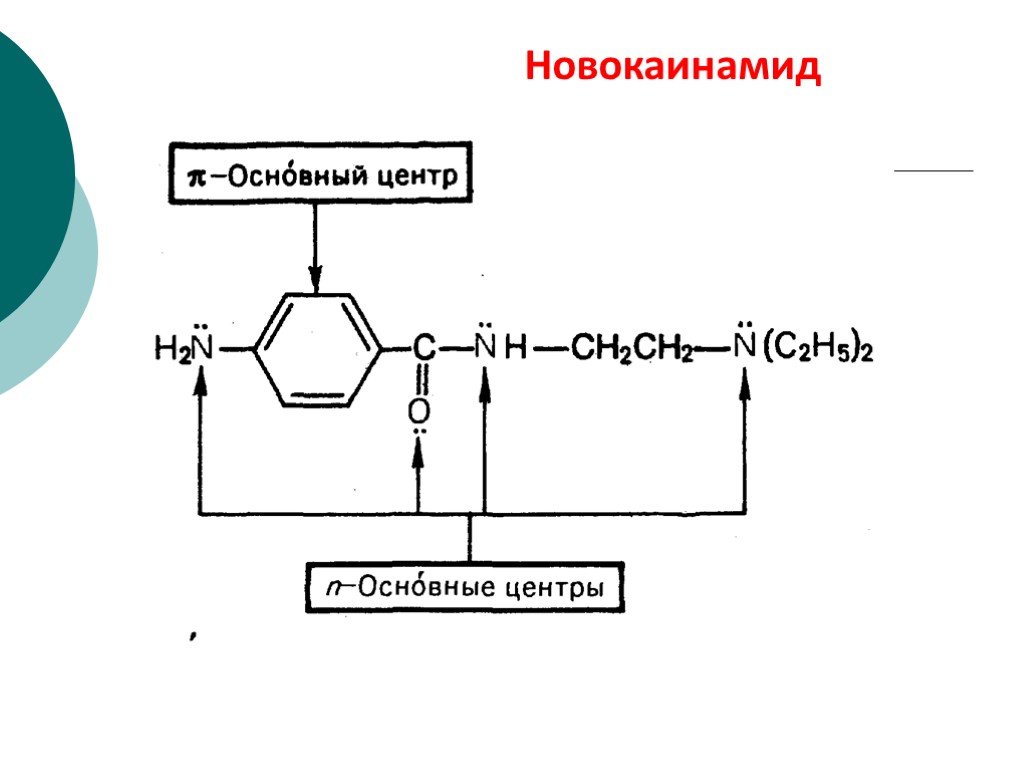
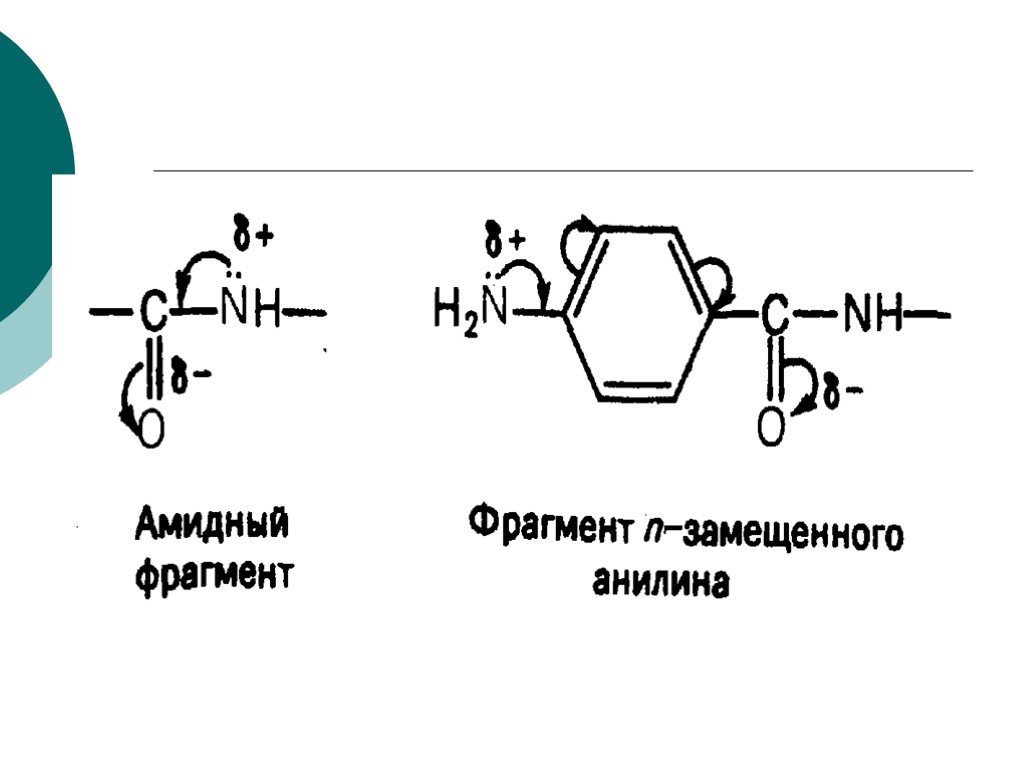
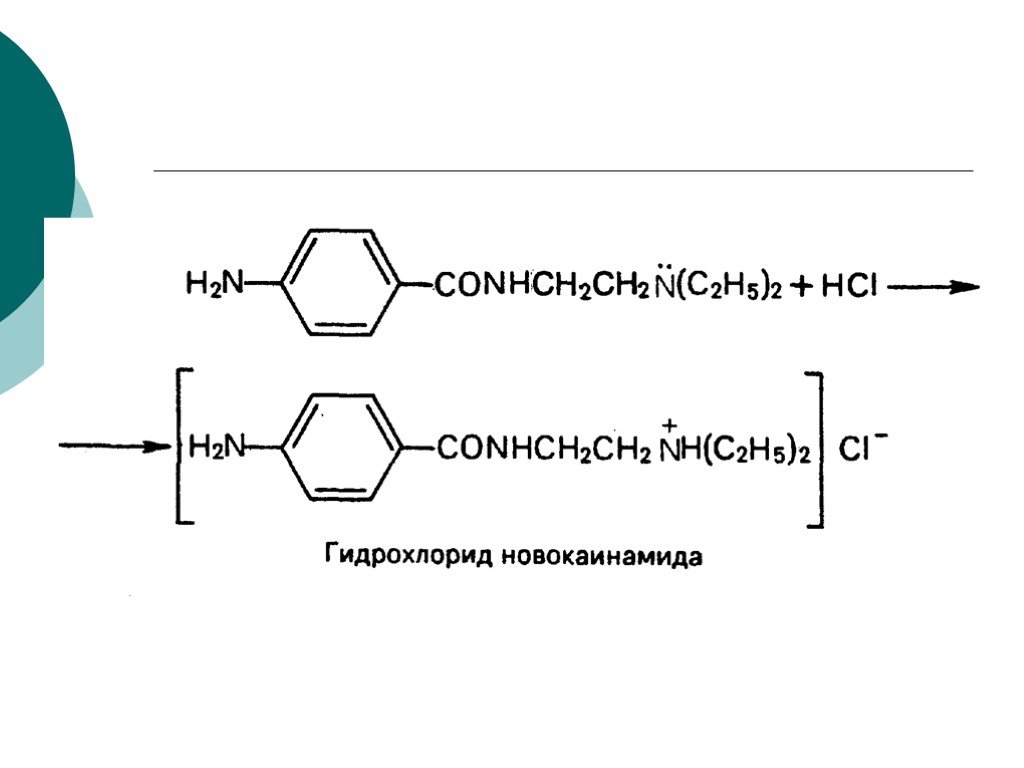
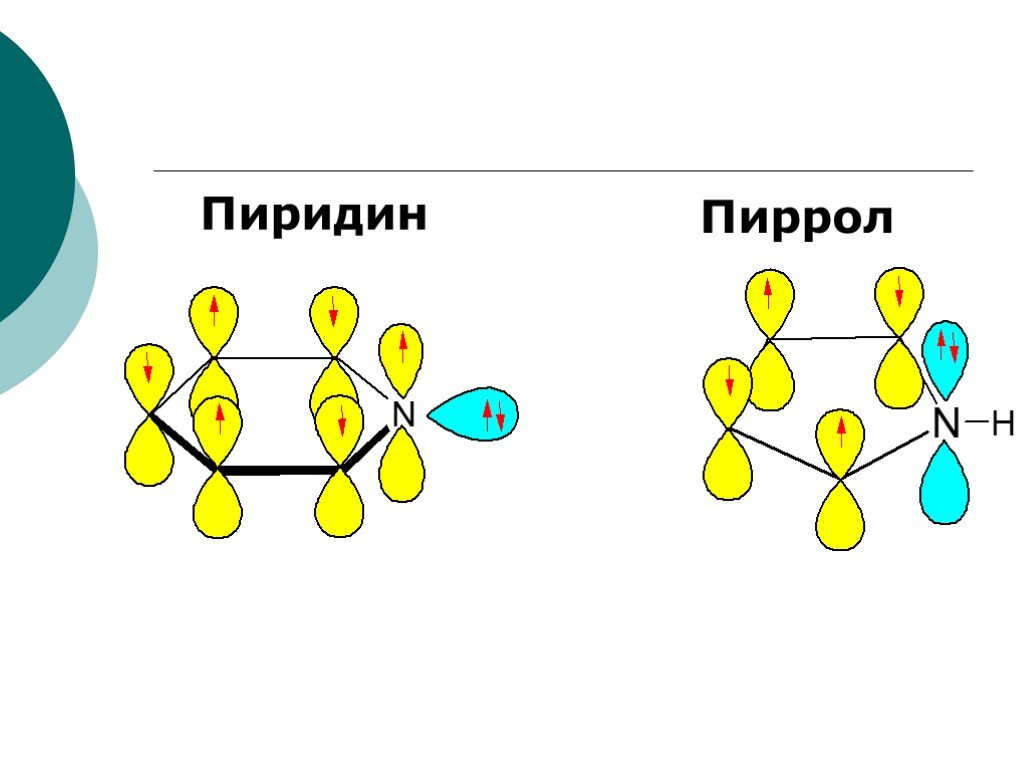
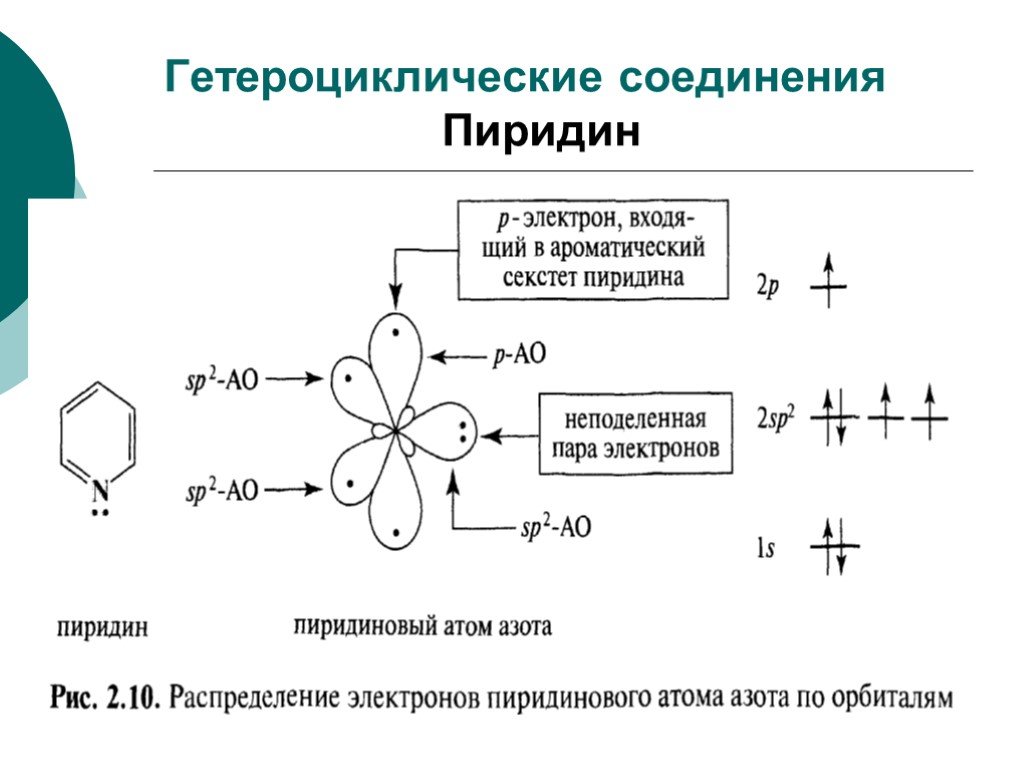
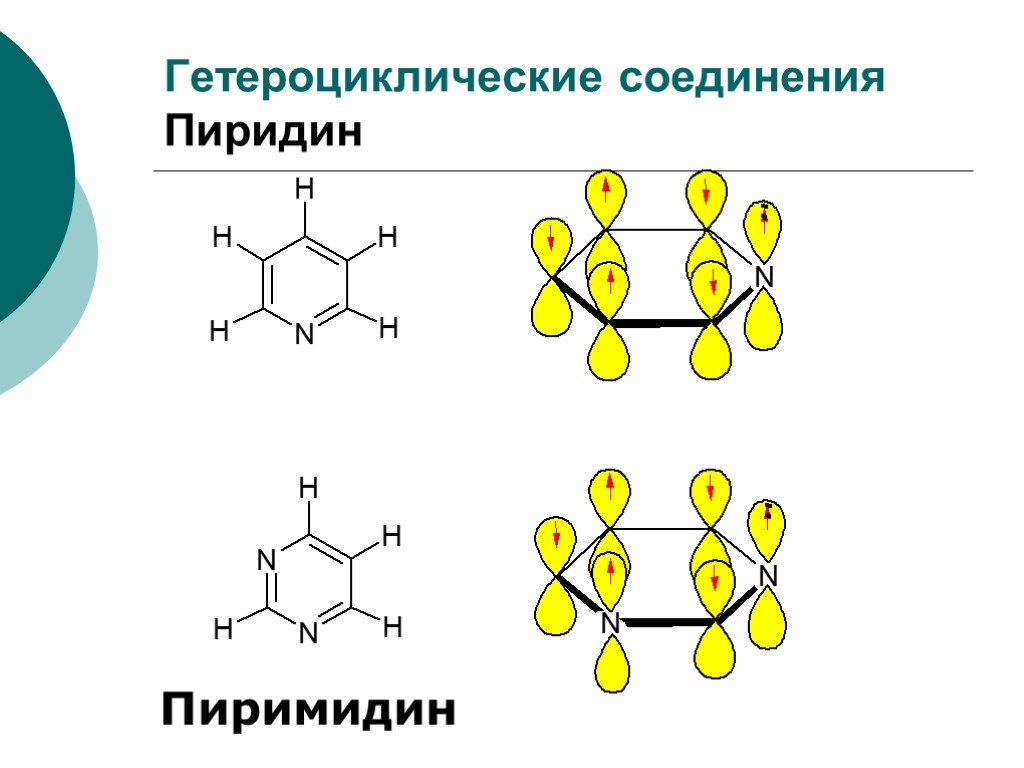
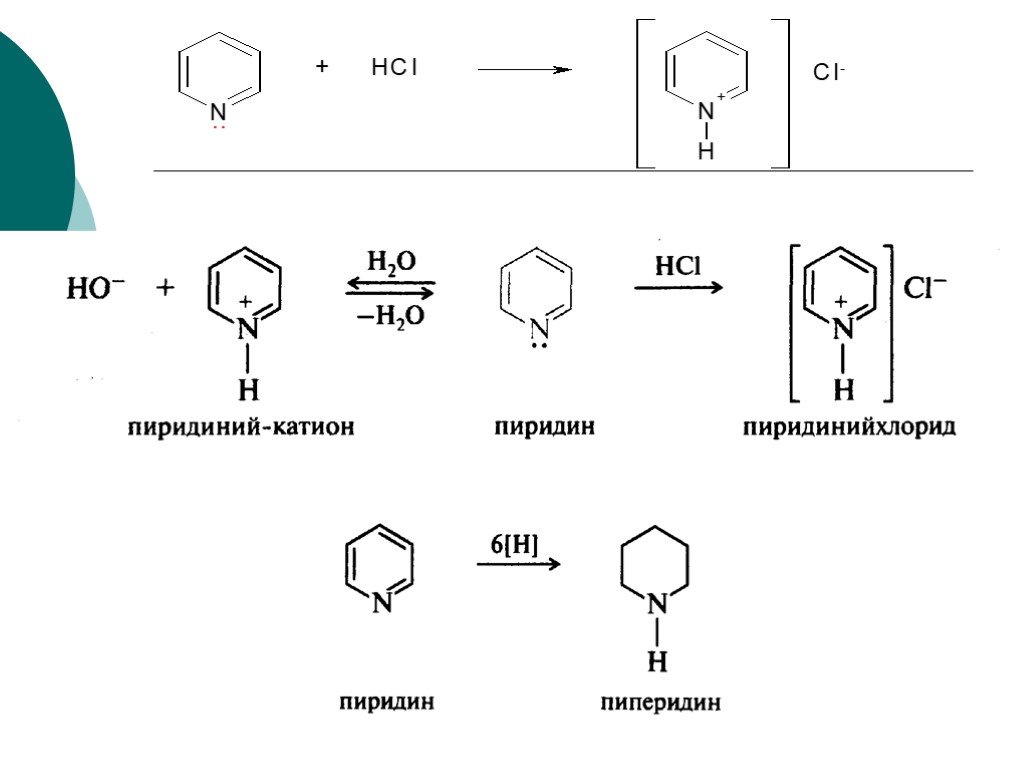













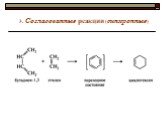
![III. По молекулярности реакции делятся на мономолекулярные и бимолекулярные. A + B AB Мономолекулярная реакция (диссоциативная): v = k [A] v = k [B] Бимолекулярная реакция ( ассоциативная): v = k [A] [B] III. По молекулярности реакции делятся на мономолекулярные и бимолекулярные. A + B AB Мономолекулярная реакция (диссоциативная): v = k [A] v = k [B] Бимолекулярная реакция ( ассоциативная): v = k [A] [B]](https://prezentacii.org/upload/cloud/19/01/119670/images/thumbs/screen16.jpg)