Презентация "Всё об алюминии" по химии – проект, доклад
Презентацию на тему "Всё об алюминии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Все об алюминии
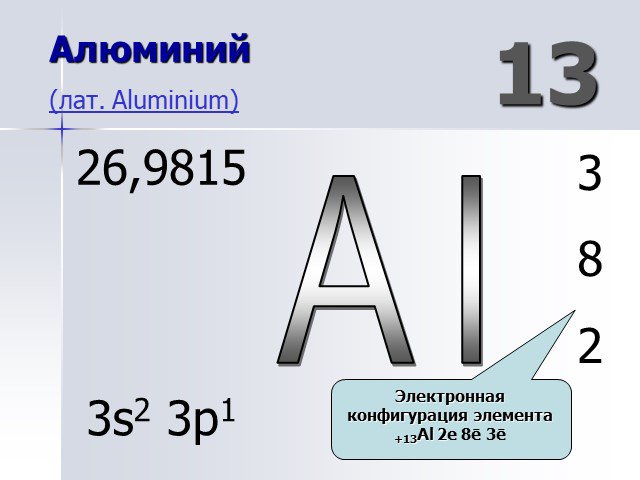
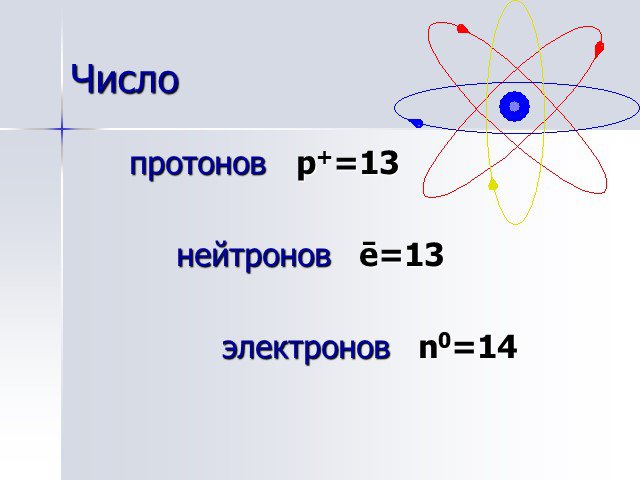
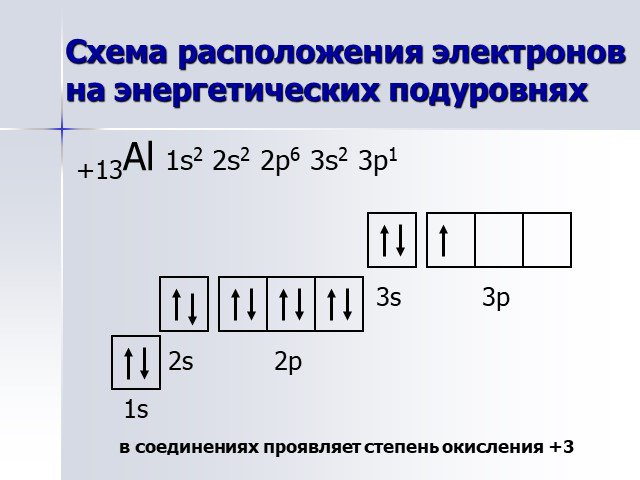
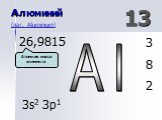
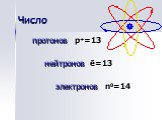
АЛЮМИНИЙ. нахождение в природе. Алюмосиликаты: Глина – Al2O3*nSiO2*mH2O Бокситы – Al2O3*nH2O. Строение атома. 27+13Al 2 8 3 1s22s22p1 *3 3 Al°-3ê ...Понятие об ЭДС
1. Сформировать понятия об электролитах и неэлектролитах. 2. Рассмотреть механизм диссоциации веществ с ковалентной полярной и ионной связью. 3.Ввести ...Понятие об углеводах. Моносахариды. Химические свойства глюкозы
Классификация углеводов. Углеводы Cn(H2O)m Моносахариды Дисахариды Полисахариды. Моносахариды – углеводы, не подвергающиеся гидролизу. триозы тетрозы ...Обобщение сведений об основных классах неорганических веществ
Цель урока. Обобщение и систематизация знаний по основным классам неорганических веществ. Задачи урока. 1)образовательная: а)отработать умение записывать ...Обобщение знаний об углеводородах
Цель:. Повторить и систематизировать знания по теме «Углеводороды». Девиз:. «Мало знать, надо и применять. Мало хотеть, надо и делать» Гёте. Конкурс ...Немного интересного об углеводах
Углеводы моносахариды дисахариды полисахариды. Моносахариды С6Н12О6. Дисахариды С12Н22О11. Полисахариды (С6Н10О5)n. Глюкоза Фруктоза Галактоза. Сахароза ...Мифы и реальность об атоме
Предметные области. Проект охватывает цикл естественнонаучных дисциплин (физика, химия, экология). Актуальность темы. Базовая тема для изучения большинства ...Всё о кремнии
Si 30,9738 Р S 32,064 Сера 16 Cl 17 Al 13 Алюминий 26,982 I 10 Периоды Ряды.Периодическая система химических элементов Д.И.Менделеева.
39,948 24,312 ...
Всё на свете химия!
А что же такое химия? Наука о веществах и превращениях друг в друга. Химия в быту. Химия в быту, сравнительно молодая наука, является нашим незаменимым ...Конспекты
Систематизация знаний об окислительно-восстановительных реакциях и реакциях ионного обмена
Тема урока:. «Систематизация знаний об окислительно-восстановительных реакциях. и реакциях ионного обмена». Класс:. 9. Тип урока. : урок обобщения ...Я знаю об автомобиле….
. Урок - мастерская. (интегрированный урок: физика, химия - 2ч.). 9 класс. . по теме. . . «Я знаю об автомобиле….». Цель урока. :. Непосредственная ...Обобщение сведений об углеводородах
Тема: « Обобщение сведений об углеводородах». Цель:. 1. обобщить и закрепить знания учащихся о различных классах. углеводородов;. продолжить ...Общие представления об органических веществах
IX. класс. . Тема: «ОБЩИЕ ПРЕДСТАВЛЕНИЯ. ОБ ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ». (Урок изучения нового материала). Форма урока:. рассказ учителя и демонстрация ...Обобщение сведений об основных классах неорганических веществ
Урок по химии в 8 классе. . Тема: «Обобщение сведений об основных классах неорганических веществ». . Цель:. обобщение и систематизация знаний ...Обобщение сведений об основных классах неорганических веществ
Стародубова Лилия Васильевна. Учитель химии. МБОУ СОШ №75, г. Нижний Новгород. Урок по химии в 8 классе. . Тема: «Обобщение сведений об основных ...Обобщение и систематизация знаний об элементах: металлах и неметаллах, о видах химической связи
Урок №13. Обобщение и систематизация знаний об элементах: металлах и неметаллах, о видах химической связи. . . Тип урока:. обобщение и закрепление ...Обобщение знаний об основных типах химической реакции
. /8 класс/. Тема урока:. Обобщение знаний об основных типах химических реакций. Цель:. Обобщить и закрепить знания о типах ...Обобще¬ние сведений об основных классах неорга¬нических веществ
Практическое занятие "Экспериментальное решение задач по теме « Обобщение сведений об основных классах неорганических веществ». Цели урока:. Обобщить ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Неизвестен
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию